牛源坏死梭杆菌43K外膜蛋白的黏附特性研究
2023-02-27贺显晶王志慧郭东华
贺显晶,刘 娇,王志慧,武 瑞,郭东华*
(1.黑龙江八一农垦大学动物科技学院,大庆 163319; 2.佳木斯大学,佳木斯 154007)
牛源坏死梭杆菌(Fusobacteriumnecrophorum,Fn)是一种革兰阴性多形杆状专性厌氧菌,是牛肝脓肿、腐蹄病和坏死性喉炎的主要致病菌,同时在奶牛乳房炎和子宫内膜炎的发生中也具有重要作用,在牛群感染中具有普遍性的趋势。细菌黏附宿主细胞是病原菌建立感染的关键步骤,而有关于牛源坏死梭杆菌黏附相关蛋白研究尚属探索阶段,因此深入开展牛源坏死梭杆菌相关黏附蛋白研究,对阐明牛坏死梭杆菌病的致病机制奠定理论基础,也为动物厌氧菌病的机制研究提供参考。
外膜蛋白(outer membrane protein,OMPs)是革兰阴性细菌外膜的主要结构,在细菌黏附宿主细胞中发挥重要作用。坏死梭杆菌根据DNA同源性分为F.necrophorumsubsp.necrophorum(Fnn亚种)和F.necrophorumsubsp.funduliforne(Fnf亚种)[1-2]。不同亚种坏死梭杆菌的OMPs谱存在很大差异,这也解释了不同亚种在毒性及参与坏死梭杆菌感染发病机制方面的差异[3]。43K OMP(43 ku outer membrane protein)是本课题组首次鉴定的Fnn亚种牛源坏死梭杆菌的主要OMPs,其与梭菌属其他成员的OMPs表现出高度的相似性[4]。进一步研究发现,43K OMP在牛源坏死梭杆菌不同分离株中广泛存在[5]。因与坏死梭杆菌同菌属的其他厌氧菌如具核梭杆菌、放线杆菌等对宿主细胞的黏附是由其表面的外膜蛋白介导[2, 6-8]。据此,作者推测43K OMP是牛源坏死梭杆菌的一种重要黏附相关蛋白,在牛源坏死梭杆菌致病中发挥重要作用。目前,有关于牛源坏死梭杆菌43K OMP的功能研究尚属探索阶段,为更好地揭示43K OMP的黏附功能,本研究通过构建43K OMP原核表达系统,进一步研究其对细菌黏附细胞的影响及43K OMP对细胞的黏附作用,为牛源坏死梭杆菌43K OMP的生物学功能拓展研究奠定理论基础。
1 材料与方法
1.1 菌株、细胞及载体
牛源坏死梭杆菌A25菌株(Fusobacteriumnecrophorum,Fnn亚种,ATCC 25286)保存于黑龙江八一农垦大学兽医分子病理学实验室;牛子宫内膜上皮细胞(BNCC 340413)购于北京北纳创联生物技术有限公司;牛乳腺上皮细胞为MAC-T细胞系,鼠乳腺上皮细胞(EpH4-Ev)由吉林大学农学部动物生理教研室惠赠,小鼠肝细胞(AML12 SCSP-550)购于中国科学院干细胞库;pET-32a表达载体、E.coliBL21(DE3)感受态细胞由黑龙江八一农垦大学病理实验室保存;43K OMP多克隆抗体血清、牛源坏死梭杆菌高免血清、43K OMP单克隆抗体、兔阴性血清及鼠阴性血清由黑龙江八一农垦大学兽医分子病理学实验室制备并保存[9-11]。
1.2 主要试剂
细菌基因组DNA提取试剂盒、质粒小提取试剂盒购于天根生物技术有限公司,ExTaqDNA聚合酶购于大连宝生物工程有限公司,DMEM培养基、1640培养基、DMEM/F12培养基、HEPE,LiCl、LDS、SLS、ITS、地塞米松均购于美国Sigma公司,FBS购于CLARK公司,SDS-PAGE凝胶配制试剂盒、DMSO购于索莱宝生物技术有限公司,Alexa Fluor 488标记山羊抗兔IgG、Alexa Fluor 488标记山羊抗鼠IgG购于碧云天生物技术有限公司,辣根过氧化酶标记的山羊抗兔IgG和山羊抗鼠山羊购于武汉三鹰生物技术有限公司,所有引物合成由上海生工生物工程股份有限公司完成。
1.3 细菌的培养
牛源坏死梭杆菌A25菌株在预先还原厌氧的苛养肉汤培养基中37 ℃厌氧培养12 h以上备用。用于重组表达的大肠杆菌BL21 DE3在100 μg·mL-1氨苄青霉素的LB肉汤培养基培养。
1.4 天然43K OMP的提取
参照王志慧[9]和徐晶(Xu)等[12]的方法提取牛源坏死梭杆菌天然43K OMP。牛源坏死梭杆菌A25菌株1∶100接种于FAB液体中厌氧培养至OD600nm为0.6~0.8时,将500 mL菌液用无菌的生理盐水清洗3次,5 000×g离心5 min,将菌液沉淀用50 mL无菌的PBS(pH=7.2)重悬后置于冰水混合物中,功率60 W,超声时间6 s,间歇6 s进行超声破碎1 h。将菌液混合物4 ℃,3 000×g离心30 min,收集上清。收集的上清进行4 ℃,12 000×g离心30 min,收集沉淀。将沉淀用50 mL 0.5%的SLS重悬后,室温孵育30 min,4 ℃,12 000×g再次离心30 min,弃上清取沉淀。将沉淀用25 mL 2% LDS的20 mmol·L-1的HEPEs-LiCl(pH=7.4)重悬后,4 ℃孵育30 min。提取液经4 ℃,12 000×g离心30 min,收集沉淀。将沉淀用2 mL 20 mmol·L-1的HEPEs混合均匀,分装,提取后的天然43K OMP经SDS-PAGE分析后,43K OMP重组蛋白的表达纯化复性及OMP的去内毒素处理由北京海盖德科技有限公司完成。
1.5 43K OMP重组蛋白的表达与纯化
参照课题组前期的方法进行克隆表达牛源坏死梭杆菌43K OMP基因[10-11],参照牛源坏死梭杆菌H05菌株43K OMP基因序列(GenBank accession No.JQ740821.1)PCR扩增43K OMP基因,在序列的5′端和3′端加入BamHⅠ和XhoⅠ两种酶切位点,随后克隆连接至表达载体pET-32a上,将pET-32a-43K OMP质粒转化入大肠杆菌BL21 DE3细胞中。将携带pET-32a-43K OMP质粒的大肠杆菌BL21 DE3细胞标记为H2019,将H2019经IPTG(浓度为1 mmol·L-1)37 ℃诱导表达4 h,超微破碎后,应用蛋白纯化试剂盒对重组蛋白进行纯化,将纯化后的重组蛋白进行Western blot鉴定。重组蛋白纯化及复性委托北京海盖德科技有限公司完成。
1.6 H2019与细胞的黏附试验
分别将牛子宫内膜细胞、MAC-T细胞、鼠乳腺上皮细胞及鼠肝细胞接种于6孔板,5%CO2培养箱,37 ℃培养至密度为90%以上,弃培养液,PBS洗3次。H2019和pET-32a载体的大肠杆菌 BL21 DE3细胞经IPTG 37 ℃诱导3 h后,PBS离心洗3次后,通过麦氏比浊法用不含双抗的细胞培养基将菌液浓度为1×107CFU·mL-1备用。将各孔与IPTG诱导的H2019和pET-32a载体的大肠杆菌 BL21 DE3细胞37 ℃孵育1 h,弃培养液,PBS洗3~5次,每次3 min,加入1%TritonX-100的PBS 10 min,吸取悬液倍比稀释后,在含有氨苄抗性的LB固体培养基上37 ℃孵育过夜,菌落计数,每个处理3个重复。
1.7 天然蛋白竞争试验
将细胞接种于6孔板中(1×107·mL-1),5%CO2培养箱,37 ℃培养至密度为90%以上,每孔加入提取并去内毒素的牛源坏死梭杆菌天然43K OMP(100 μg·孔-1)37 ℃孵育1 h。PBS清洗3次,以去除未黏附的OMP。诱导表达的H2019菌液经PBS清洗3次后,用加入10%FBS的细胞培养基重悬,与细胞37 ℃共孵育1 h。PBS清洗后收集细胞悬液倍比稀释后计数。未与OMP共孵育的细胞作为对照组。每个处理重复3次。
1.8 抗体抑制试验
将H2019在37 ℃经IPTG诱导3 h后,PBS清洗,用10%FBS的细胞培养基重悬。将1 mL的细菌悬液按照1∶200和1∶50的浓度加入43K OMP多抗或单抗37 ℃摇床内孵育1 h。将细胞接种于6孔板中(1×107·mL-1),5%CO2培养箱中,37 ℃培养至密度为90%以上,经PBS清洗后与细菌悬液共孵育1 h。同时设置阴性血清对照组和细菌对照组。PBS清洗3~5次,进行菌落计数。每个处理重复3次。
1.9 蛋白水解试验
将细胞接种于6孔板中,待细胞生长密度至90%左右。将H2019在37 ℃经IPTG诱导2 h后,分成4等份,分别与蛋白酶K(0、25、50、100 μg·mL-1)37 ℃孵育2 h,PBS清洗3次后,用10% FBS的细胞培养基重悬后,与细胞共孵育1 h,PBS清洗3~5次,以去除未黏附的细菌后进行菌落计数。每个处理重复3次。
1.10 43K OMP对细胞的黏附试验
将牛子宫内膜细胞或MAC-T细胞消化按照1×107·mL-1浓度接种于6孔板,37 ℃培养24 h后,细胞生长密度为85%左右,PBS漂洗细胞3次,4%多聚甲醛4 ℃过夜固定,PBST漂洗3次,除去多余的固定液。3%BSA室温封闭2 h,PBST充分漂洗3次。试验组加入重组蛋白或天然43K OMP(终浓度为50 μg·孔-1),同时只加PBS的孔作为阴性对照组,室温孵育1 h。孵育结束后,PBST充分漂洗3次,去除未黏附的蛋白和培养基。加入43K OMP单克隆抗体(稀释度为1∶800)室温孵育1 h,PBST充分漂洗3次,去除游离抗体,加入Alexa Fluor 488标记的二抗(1∶500稀释),37 ℃孵育1 h,PBST充分漂洗3次,倒置荧光显微镜下观察43K OMP蛋白与细胞是否黏附及结合位置。
1.11 数据分析
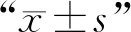
2 结 果
2.1 43K OMP的诱导表达
H2019经IPTG诱导后,菌体超声破碎物经SDS-PAGE分析显示,在59 ku出现特异性的表达条带,表明43K OMP蛋白成功表达,且目的蛋白以包涵体形式存在于菌体沉淀中(图1A)。纯化蛋白经Western blot鉴定,在59 ku处出现明显的目的条带(图1B)。

A.43K OMP重组蛋白的诱导表达(1.蛋白质相对分子质量标准;2.诱导后pET-32a超声破碎上清;3.诱导后pET-32a超声破碎沉淀;4.诱导后H2019超声破碎上清;5.诱导后H2019超声破碎沉淀);B. 43K OMP重组蛋白的Western blot鉴定
2.2 H2019对细胞的黏附试验结果
黏附试验结果表明,与空载体对照组孵育的细胞相比,当牛子宫内膜细胞、MAC-T细胞、鼠乳腺上皮细胞、鼠肝细胞与诱导的H2019共孵育后,细胞黏附的细菌数量均极显著增加(P<0.01)(图2)。

A. BEND;B. MAC-T;C. MMECs;D. AML12; **. P<0.01, ****. P<0.000 1
2.3 天然43K OMP对H2019黏附宿主细胞的影响
与未加入天然43K OMP蛋白的对照组相比,当牛子宫内膜细胞、MAC-T细胞、鼠乳腺上皮细胞、鼠肝细胞与天然蛋白预孵育后,黏附于细胞上的H2019数量极显著降低(P<0.01)(图3)。
A. BEND;B. MAC-T;C. MMECs;D. AML12; ***. P<0.001, ****. P<0.000 1
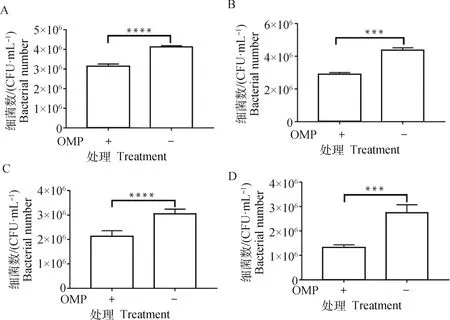
H2019与43K OMP多抗共孵育后,黏附于牛子宫内膜细胞、MAC-T细胞、鼠乳腺上皮细胞和鼠肝细胞上的H2019数量极显著降低(P<0.01),且在牛子宫内膜细胞降低趋势更显著,而阴性血清组与对照组无显著性差异(P>0.05)(图4)。

A. BEND;B. MAC-T;C. MMECs;D. AML12; **. P<0.01, ****. P<0.000 1
当H2019与43K OMP单抗共孵育后,黏附于牛子宫内膜细胞、MAC-T、鼠乳腺上皮细胞和AML12细胞的H2019数量呈现不同程度的降低(P<0.05),而阴性血清组与对照组无显著性差异(P>0.05)(图5)。
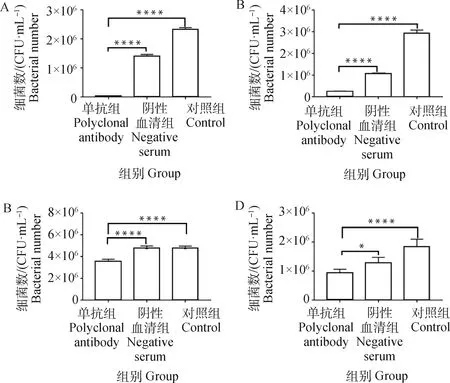
A. BEND;B. MAC-T;C. MMECs;D. AML12; *. P<0.05, ****. P<0.000 1
2.4 蛋白酶K对H2019黏附宿主细胞的影响
将诱导表达43K OMP的H2019与不同浓度的蛋白酶K(0、25、50、100 μg·mL-1)孵育,SDS-PAGE分析显示:表达的43K OMP量被蛋白酶K按剂量依赖性的方式消化降解(图6 A)。同时黏附试验也显示了黏附于牛子宫内膜细胞、MAC-T细胞、鼠乳腺上皮细胞和鼠肝细胞的H2019数量也呈现剂量依赖性降低(图6B、C、D和E)。

A. 蛋白酶K对H2019诱导表达的影响(1.蛋白质相对分子质量标准;2~5. 蛋白酶K浓度 0、100、50、25 μg·mL-1);B~E. 蛋白酶K对H2019黏附牛子宫内膜细胞 (B)、MAC-T细胞(C)、鼠乳腺上皮细胞 (D) 和AML12细胞 (E) 的影响。**. P<0.01, ****. P<0.000 1
2.5 43K OMP对细胞的黏附作用
将牛乳腺上皮细胞、子宫内膜细胞分别与43K OMP重组蛋白、天然43K OMP蛋白共孵育,间接免疫荧光结果显示,43K OMP重组蛋白或天然蛋白组均发出明显的绿色荧光,而对照组无荧光出现,表明牛源坏死梭杆菌43K OMP能黏附牛子宫内膜细胞和乳腺上皮细胞,且绿色荧光分布轮廓与细胞形态相似(图7)。

扫描文章首页OSID码可查看彩图
3 讨 论
细菌黏附宿主细胞是细菌定植和侵袭的先决条件,细菌对宿主细胞的特异性黏附是病原菌感染的重要步骤。牛源坏死梭杆菌作为条件致病菌,对瘤胃上皮细胞及肝窦内的血管内皮细胞、蹄部损伤的皮肤组织细胞、乳腺上皮细胞和子宫内膜细胞的黏附是牛肝脓肿、腐蹄病、乳房炎及子宫内膜炎等疾病感染的重要步骤。在梭杆菌属中,OMPs对坏死梭杆菌的黏附和感染至关重要。与牛源坏死梭杆菌同菌属的具核梭杆菌中,OMPs在细菌黏附细胞、细菌共聚及生物膜形成中发挥重要作用。其中,RadD能结合变形链球菌SpaP,介导其与变形链球菌或酵母念珠菌的共聚[13-15]。FadA促进具核梭杆菌黏附KB、CHO细胞和胎盘内皮细胞[16-17],增强牙龈卟啉单胞菌和放线菌的黏附入侵能力[18-19]。Fap2蛋白促进具核梭杆菌与癌细胞的识别和结合是直肠癌发病的重要机制[20]。而与43K OMP同源性高的具核梭杆菌FomA蛋白在具核梭杆菌黏附宿主细胞和外膜囊泡致病机制中发挥重要作用[21-23]。因此,推断43K OMP在牛源坏死梭杆菌上黏附内皮细胞具有潜在作用。
在有关于牛源坏死梭杆菌黏附机制的相关研究中,早期认为牛源坏死梭杆菌能通过血凝素黏附于Vero表面,且牛源坏死梭杆菌黏附瘤胃上皮细胞也与血凝素相关[24-25]。通过抗血凝素血清能降低牛源坏死梭杆菌与兔、鼠等易感动物细胞的黏附[26]。近年来,有学者发现胰酶能显著降低坏死梭杆菌黏附肾上腺血管内皮细胞的能力,表明介导坏死梭杆菌黏附细胞的是蛋白质,推测起作用的可能是OMPs[27]。同时,对Fnn亚种和Fnf亚种坏死梭杆菌的OMPs进行系统研究,发现相对分子质量为17、24、40和74 ku的OMPs可能与坏死梭杆菌黏附细胞有关,且40 ku大小的OMP在坏死梭杆菌黏附细胞中可能发挥重要作用[27-30]。43K OMP是首次在牛源坏死梭杆菌临床分离株H05鉴定的,本课题组前期发现43K OMP对牛源坏死梭杆菌黏附BHK-21细胞上具有一定作用[10,31-32]。同时,应用重组纯化的43K OMP免疫小鼠,发现43K OMP具有一定的保护性,且43K OMP与牛源坏死梭杆菌Lkt和Hly截短表达蛋白PL-4和H2共同制备的亚单位疫苗保护性更好[33]。
本研究中,以牛子宫内膜细胞、乳腺上皮细胞、鼠乳腺上皮细胞和鼠肝细胞为细胞模型,为进一步验证牛源坏死梭杆菌43K OMP对不同宿主细胞的黏附特性,将43K OMP基因克隆到pET-32a载体中,随后在大肠杆菌BL21DE3细胞上表达该蛋白。当携带重组质粒(H2019)的大肠杆菌经IPTG诱导表达后,与细胞的黏附显著增加,显示43K OMP的表达对细菌黏附具有促进作用。细胞与天然蛋白共同孵育,细菌与多抗或单抗共孵育后,H2019黏附细胞的数量明显降低,天然蛋白或抗体可以降低细胞与H2019的结合。其机制可能是天然蛋白竞争了细胞上的结合位点,抑制H2019与细胞的结合;而抗体中和了H2019表达的43K OMP,降低H2019对宿主细胞的黏附。同时也发现43K OMP的多抗或单抗并不能完全抑制H2019对细胞的黏附,提示牛源坏死梭杆菌中还存在未发现的其他黏附相关蛋白。而多抗的抑制效果明显好于单抗与不同抗体的抗原表位差异存在一定的关系。经不同浓度的蛋白酶K处理后,蛋白酶K降解了表达的43K OMP,随之H2019黏附数量呈剂量依赖性降低。间接免疫荧光结果也显示了天然43K OMP和重组蛋白均能特异性黏附于细胞膜表面。因此,43K OMP是牛源坏死梭杆菌的一种重要黏附素,有助于促进牛源坏死梭杆菌对宿主细胞的黏附和定植。但43K OMP介导牛源坏死梭杆菌黏附机制尚未可知,43K OMP是通过宿主细胞表面的受体蛋白互作介导细菌黏附,还是与细胞的多糖作用介导细菌黏附尚未可知,还需要人们进一步研究。深入研究43K OMP介导牛源坏死梭杆菌的黏附机制,将对阐明牛源坏死梭杆菌致病机制具有重要意义。
4 结 论
43K OMP是牛源坏死梭杆菌的一种重要黏附蛋白,在牛源坏死梭杆菌黏附宿主细胞中发挥重要作用。
