姜黄素调控肠道菌群及抗病毒作用研究进展
2023-02-27卓儒浩柳清扬
卓儒浩,柳清扬,钟 翔*
(1.南京农业大学动物科技学院,南京 210095; 2.南京农业大学生命科学学院,南京 210095)
作为肠道微生物屏障中的关键组成部分,肠道菌群及其代谢产物在调节宿主肠道免疫系统和维持肠道稳态中起着重要的作用。然而,在现代畜牧养殖生产中,由于抗菌药物的不规范使用及管理不当极易导致畜禽肠道菌群多样性降低、易位和紊乱[1],增加了病原微生物感染的可能性,进而引发畜禽腹泻。传统上,抗生素往往被用于治疗肠道菌群失调引发的疾病,但滥用抗生素会导致药物残留、耐药致病菌产生和肠道益生菌减少,目前已经被禁止在饲料中添加使用。因此,开发绿色、安全、高效的饲料添加剂成为了发展高效优质畜牧业的当务之急。
作为天然的植物提取物,姜黄素是从姜科植物姜黄的根茎中提取的一种酸性多酚类化合物,具有抗肿瘤、抗氧化、抗炎症、抗细菌和抗病毒等多种免疫调节特性,已被广泛应用于食品、化妆品、制药和饲料加工等领域[2-4]。目前,姜黄素因其广谱的抗病毒作用和巨大的治疗潜力,正受广泛关注。值得注意的是,姜黄素被证实可通过改变肠道菌群的组成和数量来帮助动物抵御某些疾病,改变动物生理状况,促进动物机体健康[5]。此外,近年来越来越多的研究表明,姜黄素在多种人类和畜禽致病病毒感染中发挥了强大的抵御或灭活作用[6]。同时多项研究表明,姜黄素具有抵抗新冠病毒侵染的潜力[7-8],提示姜黄素具有开发成为新型特异性抗病毒药物的巨大潜力。因此,本文重点探讨了姜黄素在调控肠道菌群以及抗病毒方面的作用机制,以期为开发基于姜黄素的新型饲料添加剂和抗病毒药物提供理论依据。
1 姜黄素的理化特性
姜黄素是一种亲脂性多酚,是姜黄经溶剂萃取和结晶纯化提取后得到的产品,化学结构式为C21H20O6,相对分子质量为368.37,熔点为183 ℃,呈黄色结晶状。姜黄素难溶于水,但易溶于丙酮、二甲亚砜和乙醇等有机溶剂[9]。从结构上看,姜黄素分子是由α,β-不饱和羰基连接的两个对称相似的芳香环组成,并含有共轭双键,可以作为有效的电子供体来阻碍氧化还原反应中活性氧的产生[4,10](图1)。此外,姜黄素具有良好的安全性和耐受性,甚至成年人在摄入高达12 g·d-1的剂量下也几乎没有任何毒性,美国食品和药物管理局将其归类为“公认为安全”级别[11-12]。然而,姜黄素具有的高度疏水性、不稳定性和代谢速度快等特点造成机体吸收不良,导致姜黄素在体内的系统生物利用度较低[2]。因此,提高姜黄素的生物学利用率会是将来的一个研究方向。
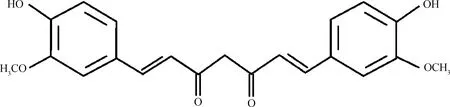
图1 姜黄素的分子结构
2 姜黄素的生物学功能
既往研究表明,姜黄素具有广泛的生物学功能,包括抗氧化、抗炎症、抗肿瘤等。氧化应激是癌症、糖尿病、心脑血管疾病、神经细胞损伤、组织缺氧等多种疾病的诱因。作为天然的抗氧化介质,姜黄素能有效地清除细胞内的活性氧(ROS)和活性氮(RNS),并通过调节谷胱甘肽(GSH)、过氧化氢酶(CAT)和超氧化物岐化酶(SOD)的活性来抑制氧化应激[13]。最近,姜黄素被报道能缓解大鼠肝组织的氧化损伤[14]。机制上,姜黄素的抗氧化作用主要归因于其对Keap1-Nrf2通路的调控[15]。同时,姜黄素还具有下调细胞炎症因子水平从而缓解机体炎症的作用。Valizadeh等[16]研究发现,姜黄素能显著降低新型冠状病毒肺炎(COVID-19)患者血清中促炎因子IL-1β和IL-6的表达水平。此外,姜黄素对NF-κB通路的抑制可进一步抑制促炎因子的转录和前转移酶的表达[17]。值得注意的是,姜黄素被证实通过参与血管生成、突变、细胞周期调控、细胞凋亡以及肿瘤发生和转移等多种途径发挥抗肿瘤作用[13]。Chang等[18]研究表明,肿瘤内注射姜黄素能在一定程度上抑制肿瘤生长,降低肿瘤微血管密度。近年来,姜黄素与微生物的互作和抗病毒功能已逐渐成为新兴研究热点,因此,后文将重点探讨姜黄素在肠道菌群和抗病毒方面的作用机制。
3 姜黄素与肠道菌群的相互作用
众所周知,肠道菌群通过合成维生素、协助消化和缓解应激等来保障宿主健康,特别是在代谢方面。虽然姜黄素摄入后在血浆和组织中的系统生物利用度低,但有趣的是,口服后在肠道内检测到高度积累的姜黄素[19],这表明姜黄素在体内的主要作用场所是肠道,或许直接与肠道菌群产生相互作用。此外,先前的研究已经证实姜黄素能改善肠黏膜完整性,调节肠道屏障[20]。因此,姜黄素与肠道菌群之间的作用机制或许能解释姜黄素在体内较低的系统生物利用度与发挥广泛的生物学活性之间的矛盾,这将是一个富有吸引力的新兴研究领域。
3.1 姜黄素对肠道菌群的调控
近年来,越来越多的证据显示,姜黄素通过改变肠道菌群的多样性和抑制致病菌增殖在肠道水平发挥正向调控作用。在一项针对阿尔兹海默病(Alzheimer’s disease, AD)的研究中,研究人员发现,姜黄素能直接影响APP/PS1转基因AD小鼠肠道菌群的相对丰度和多样性[21]。在连续口服3个月高剂量(200 mg·kg-1)姜黄素后,小鼠肠道菌群的多样性呈现增加的趋势。同时普雷沃氏菌科、拟杆菌、大肠杆菌和志贺菌等被报道与AD发展相关的关键细菌种属的相对丰度显著降低[21],提示姜黄素对肠道菌群的调控可能间接有助于AD的治疗与恢复。此外,Zhang等[22]研究发现,姜黄素可直接影响去卵巢大鼠肠道菌群的分布与数量。切除卵巢后引起的雌激素缺乏可导致大鼠体重显著增加并改变其肠道菌群分布和结构,而姜黄素能显著降低去卵巢大鼠的体重。进一步研究发现,添加姜黄素显著改变了去卵巢大鼠肠道内沙雷氏菌、厌氧棍状菌、希瓦氏菌、假单胞菌、乳头杆菌、微小杆菌和幽门螺杆菌等7种细菌种属的数量[22]。因此,姜黄素可能通过部分逆转切除卵巢后因雌激素缺乏引起的肠道菌群多样性的改变,从而预防去卵巢动物体重的增加。在连续口服15 d 100 mg·kg-1姜黄素后,野生型小鼠肠道菌群的丰富度和多样性呈现降低的趋势[23]。研究人员发现,姜黄素显著降低了小鼠肠道内普雷沃氏菌科的相对丰度,但显著提高了拟杆菌科和理研菌科的相对丰度[23]。类似地,还有研究表明,姜黄素可抑制断奶仔猪肠道内大肠杆菌、肠球菌和梭状芽胞杆菌等致病菌的增殖,提高乳酸杆菌和双歧杆菌等益生菌的相对丰度[5]。机制上,姜黄素通过增加肠道菌群的多样性,改变肠道致病菌和益生菌的比例,进而下调肠道内TLR4的表达水平,抑制炎症因子IL-1β和TNF-α的分泌,最终缓解断奶应激导致的肠道炎症。
在部分疾病动物模型上的研究揭示了姜黄素可作为一种安全有效的新治疗策略,特别是在调控畜禽肠道菌群方面。Xun等[24]发现,向口服肠毒素大肠杆菌的断奶仔猪日粮中添加300 mg·kg-1姜黄素可以抑制大肠杆菌诱导的炎症因子IL-1β的产生,同时促进机体免疫球蛋白sIgA的分泌。这可能与姜黄素抑制病原体侵袭时回肠中巨噬细胞的数量与功能活性有关。最近,Zhai等[25]报道了姜黄素对赭曲霉毒素A(OTA)诱导的肝氧化损伤的影响。以北京鸭为动物模型,研究发现,OTA可显著改变盲肠内拟杆菌和产丁酸菌的相对丰度,而添加姜黄素可恢复OTA引起的肠道菌群组成和代谢的紊乱。因此,研究人员推测,姜黄素可能通过调节肠道菌群来减轻OTA诱导的肝氧化损伤[25]。作为一种食源性病原体,鼠伤寒沙门菌感染可影响肉鸡的生产性能,甚至导致较高的死亡率。在一项鼠伤寒沙门菌感染的肉鸡模型中,姜黄素被证实抑制了鼠伤寒沙门菌在肠道内的定植[26]。进一步研究发现,姜黄素显著提高了盲肠内梭状芽胞杆菌、粪杆菌和肠球菌的相对丰度,增加了肠道菌群的多样性。该研究提示,姜黄素抑制鼠伤寒沙门菌感染并维持肠道稳态的治疗作用或许也是通过调控肠道菌群实现的。此外,针对非酒精性脂肪肝(NAFLD)的研究表明,高脂日粮诱导的NAFLD大鼠的肠道菌群结构显著改变,但姜黄素治疗可部分逆转这一改变[27]。值得注意的是,研究证实姜黄素选择性地调节特定的细菌种属,显著提高了包括乳酸杆菌和7种产短链脂肪酸菌在内的与减轻肝组织重量和改善肠黏膜完整性相关的关键细菌的相对丰度,同时导致瘤胃球菌和粪球菌等与肥胖和糖尿病发展相关的细菌数量减少[27]。由此可见,姜黄素可能以肠道菌群作为主要调控靶点,治疗NAFLD诱导的肝脂肪变性。支持这一推论的是,姜黄素直接作用于肠道菌群,显著提高了产短链脂肪酸菌的相对丰度,并随着粪便丁酸水平的升高,最终抑制了结肠炎的发展[28]。
除了改变动物肠道菌群的结构与分布,最近一项双盲、随机、安慰剂对照的临床试点试验揭示了姜黄素对人类肠道菌群的直接影响。根据Peterson等[29]的试验数据,在安慰剂组中,细菌种类减少了15%,而服用姜黄素后细菌种类呈现高达69%的增加。尽管不同受试者的肠道菌群对姜黄素治疗的反应不一致,但对治疗有反应的受试者体内梭状芽胞杆菌、拟杆菌、柠檬酸杆菌、克罗诺杆菌、肠杆菌、肠球菌、克雷伯氏菌、副拟杆菌和假单胞菌的数量均呈现一致的增长,同时几种布鲁菌和大多数瘤胃球菌的相对丰度降低[29]。然而,另一项人体试验结果表明,姜黄素治疗虽然改善了消化不良患者的胃肠道症状和焦虑水平,但与胃肠道疾病发展相关的几种肠道细菌并未受到显著影响[30]。尽管这些临床试验结果存在争议,但它们确实强调了探究姜黄素潜在疗效的临床干预研究的复杂性。因此,未来的研究需要进一步阐明姜黄素的具体作用机制,特别是在剂量和治疗时间方面。
综上所述,姜黄素对肠道菌群的直接调控作用主要体现在改变肠道菌群的组成和数量方面。通过选择性地改变致病菌和益生菌的相对丰度从而缓解宿主的各类疾病或许是姜黄素发挥其广泛药理特性的潜在机制。
3.2 肠道菌群对姜黄素的影响
鉴于广泛参与宿主体内多种营养代谢反应并可产生大量微生物酶进行代谢,肠道菌群实际上可以被认为是宿主肠道内一种高效的生物反应器[4]。近年来,越来越多的研究发现,肠道菌群在姜黄素的代谢与转化过程中发挥了关键作用,证实了肠道菌群与姜黄素之间存在双向作用。事实上,除了通过肠上皮细胞或肝细胞产生的酶,姜黄素还可以通过肠道菌群产生的酶进行代谢与转化,从而产生一系列具有生物活性的化合物[31]。至少有6种肠道细菌可以代谢姜黄素,包括假小链双歧杆菌、长双歧杆菌、粪肠球菌、大肠杆菌、干酪乳酸杆菌和嗜酸乳酸杆菌等[32]。其中,大肠杆菌具有最高的姜黄素代谢活性。机制上,大肠杆菌产生的姜黄素/二氢姜黄素还原酶在NADPH的辅助下先将姜黄素还原为二氢姜黄素,再以相同原理将二氢姜黄素转化为四氢姜黄素[33]。此外,Lou等[34]应用超高效液相色谱结合四极杆飞行时间串联质谱技术,在体外探讨了人类肠道菌群对姜黄素的影响。令人惊讶的是,姜黄素被肠道菌群广泛转化,产生的姜黄素代谢产物高达23种。对这些代谢产物进一步鉴定分析,发现去甲氧基化、还原、羟基化、去甲基化和乙酰化是肠道菌群代谢姜黄素的主要途径[34]。类似地,研究人员从小鼠粪便中分离得到的1株芽孢杆菌DCMB-002能通过还原、羟基化、去甲基化和去甲氧基化等途径转化姜黄素,并产生了7种具有适度抗氧化活性的代谢产物,其中6种为首次报道[35]。
姜黄素在体内的代谢转化的过程主要分为两个阶段[11, 36]。在第一阶段,肠道菌群将姜黄素转化为3种代谢产物,分别是四氢姜黄素、六氢姜黄素和八氢姜黄素;在第二阶段,姜黄素通过与第一阶段的代谢产物共轭耦合,最终转化成相应的能与葡萄糖苷酸和O-硫酸盐共轭耦合的代谢产物。同时,肠道菌群可以解耦第二阶段的无活性代谢产物,将其转化为相应的第一阶段活性代谢产物以及阿魏酸等部分裂变产物[36]。葡萄糖苷酸化是姜黄素及其代谢产物的主要共轭途径,而六氢姜黄素葡萄糖苷酸通常作为姜黄素在体液、器官和细胞中的主要代谢产物[36]。大量研究表明,姜黄素的代谢产物具有类似甚至优于姜黄素的生物活性和效力。作为重要的姜黄素代谢产物,四氢姜黄素已被证实通过调节神经炎症和降低氧化应激来预防和治疗神经退行性疾病,并具有抗癌特性[37]。此外,肠道菌群转化产生的去甲基姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素等多种姜黄素代谢产物已经表现出显著的神经保护作用[21]。重要的是,相比于姜黄素自身,这些代谢产物具有更高的生物利用度[38],可能有助于增强姜黄素的临床疗效。因此,理应将这些代谢和降解产物考虑为姜黄素发挥其药理活性的主要介质。
总之,目前的研究清楚地阐明了肠道菌群对姜黄素的转化与代谢具有深远的影响。更重要的是,这种影响是产生姜黄素活性代谢产物的关键。姜黄素在体内发挥的多种生物学活性可能与肠道菌群促进其代谢产物的产生密切相关。然而,需要考虑的是,姜黄素的代谢依赖于个体的肠道菌群,个体的差异性将影响姜黄素的有益作用。因此,未来的研究需要深入探讨肠道菌群代谢姜黄素的具体机制,以获得更多具有医学参考价值的姜黄素代谢产物。
4 姜黄素的抗病毒作用
事实上,由各类病毒感染引发的病毒性疾病一直是危害全球人类和畜禽健康的重要因素。然而,当前针对大多数病毒性疾病的治疗策略缺乏稳定的持久性和高效性[6]。同时,鉴于病原对现有药物耐药性的出现和部分治疗方法成本昂贵,寻找和开发新型抗病毒药物成为目前医药领域的重要挑战之一。近年来,越来越多的证据指出,天然化合物是新型抗病毒药物的可持续来源。姜黄素作为一种植物来源的化合物,由于具有多种药用特性,在亚洲传统医学中已被广泛应用于皮肤病、感染、肝病和抑郁症等疾病的治疗[11]。自上个世纪姜黄素被发现具有抗病毒活性以来,已有大量研究报道了姜黄素在抵抗不同病毒科的病毒感染中发挥的关键作用(图2)。在此,本文重点关注姜黄素的抗病毒作用及其相关机制。
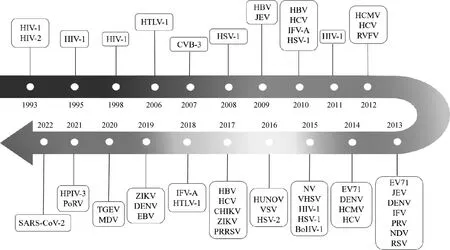
图2 姜黄素抗病毒研究进展
4.1 直接抗病毒作用
4.1.1 抑制病毒吸附 众所周知,病毒感染宿主细胞的过程主要分为吸附、侵入、复制和释放这4个阶段。近年来,越来越多的试验指出,姜黄素在病毒感染的早期通过抑制包膜病毒对宿主细胞的吸附发挥抗病毒作用。Mounce等[39]研究发现,当姜黄素及其衍生物与寨卡病毒(ZIKV)、基孔肯雅病毒(CHIKV)和水疱性口炎病毒(VSV)等包膜病毒直接孵育时,病毒与细胞表面结合的能力被削弱,感染性丧失。令人惊讶的是,姜黄素没有直接降解病毒RNA,也没有破坏病毒颗粒。除了抗人类病毒,最近两项针对猪传染性胃肠炎病毒(TGEV)和猪繁殖与呼吸综合征病毒(PRRSV)的体外试验表明,姜黄素同样能显著抑制家畜病毒对宿主细胞的吸附,不仅降低了病毒颗粒的感染性,还抑制了病毒介导的细胞融合[40-41]。机制上,姜黄素的抑制作用可能归因于改变这些病毒包膜的流动性,而不是灭活病毒颗粒。支持这一推论的是,姜黄素含有的α,β-不饱和酮已经被报道能影响病毒包膜的流动性,从而破坏其与细胞膜的结合和融合[42]。此外,膜流动性的改变可能导致病毒结合细胞所必需的病毒糖蛋白的构象发生改变[39]。尽管现有的数据提示了姜黄素成为一种有效预防包膜病毒感染药物的可能性正在增加,但仍需要进一步的临床试验来评估姜黄素在体内的治疗能力。
4.1.2 抑制病毒复制 作为逆转录病毒科的成员,人类免疫缺陷病毒(HIV)感染所引起的艾滋病一直是困扰全球公共卫生的重大问题之一。迄今为止,国际社会仍然缺乏针对HIV安全有效的疫苗或治疗手段。令人惊讶的是,姜黄素在抑制HIV感染方面表现出独特的潜力。通过直接靶向病毒整合酶、蛋白酶和反式转录激活因子(Tat)等关键蛋白,姜黄素能在HIV生命周期的不同阶段抑制病毒复制[43]。机制上,姜黄素通过与蛋白催化核心区域的酸性残基结合抑制病毒整合酶的功能[44]。此外,姜黄素被报道诱导了HIV Tat蛋白的降解,并高效地抑制了Tat诱导的病毒长末端重复序列的反式激活[45]。姜黄素对蛋白激酶C-δ的抑制还在一定程度上抑制了肠病毒71型(EV71)在感染前期的蛋白表达和基因组复制,但并未影响病毒吸附和进入细胞[46]。类似的,姜黄素被报道抑制了EB病毒(EBV)关键蛋白EBNA1转录启动子Qp的活性,并在体内和体外通过蛋白酶体-泛素途径降低了EBNA1的表达,从而显著抑制了EBV感染后的病毒复制[47]。在抗畜禽病毒方面,Gao等[48]发现,姜黄素能以剂量依赖性的方式抑制猪瘟病毒(CSFV)的复制,但对病毒的吸附和侵入没有影响。而体外研究证实,20 μmol·L-1姜黄素显著抑制了猪轮状病毒(PoRV)的复制与增殖,降低了病毒滴度,并扭转了因病毒感染而失调的细胞免疫相关因子水平[49]。不仅如此,冯春等[50]研究显示,姜黄素能抑制马立克病病毒(MDV)的复制和增殖,提示姜黄素还具有抵御家禽病毒感染的作用。
4.2 间接抗病毒作用
4.2.1 调控宿主相关蛋白 对人类乳头瘤病毒(HPV)感染的研究显示,HPV癌蛋白E6和E7能与p53和pRb等肿瘤抑制蛋白形成复合物从而降解肿瘤抑制蛋白[51],而姜黄素被报道能通过恢复肿瘤抑制蛋白的水平及其他抑制因子来限制HPV感染及宫颈癌的发展[52]。Mamgain等[53]利用分子对接技术,在硅建模中发现姜黄素与E6的p53相互作用位点结合,阻止其与p53结合,从而阻断肿瘤抑制蛋白的降解。体外试验表明,姜黄素显著下调了E6和E7的水平,恢复了肿瘤抑制蛋白p53、pRb和PTPN13的表达,从而抑制了HPV感染[54]。此外,含有姜黄素的乳膏和胶囊已被开发并局部应用于宫颈,且临床研究证实其对健康女性无毒性作用[55-56]。重要的是,这类姜黄素制剂确实抑制了HPV阳性细胞和宫颈肿瘤的生长,并提高了HPV清除率,展现了姜黄素在预防和抵抗HPV感染方面的巨大潜力。
迄今为止,疱疹病毒科的病毒感染在全球具有非常高的致病率,尚无有效治疗方法。近年的一些研究发现,姜黄素在体内外通过显著降低病毒即时早期基因的表达抑制了单纯疱疹病毒Ⅰ/Ⅱ型(HSV-1/2)和人类巨细胞病毒等疱疹病毒科成员的传染性,这或许也与姜黄素下调细胞内热休克蛋白90的水平密切相关[57-59]。此外,姜黄素预处理人类生殖上皮细胞可减少HSV-2感染后病毒颗粒的释放,提示该天然物质可能有助于阻断性疾病的传播[60]。
4.2.2 激活宿主相关信号通路 除了靶向感染后宿主关键蛋白的表达,研究人员还观察到姜黄素通过调控宿主细胞的重要信号通路发挥抗病毒作用。最近,姜黄素被证实通过激活宿主细胞Nrf2-HO-1信号通路,刺激多种抗氧化酶的产生,进而抑制了甲型流感病毒(IAV)诱导的氧化应激[61]。令人惊讶的是,进一步研究发现,姜黄素能抑制被IAV激活的宿主细胞TLR2/4、p38/JNK MAPK和NF-κB通路,可能同时抑制病毒复制和病毒诱导的炎症反应,这与Hesari等[62]报道的姜黄素抑制乙型肝炎病毒(HBV)的作用机制类似。不仅如此,激活Nrf2-HO-1通路还可以增加Ⅰ型干扰素IFN-β的产生,进而抑制IAV的复制,并最终改善病毒感染导致的急性肺损伤和急性呼吸窘迫综合征[61]。此外,Yang等[63]以大鼠为模型探讨了姜黄素对伪狂犬病病毒(PRV)的抑制作用。PRV感染可造成宿主的海马神经元氧化损伤,激活线粒体凋亡通路,导致线粒体功能障碍。研究表明,10 μmol·L-1姜黄素能提高感染PRV后海马神经元的活性,通过上调宿主BDNF/TrkB通路抑制PRV对宿主神经元和线粒体的破坏,从而发挥神经保护作用[63]。
4.3 潜在抗新型冠状病毒能力
自2019年底至今,由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染引发的COVID-19疫情仍在全球范围内持续流行,已在全社会造成了不可估量的损失。目前,针对COVID-19的多种疫苗已被研发并正在进行临床应用,但由于疫苗效价和病毒变异的不稳定性,仍迫切需要寻找并开发更多具有相关治疗潜力的药物。
近年来累积的证据显示,姜黄素在抵御其他相关冠状病毒和呼吸道病毒感染中展现出巨大的优势,提示该天然化合物可能作为一种治疗COVID-19的潜在选择。一般来说,血管紧张素转换酶2(ACE2)与病毒刺突蛋白的结合是冠状病毒进入宿主细胞的经典途径[64]。有趣的是,最近的模拟研究预测,姜黄素能与ACE2相互作用从而阻断其与刺突蛋白的结合,进而阻止病毒对靶细胞的识别和侵入[7]。值得注意的是,Marín-Palma等[8]证实,姜黄素在体外具有抗SARS-CoV-2活性。在SARS-CoV-2 D614G毒株感染的早期和复制阶段,姜黄素均表现出显著的抑制作用。机制上,考虑到姜黄素较低的结合能力和抑制常数,一方面姜黄素可能通过直接与宿主细胞因子或病毒蛋白相互作用从而阻止靶细胞的识别,另一方面姜黄素可能直接灭活参与病毒和宿主膜融合的酶从而阻止病毒的侵入[8]。不仅如此,针对SARS-CoV-2 Delta突变株的研究发现,姜黄素同样显著降低了病毒的滴度,表明姜黄素的抗SARS-CoV-2活性不依赖于SARS-CoV-2毒株类型[8]。此外,姜黄素具有调节炎症因子的表达进而改变宿主炎症状态的能力,可以防止细胞因子风暴的发生,有助于改善COVID-19患者的疾病进展[65]。事实上,与SARS-CoV-2感染及随后的病理变化相关的宿主细胞分子靶点和信号通路大都受到姜黄素靶向调控[66]。因此推测,姜黄素具有预防和抑制SARS-CoV-2感染的能力,可以调节与导致COVID-19病理后果相关的分子级联反应来减缓疾病进展,从而在COVID-19相关治疗策略中占据优势地位。
综上,姜黄素通过直接靶向病毒关键成分或影响细胞代谢通路来介导强大的抗病毒效果(表1)。姜黄素对病毒的多效性作用源于其与多种分子靶点的相互作用,进而触发宿主体内与病毒感染相关的免疫或炎症信号通路。此外,姜黄素对细胞间信号级联的调节在一定程度上干扰了病毒的生命周期,限制了病毒的吸附和复制[66]。然而,目前的研究依然集中于分析姜黄素的系统应用,关于姜黄素在感染性疾病临床试验中的作用仍然不足。今后的临床研究需要进一步证明姜黄素在体外被观察到的效果是否适用于患者。
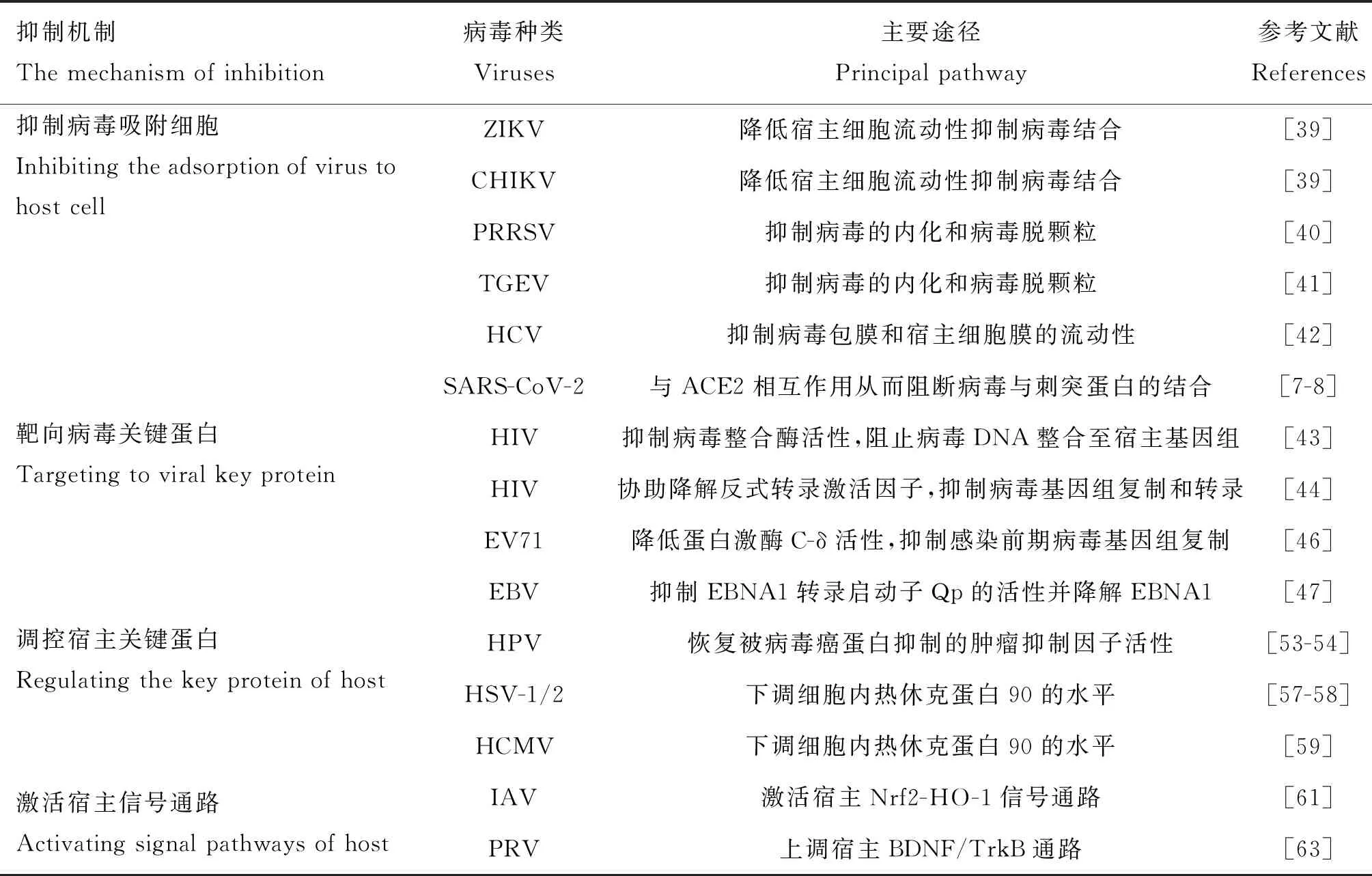
表1 姜黄素抗病毒机制
5 结语与展望
总之,姜黄素具有影响人类和畜禽肠道菌群多样性、调控益生菌与致病菌比例以及抵御多种人类和畜禽病毒侵袭的功能。作为一种植物源性的天然产物,姜黄素还具有安全、廉价和来源广泛的优势。如今在我国畜牧业饲料端全面禁止抗生素使用的背景下,姜黄素在代替抗生素成为新型绿色饲料添加剂的优势显得更加明显。此外,姜黄素能通过多种途径激活畜禽免疫系统,提高畜禽抵抗力,缓解畜禽炎症,保障动物健康,最终促进畜牧业降本增效。然而,关于姜黄素的科学研究与应用仍存在诸多困惑。例如,姜黄素发挥抗病毒的作用机制和关键的靶点尚未完全清楚。近年来的研究表明,N6-甲基腺苷(N6-methyladenosine,m6A)RNA甲基化可调控病毒的生命周期,而本课题组前期的研究发现,姜黄素可影响仔猪肠道的m6A RNA甲基化修饰进而发挥免疫调节作用[20],由此推测,姜黄素可能通过m6A RNA甲基化发挥抗病毒作用。此外,姜黄素在机体的代谢迅速,生物利用率较低。未来需要通过加工工艺或者改性的方法来开发新的高效姜黄素产品,以促进姜黄素在畜禽饲料和兽药领域更深入和广泛的应用。总之,在非洲猪瘟和禁抗时代背景下,姜黄素作为新型的绿色饲料添加剂将在我国构建安全、高效和优质的养殖模式中发挥重要作用。
