可转移黏菌素耐药基因mcr:控制革兰阴性菌感染“最后一道防线”的严峻挑战
2023-02-27丁帅帅魏述永
胡 俊,丁帅帅,魏述永
(西南大学动物医学院,西南大学医学研究院免疫学研究中心,重庆 402460)
随着动物源细菌耐药性不断加剧,一度因肾毒性及神经毒性而使用受限的黏菌素重新引起重视,并被认为是兽医临床控制多药耐药革兰阴性菌感染的“最后一道防线”。然而,近年来,可转移黏菌素耐药基因mcr的快速扩散,使得黏菌素的防线意义面临严峻挑战。mcr是磷酸乙醇胺转移酶家族编码基因的成员,可在不同细菌和宿主物种间水平传播并导致受体细菌低水平黏菌素耐药,给公共卫生安全带来了潜在威胁[1-4]。
黏菌素是一种阳离子多肽类抗生素,具有亲脂性脂肪酰侧链,作用于许多革兰阴性菌脂多糖(lipopolysaccharide,LPS)中的脂质A,其带正电荷的α、γ-二氨基丁酸可与脂质A的负电荷磷酸基团产生静电作用,引起Ca2+、Mg2+等二价阳离子取代,细胞膜通透性增加,细胞质渗漏,最终导致细胞死亡[5]。MCR蛋白与各种细菌中的磷酸乙醇胺转移酶有约60%的相似性,可由5个跨膜螺旋将自身锚定在细胞膜的周质中,然后通过磷酸乙醇胺共价修饰脂多糖的脂质A,导致脂质A和黏菌素之间的亲和力降低并耐药[1,6]。
自2016年首次报道以来,迄今已经发现了mcr-1~mcr-10共10类43个mcr的突变体[7-9],本文对其发现、流行规律、同源性、进化分析、分子特征、阳性质粒类型等研究进行综述,以期为后续研究提供参考。
1 mcrs的发现及流行情况
1.1 mcrs的发现及宿主细菌
mcr-1[1]、mcr-1.3[10]、mcr-1.4[11]、mcr-1.5[12]、mcr-1.7[11]、mcr-1.8(直接提交到NCBI),mcr-1.9[13]、mcr-1.11~mcr-1.13[14]首检于大肠杆菌,其余突变体mcr-1.2[15]、mcr-1.6[16]和mcr-1.10[17]分别在肺炎克雷伯菌、沙门菌和莫拉菌中首次检出。在已发现的mcr-3的11个突变体中,mcr-3[18]、mcr-3.2[19]、mcr-3.5[20]、mcr-3.11[21]和mcr-3.12[22]分别在大肠杆菌中首次检出,mcr-3.3[23]、mcr-3.6~mcr-3.9[24]和mcr-3.10[25]分别在维氏气单胞菌、异常嗜糖气单胞菌、中间气单胞菌、嗜水气单胞菌和豚鼠气单胞菌中首次检出。其他mcrs的发现信息[26-43]如表1所示。

表1 mcrs的首检信息

(续表1 Continued)
现已报道的mcrs的宿主细菌有20多种,多数属于肠杆菌科(大肠杆菌、沙门菌、肺炎克雷伯菌等)、气单胞菌科(维氏气单胞菌、异常嗜糖气单胞菌、中间气单胞菌等)及莫拉菌科(莫拉菌、鲍曼不动杆菌等)。从检出率、分布范围及阳性mcr类型分析,肠杆菌科细菌是其最重要的宿主细菌。另外,多数宿主细菌在自然界中广泛分布,且可达成mcr种间水平转移,从而导致该耐药基因全球流行。需要注意的是,mcr宿主细菌包括一些临床重要的人畜共患病原菌,这可能会给公共卫生安全带来潜在风险。例如,莫拉菌已被证实为mcr基因的宿主细菌,其主要感染动物,但也可以感染人类[28-29]。其他人畜共患的mcrs宿主细菌还包括大肠杆菌[28-29]、沙门菌[28-29]、嗜水气单胞菌[29]、豚鼠气单胞菌[24-25]等。mcr的宿主细菌[44-83]见表2。

表2 mcr基因的宿主细菌
1.2 mcrs流行规律及影响因素
mcrs已在全世界50多个国家广泛传播,并覆盖除南极洲以外的所有大陆。根据PubMed、Google scholar以mcr作为关键词的检索结果,筛选出相关研究论文发表数量最高的10个国家及其主要流行的mcrs突变体类型,如表3所示。

表3 mcr检出率最高的国家及其流行的突变体种类
在mcrs中,mcr-1的检出率最高、突变体最多,mcr-9也在六大洲广泛分布,并与mcr-1共同成为全球传播的黏菌素耐药决定因素[96]。mcr-3和mcr-5也是广泛传播的mcr基因,而其他mcr家族基因分布在较小的区域(mcr-4、mcr-2、mcr-8)或分散分布(mcr-7)。到目前为止,只在英国发现过一例关于mcr-6基因的报道。就区域来看,亚洲是报道mcr最多的大洲。同样,欧洲和美洲——如西班牙、意大利、德国、美国、巴西和阿根廷等相关报道也在增加[97]。
mcr的快速传播归因于其通过质粒和转座子水平转移的能力,低浓度黏菌素的持续压力加速了这种传播[97],而这种压力来源于兽医治疗或预防感染中使用的以及饲料中添加的黏菌素[98]。此外,mcr的广泛传播也与跨国旅行、世界贸易、食物链控制或预防不足等相关,并可能增加mcr的人畜共患传播风险[99-100]。
2 mcrs同源性及进化关系
2.1 相似性
同类mcr突变体间的相似性十分相近。以mcr-1为例,除了mcr-1.10之外,mcr-1及其大多数突变体间只有1~2个核苷酸突变。然而,mcr-1.10与mcr-1之间存在较大的差异,包括36个核苷酸突变引起的7个氨基酸替换,其中,3个氨基酸变化发生在N端蛋白区域,mcr-1与mcr-1.10之间的蛋白相似性为98.7%[17](表4)。但MCR间相似度差异较大,除MCR-2与MCR-1 (80%)、MCR-7与MCR-3(70%)、MCR-9与MCR-8(65%)、MCR-10和MCR-9(82.93%)相似性较高外,其余MCR间的相似性仅为40%左右,甚至更低。可见虽然具有相近的催化活性并导致黏菌素耐药,但MCR间相似性差异较大,这可能与其不同的菌种起源有关。
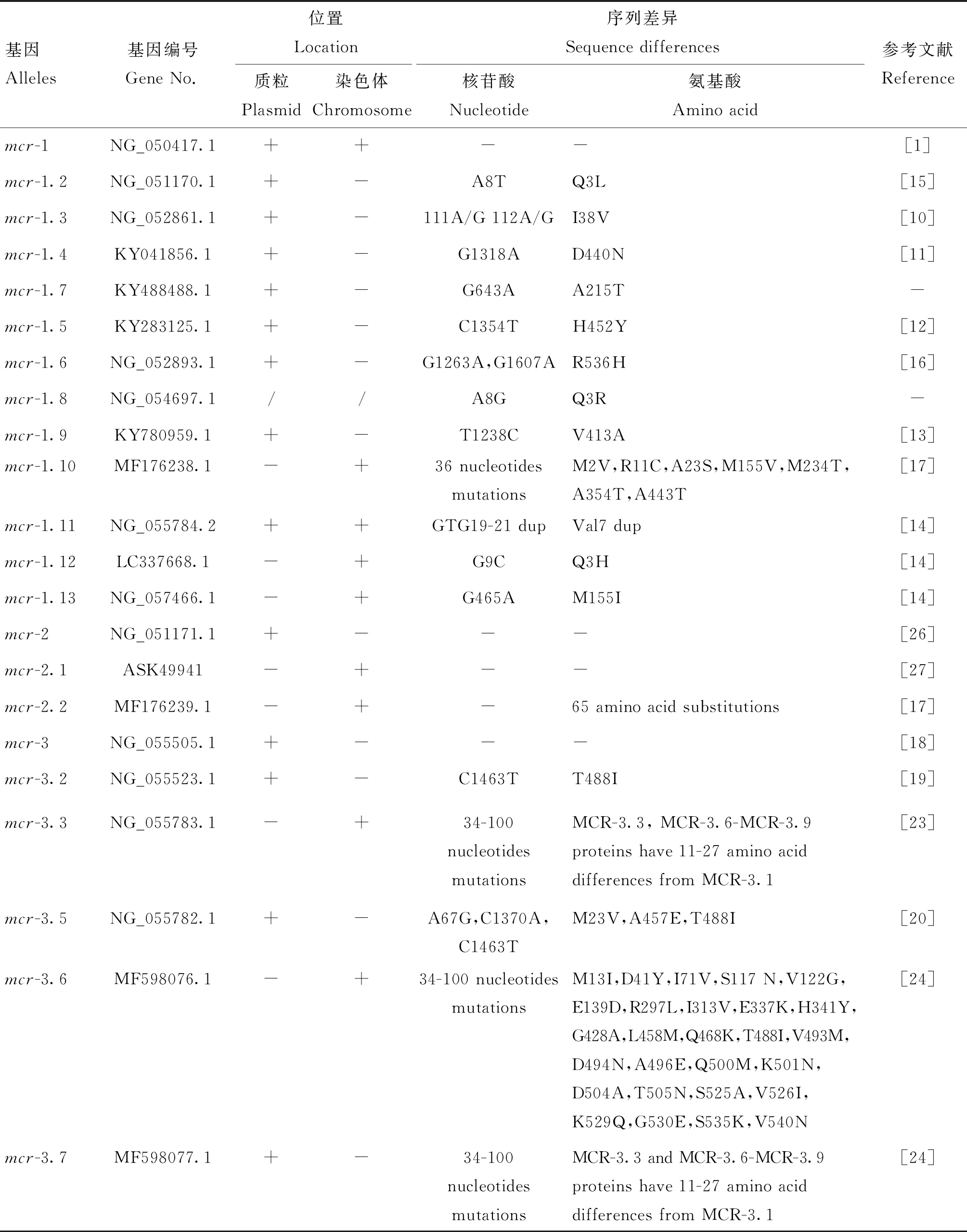
表4 mcr基因的序列差异
2.2 进化关系
系统进化分析表明,MCR-1和MCR-2可能起源于莫拉菌,其序列与卡他莫拉菌染色体基因编码的mcr样蛋白的氨基酸相似性分别为59%和60%[29]。通过仅在杀鲑气单胞菌中发现的转座子TnAs2的分析,肠杆菌科细菌的mcr-3基因可能起源于气单胞菌[18]。mcr-4家族可能起源于冷海希瓦菌,由质粒携带的mcr-4.3与冷海希瓦菌NCIMB 400的染色体DNA片段(约1.7 kb)100%匹配(登录号: CP000447)[101]。MCR-5.1及其变异体MCR-5.2与MCR-3和MCR-4家族有共同的祖先[79]。MCR-6可能起源于莫拉菌。MCR-7.1与MCR-3和MCR-3样序列具有相近的遗传距离,同样来源于气单胞菌。MCR-8的起源仍不清楚[83]。MCR-9和MCR-10蛋白共同起源于一个尚未确定的物种,与已知的布丘菌密切相关[43]。
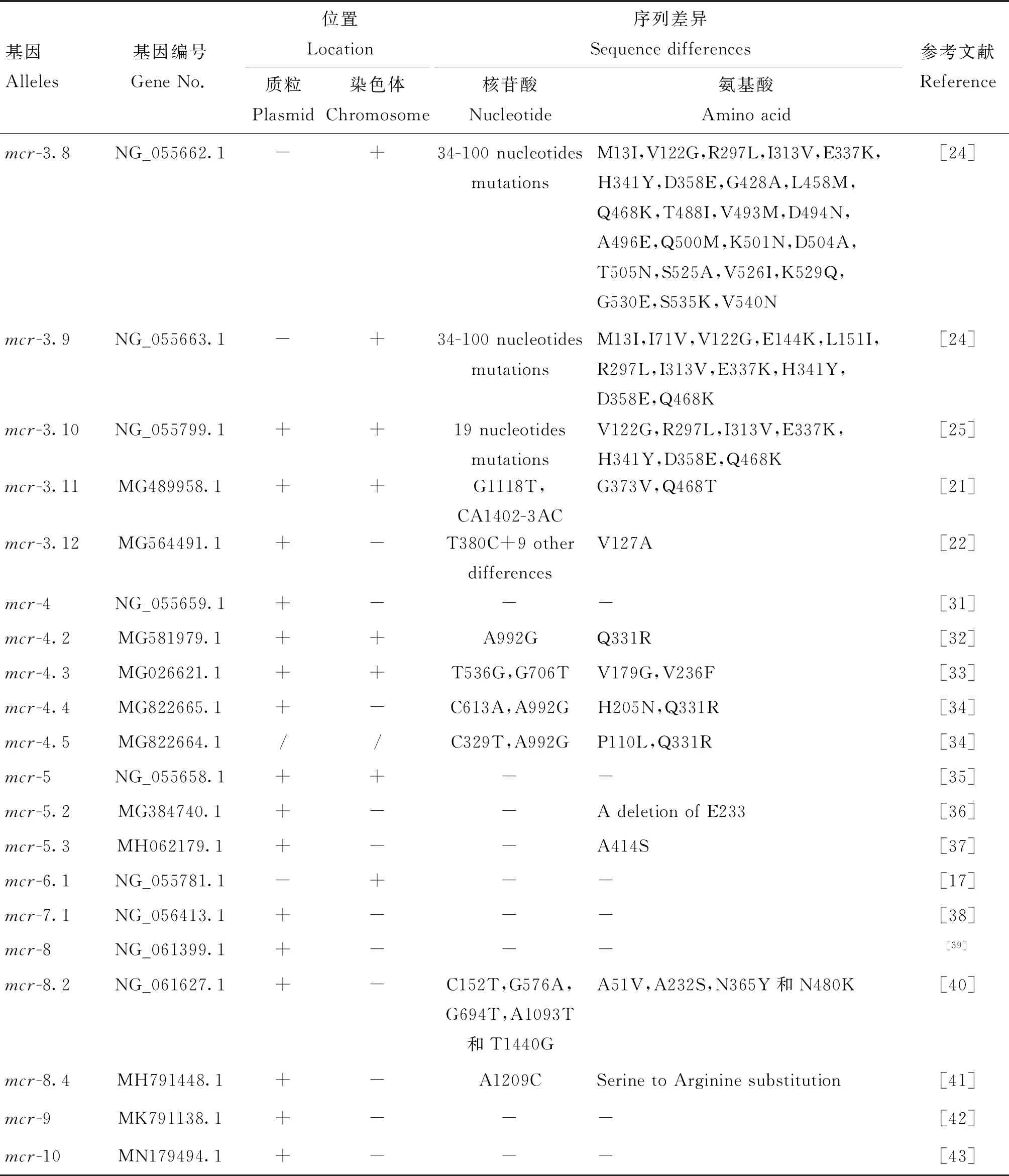
(续表4 Continued)
3 MCR的分子特征
3.1 MCR蛋白的预测结构
所有预测的MCR-1~MCR-10的结构均具有两个高度保守的EptA结构域:一个N端含有5个跨膜α-螺旋的膜锚定结构域,以及一个C端可溶性催化结构域[42-43]。三维模型显示,MCR-1~MCR-10膜锚定结构域和可溶性催化域具有高度的保守性[43]。MCR的关键残基可能对LptA和EptC的催化活性很重要[1],这些结构域可以锚定MCR并完成细胞膜质周表面脂质A的共价修饰[6]。此外,MCR-1和MCR-2的跨膜和催化结构域是可互换的,但MCR-1和MCR-4的跨膜和催化结构域在功能上是不可互换的。交换MCR-4和MCR-1或MCR-3的跨膜结构域可使酶失活,并且不能赋予敏感大肠杆菌黏菌素耐药性[101]。
3.2 MCRs的催化活性
底物和金属原子是MCR维持其催化活性所必需的,半胱氨酸形成的二硫键对催化结构域起到了稳定作用[102]。MCR-1活性维持的必需残基(Glu246、His395和磷酸化位点Thr285)及重要残基(Lys333、Glu468和His478)在MCR-2中是严格保守的[103]。MCR-1的催化结构域Thr285和MCR-3的催化结构域Thr277在介导黏菌素抗性中发挥了重要作用。在MCR-1将PEA转移到脂类A的过程中,催化结构域的保守残基Thr285被认为是PEA基团的受体,而在MCR-3中,Thr277起到亲核基团的作用,是负责催化反应的关键氨基酸[102]。
在许多MCR中,类似锌结合位点的区域具有明显的进化保守性且对酶的功能非常重要[68,104-106]。Zn2+在MCR-1和MCR-2中均与Glu246、Thr285和Asp465进行四面体几何配位[107],并与MCR-3中的Glu238、Thr277、Asp450和His451结合形成四面体配位结构[105]。而在MCR-4中,单个锌原子与E240、T278、H377、D452和H453结合,五个锌结合残基中的任何一个突变都完全使MCR-4失去功能[101]。与MCR-1相比,MCR-5.3的锌离子和残基更加保守且亲和性更高[37]。
4 mcrs遗传背景
4.1 可移动元件
插入序列、转座子等可移动遗传元件(mobile genetic elements,MGEs)在mcrs传播中起着至关重要的作用[13]。例如:ISApl1(IS30家族的一个插入序列(insertion sequence,IS)对于mcr-1水平转移具有重要意义[108]。然而,mcr-1的传播并非必定与ISApl1有关,mcr-1.9基因可以在mcr-pap2元件中的上游IS26元件缺失的情况下转移,以及没有ISApl1或只有一个拷贝的情况水平转移,且ISApl1对于mcr-1在质粒上的稳定性是非必须的[109-110]。此外,在mcr-3阳性质粒上游发现了缺失的ISKpn40,mcr-3与ISKpn40的结合可能促进了它的易位[21]。mcr-8的传播与IS元件IS903B和ISEcl1相关,IS903B的2个完整的ISs位于pkp91中mcr-8的上游或下游,而在WCHKP1845中,起源于阴沟肠杆菌的ISEcl1存在于mcr-8的下游[39]。
Tn3家族参与了mcr-3和mcr-5的水平转移。在mcr-3阳性大肠杆菌质粒pWJ1中, Tn3家族转座子TnAs2位于mcr-3的上游[18]。在铜绿假单胞菌MRSN 12280的染色体中,mcr-5基因嵌入在一个具有38 bp反向重复序列的Tn3家族转座子中,插入后产生一个5 bp的靶位点重复(TCCAT)[78]。同样,mcr-5.2插入到一个ColE质粒的Tn3家族转座子中而水平转移[36]。
4.2 阳性质粒
14种质粒与mcr-1的传播有关,包括IncI2[27,111-112]、IncX4[93,113-114]、IncHI2[44, 52, 88]、IncHI1[115]、IncP[11]、IncF[116]、IncFI[55]、IncFⅡ[94]、IncY[117]、IncK2[118]、IncN[119]和IncFIB[120]等,见图1。驱动mcr-1传播的三种主要质粒是IncI2、IncX4和IncHI2[1,121-123],它们是mcr-1阳性质粒的主要类别[123]。mcr-1阳性IncX4质粒比IncI2和IncHI2质粒具有更广泛的传播能力。mcr-1阳性的IncI2和IncHI2质粒的传播是区域性的。对来自7个不同物种肠杆菌科的219个携带mcr-1的质粒进行了系统发育分析,结果显示75%的IncHI2质粒来自欧洲,65.8%的IncI2质粒来自亚洲[123]。IncI2质粒携带的mcrs有mcr-1[116]、mcr-1.3[10]、mcr-1.5[12]、mcr-1.7[11]、mcr-1.11[60]、mcr-3.10[25]、mcr-7.1[38],IncX4质粒携带的有mcr-1[93]、mcr-1.2[89]、mcr-1.4[11]、mcr-1.9[13]、mcr-1.14和mcr-2[11]。而mcr-4、mcr-5及其突变体主要在较宽的寄主范围内检测到,多拷贝的ColE小型质粒。不同于大多数mcr-1阳性的窄宿主范围质粒,如IncI2和IncX4,mcr-3阳性质粒IncP-1是在各种环境中被鉴定的宽宿主范围质粒,这可能是导致mcr-3比mcr-1传播更广泛的原因[124]。
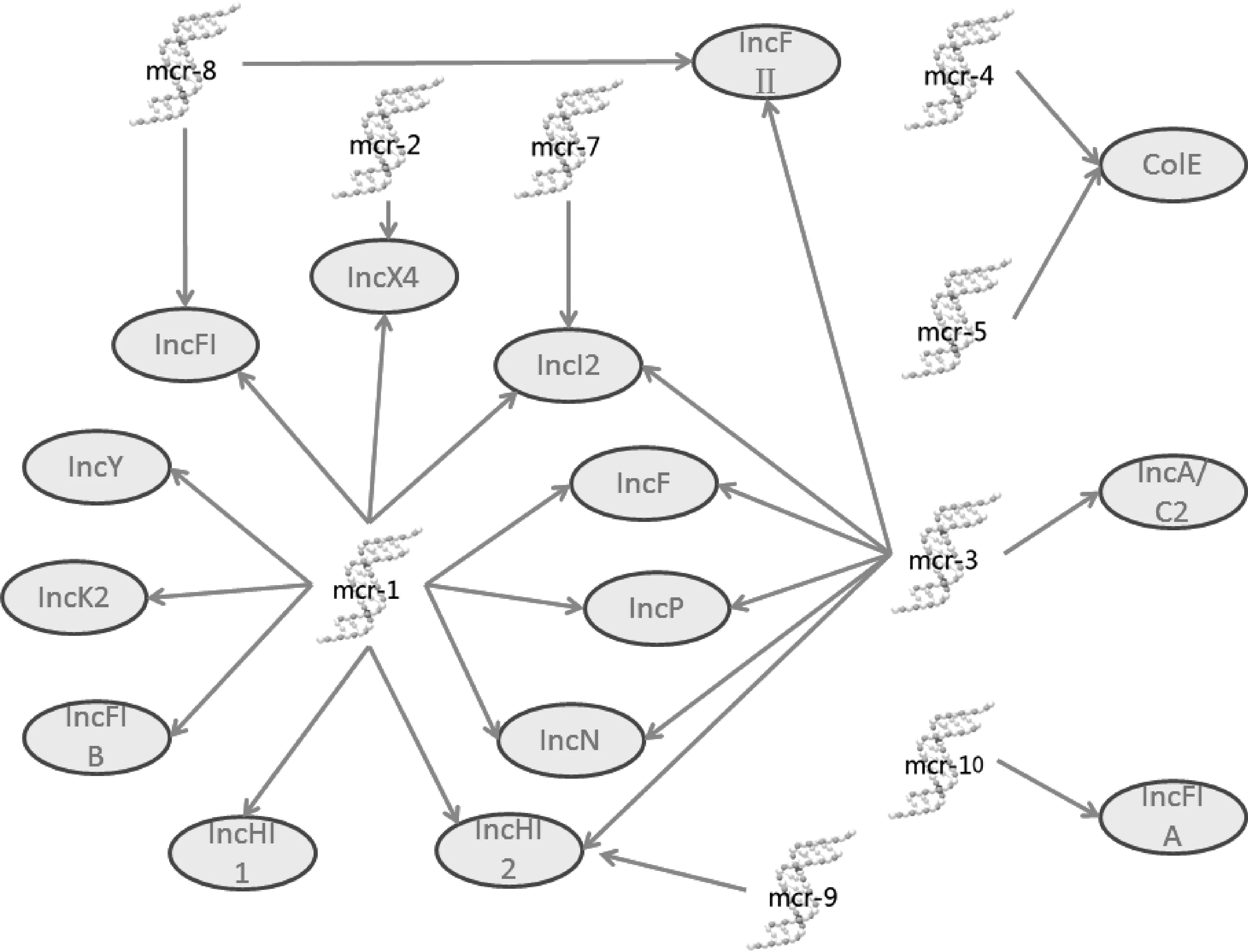
IncI2:mcr-1[27, 111],mcr-1.3[10], mcr-1.5[12, 61],mcr-1.7[11],mcr-1.9[85],mcr-1.11[60],mcr-3.10[25],mcr-7.1[38];IncX4:mcr-1[93],mcr-1.2[89],mcr-1.4[11],mcr-2[11],mcr-1.9[13];IncHI2:mcr-3[18],mcr-3.2[19],mcr-1[107],mcr-9[42];IncHI1:mcr-1[107],mcr-1.5[128];IncP:mcr-1.6[16],mcr-3.5[20],mcr-1[107],mcr-3.11[21],mcr-3[68];IncF:mcr-1[107],mcr-3[129];IncFI:mcr-1[107],mcr-8.2[40];IncFⅡ:mcr-1[107],mcr-8[39],mcr-8.4[41],mcr-3[130];ColE:mcr-5[35],mcr-5.2[36],mcr-4.3[33],mcr-4[31],mcr-4.2[74],mcr-4.4[131];IncR:mcr-8.2[40];IncA/C2:mcr-3.12[22],mcr-3[76];IncY:mcr-1[118];IncK2:mcr-1[119];IncFIB:mcr-1[121];IncN:mcr-1[132],mcr-3.19[132];IncFIA:mcr-10[43]
就流行性而言,除流行区域与宿主范围外,mcr阳性质粒的转移频率和稳定性也是需要考虑的因素。例如,IncX4质粒较IncI2质粒的转移频率更快,IncX4质粒中还具有保守的TA样稳定位点TsxAB,该位点在转移抗生素耐药基因和质粒稳定性中起重要作用,而IncHI2质粒是遗传上最易变的,它拥有一个由抗性相关基因组成的多药耐药区域。另外需要指出的是,一些mcr基因(mcr-1.10、mcr-2.2、mcr-3.3等)是染色体编码的,较质粒介导的mcr具有更强的稳定性,但不能水平传播。
5 展 望
mcrs的全球传播已经引起广泛关注,并采取了众多措施防止因其扩散而引起的黏菌素耐药性的传播。例如,在中国,从2017年4月1日起,禁止使用黏菌素作为动物促生长剂,致使硫酸黏菌素预混料的产量从2015年的27 170 t下降到2018年的2 497 t,硫酸黏菌素预混料的销售额也从7 150万美元下降到800万美元[125]。此外,美国的食品和药物管理局(Food and Drug Administration,FDA)、加拿大的公共卫生局(Public Health Agency,PHA)、欧洲药品管理局(European Medicines Agency,EMA)、英国相关部门也采取了相应的措施限制黏菌素的滥用。在欧盟,2011—2018年,多黏菌素销售额下降了54%[126]。
mcrs的研究方兴未艾,然而,在这些研究中仍然存在一些问题。黏菌素敏感性的体外试验结果可能受到细菌种群中的低敏感亚群(异抗性)[127]和LPS结构(O抗原)的差异[128]的影响。此外,黏菌素是一种较大的阳离子,在琼脂上的扩散受限,且其可以黏附在普通的塑料实验室器皿上[129],因此常规的药物敏感性测试方法,如琼脂扩散法和Etest试纸条,现在被认为是不可靠的,导致数据准确性较低[130],一些以前报道的数据可能需要重新评估。因此,临床和实验室标准研究所(Clinical and Laboratory Standards Institute,CLSI)和欧洲抗菌药物敏感性试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)建议在阳离子调整的MH肉汤中进行肉汤微量稀释用于黏菌素敏感性试验[131]。另一方面,mcr抗性基因的命名存在一定混乱。保存在国际核苷酸序列数据库合作组织(International Nucleotide Sequence Database Collaboration,INSDC)数据库中的一些新的突变体序列可能会被给予“保留至发表”(hold-until publication,HUP)的状态,直到相关手稿被接受。这意味着,发现了一个潜在的新突变体的研究人员可能不知道所有其他已被识别但尚未公开可用的突变体。为了避免混淆,在提交序列和/或新mcr突变体手稿之前,鼓励该领域的作者将新序列提交给INSDC,并通过NCBI(pd-help@ncbi.nlm.nih.gov)进行mcr突变体编号的分配和注册。如果收到描述可能归属于新亚群的相关基因的手稿,期刊也应该推荐并发起讨论[130]。
