槟榔碱通过促进巨噬细胞分泌含miR-155-5p外泌体诱导人口腔成纤维细胞的活化
2023-02-27黄永祺游月华1
黄永祺,喻 伟,游月华1,
1南方医科大学附属深圳市龙华人民医院口腔科,广东 深圳 518109;2南方医科大学口腔医学院,广东 广州510515
口腔黏膜下纤维化(OSF)是口腔潜在恶性疾病[1],长期咀嚼槟榔是其主要病因之一[2]。近年来,临床上尝试用各种药物和手术治疗来干预OSF发生发展过程,但效果有限[3,4]。深入研究OSF的发病机制对于找寻有效的治疗方法具有重要意义。
活化的颊黏膜成纤维细胞(BMFs)是OSF黏膜下胶原的主要来源[5]。本课题组在既往研究中发现BMFs的活化与槟榔碱造成的口腔黏膜下炎症密切相关[6],而在口腔黏膜下炎症中发挥关键作用的巨噬细胞是否参与了BMFs的活化,目前尚无相关报道。
细胞外囊泡(EVs)可介导细胞间通讯[7]。作为细胞外囊泡的一种,外泌体可携带多种大分子物质参与EVs调控的细胞间通讯过程[8]。miRNAs是一类长度为18~25 bp的非编码RNA[9],在多种疾病的进展中发挥关键调控作用[10,11]。同时,miRNA也是外泌体转导细胞间信号所携带的常见“货物”,研究显示,黑色素瘤细胞系可分泌携带有miR-155-5p的外泌体诱导成纤维细胞向肿瘤相关成纤维细胞转化[12]。而在OSF中,携带miR-155的外泌体是否调控巨噬细胞与BMFs间的细胞通讯目前尚无报道。miR-155已被证实在肝、肠、肾等多个脏器的纤维化过程中表达上调,并具有促进纤维化的作用[13,14],而有关miR-155对OSF的影响目前罕见报道。本研究旨在探讨miR-155在OSF中的作用及机制,为OSF的临床治疗提供新的思路与靶点。
1 材料和方法
1.1 材料
1.1.1 细胞株 人外周血单核细胞(THP-1)购自中国科学院上海细胞库;人口腔黏膜成纤维细胞(HOMF)由南方医科大学附属南方医院急诊科李旭教授课题组惠赠。
1.1.2 主要试剂耗材与仪器 无水乙醇、甲醇(广州化学试剂厂);胎牛血清、青链霉素双抗、DMEM高糖培养基、MEM 培养基、PBS 缓冲液(Gibco);miR-155-5p mimics、miR-155-5p inhibitor、si-SOCS1(锐博生物),RNA提取试剂盒、RT-qPCR检测试剂盒(诺唯赞生物科技股份有限公司);RIPA蛋白裂解液、BCA蛋白浓度检测试剂盒(碧云天生物技术有限公司);活性氧ROS检测试剂盒(南京建成生物工程研究所);CD80流式抗体、CD86 流式抗体、兔抗人α-SMA 抗体、兔抗人I 型Collagen抗体、兔抗人SOCS1抗体、山羊抗兔荧光二抗(Abcam);细胞培养瓶、细胞培养皿、细胞培养板、Transwell培养小室(Corning);结晶紫粉末(Sigma);近红外扫描仪(Odessey);超高速离心机(Beckman);正置相差显微镜(奥林巴斯BX-51);倒置相差显微镜(奥林巴斯BX-63)。
1.2 方法
1.2.1 细胞培养 THP-1细胞及HOMF细胞以DMEM高糖培养基(10%FBS、1%青链霉素双抗)进行常规培养。研究分为3组:空白对照组:不接种THP-1细胞;对照组:接种未处理THP-1细胞;ARE刺激组:接种预先以ARE 刺激24 h 的THP-1 细胞,细胞孵箱温度设定37 ℃、CO2浓度50 ml/L。HOMF 细胞铺满培养表面75%~85%时,以胰酶消化传代。
1.2.2 外泌体提取 将各组THP-1细胞完成相应处理后,更换由无外泌体血清配制的培养基中继续培养24 h,收集各组细胞培养上清,以1200 r/min离心10 min后,取上清继续以2000 r/min离心30 min,离心完成后仍留取上清,以20 000 r/min离心70 min,吸弃上清并以PBS重悬沉淀,继续以20 000 r/min离心70 min,离心完成后收集沉淀即为所提取的THP-1细胞外泌体。以PBS重悬后进行NTA检测并进行与HOMF细胞的共培养实验,或加入RNA提取试剂以提取外泌体RNA进行后续研究。
1.2.3 RT-qPCR检测细胞中mRNA、miRNA水平 参照诺唯赞公司柱提法RNA提取试剂盒说明书提取各组细胞总RNA,以逆转录试剂盒将1μg RNA逆转为cDNA,随后在体系内加入相应引物及荧光染料,以RT-qPCR检测α-SMA、I 型胶原、miR-155-5p 和U6 等基因的表达水平。以U6基因为内参,以2-ΔΔCt法对目标mRNA/miRNA的表达进行测定。U6、α-SMA、I型胶原、SOCS1等引物由上海生工公司合成,miR-155-5p mimics 与inhibitor序列、SOCS1过表达质粒由广州锐博生物合成。
1.2.4 Western blot检测各组细胞中相关蛋白表达水平将完成相应处理的细胞以无菌PBS 洗涤3 次,加入RIPA蛋白裂解液进行充分匀浆后离心,留取离心后上清蛋白溶液,以BCA法检测蛋白浓度后,向蛋白溶液中加入loading buffer并煮沸变性。以20~30 μg上样量将总蛋白进行SDS-PAGE凝胶电泳,待目的蛋白所在条带完成分离后,切取目的条带所在凝胶,以湿转法将蛋白转至PVDF膜上。转膜完成后,将PVDF膜以5%BSA溶液于37 ℃恒温封闭30 min,随后加入对应一抗并于4 ℃环境孵育过夜(各种抗体稀释比例均为1∶1500)。孵育完成后以TBST溶液洗涤3次并加入山羊抗兔荧光二抗(稀释比例为1∶10 000),继续于37 ℃恒温摇动孵育1 h,孵育完成后TBST溶液洗涤3次后,于近红外扫描仪中进行扫描显色。
1.2.5 Transwell 细胞迁移实验 将完成相应处理的THP-1细胞接种于Transwell培养系统下室,以0.25%胰酶将HOMF细胞消化、离心,以无血清培养基重悬后计数,调整细胞浓度至1×105/mL,在每个Transwell培养系统上室内接种100 μL的HOMF细胞悬液,随后将培养系统置于37 ℃恒温孵箱内培养12 h。培养完成后取出小室并浸入4%甲醇溶液内,室温固定30 min;固定完成后以PBS浸泡3次,以棉签小心擦去小室内表面未迁移细胞,随后将小室置入结晶紫染液中染色15 min;染色完成后再次以PBS浸洗3次,于倒置显微镜下拍照并计数各组HOMF迁移至Transwell小室下表面的细胞数目。
1.2.6 活性氧检测 参照南京建成活性氧检测试剂盒说明书,以无血清培养基溶解DCFH-DA探针,检测前对提前种植于24孔细胞培养板内的待检测细胞进行换液处理,随后加入已稀释的DCFH-DA探针培养基,37 ℃孵育1 h后,酶标仪设定激发波长500 nm,检测各组细胞于525 nm波长处发射的荧光数值。
1.3 统计学分析
采用SPSS 19.0 统计软件进行数据分析,采用GraphPad prism7软件进行统计绘图,所有数据经正态性检验。数据以均数±标准差表示,采用非配对双尾t检验比较独立两组间数据差异,采用单因素方差分析比较两两数据组间差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 槟榔碱可诱导THP-1 向M1 型极化但不增强HOMF的纤维化表型
观察THP-1细胞经ARE处理后由半贴壁生长转向贴壁生长,部分细胞突起较明显并含较大颗粒,细胞由M0趋向M1极化(图1A)。予ARE刺激后,THP-1内CD80 和CD86 阳性细胞比例显著增加(图1B)。Transwell细胞培养结果显示,对照组与ARE组迁移至小室下表面的细胞数量无明显差异(图1C)。qRT-PCR结果显示,与对照组相比,ARE处理后HOMF细胞内α-SMA与I型胶原蛋白mRNA水平并无显著差异[(1.03±0.08vs1.04±0.12;1.17±0.08vs1.18±0.19),P=0.93,P=0.97,图1D]。WB结果显示,与对照组相比,ARE处理后HOMF细胞内α-SMA与I型胶原蛋白表达水平并无显著差异(图1E)。
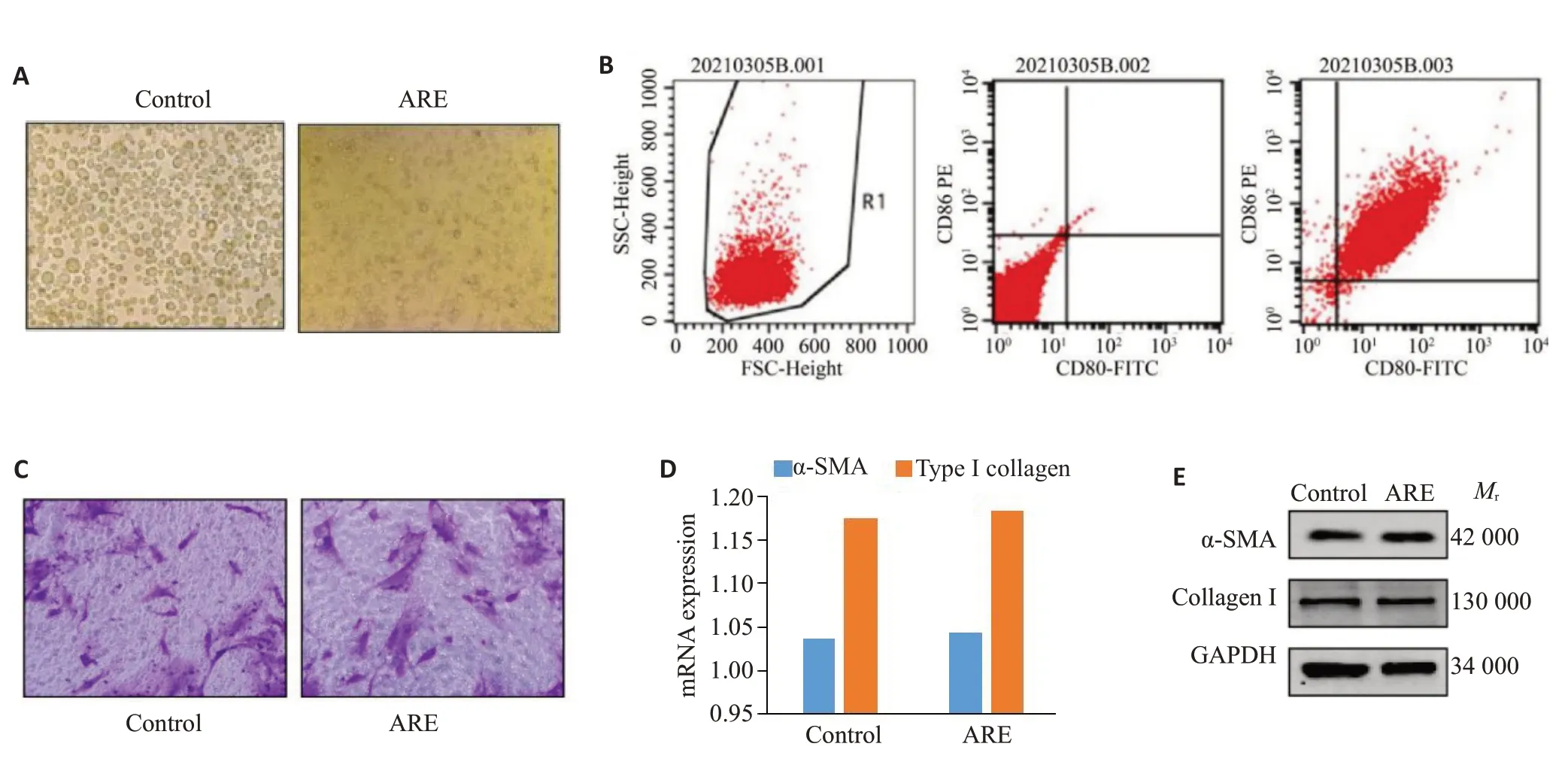
图1 槟榔碱对THP-1和HOMF细胞表型的影响Fig.1 Effects of arecoline on phenotypes of THP-1 and HOMF cells.A: Morphological changes of THP-1 cells stimulated by ARE(Original magnification: ×200).B: Surface antigen of THP-1 macrophages stimulated by ARE detected by flow cytometry.C:Transwell cell culture system showing similar cell migration ability between the control group and ARE group(×400).D,E:mRNA and protein expressions of α-SMAand type I collagen was detected by PCR and Western blotting.
2.2 ARE刺激后的THP-1细胞可增强HOMF的纤维化表型
在Transwell 培养系统的上、下室中分别接种HOMF细胞和经相应处理的THP-1细胞,共培养12 h后,观察上室HOMF细胞的迁移情况。结果显示,与空白对照组(下室中不接种THP-1细胞)和对照组(下室中接种未处理THP-1细胞)相比,ARE刺激组(下室中接种预先以ARE刺激24 h的THP-1细胞)上室内HOMF细胞迁移数量增加(图2A)。分别提取对照组及ARE刺激24 h组THP-1细胞外泌体与HOMF细胞共培养24 h,以PCR及WB方法检测HOMF细胞内α-SMA和I型胶原表达水平。结果显示,ARE刺激组HOMF细胞内α-SMA和I型胶原的mRNA及蛋白表达均较对照组显著升高(1.90±0.08vs3.17±0.08;3.19±0.05vs5.65±0.01,P<0.05,图2B、C)。
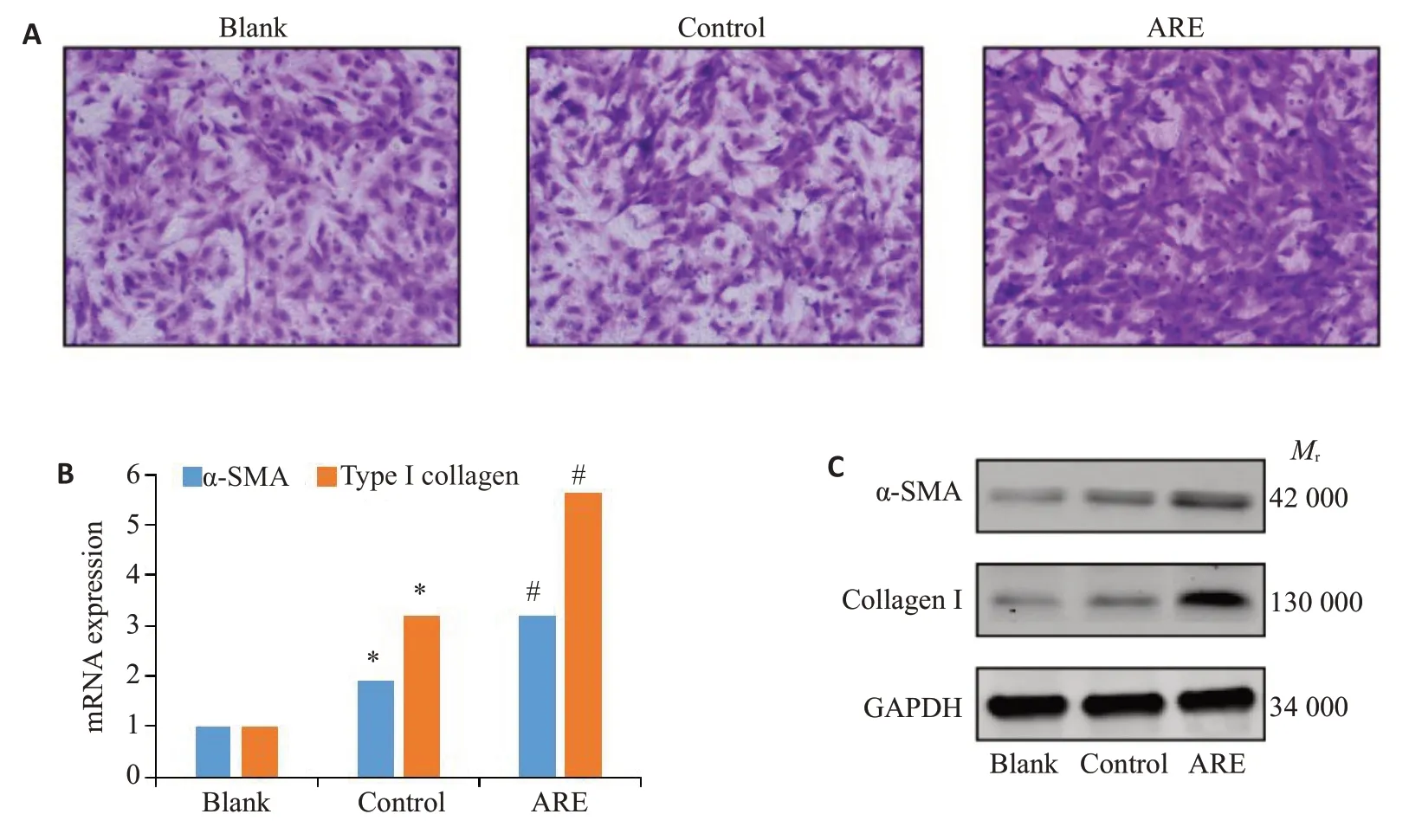
图2 槟榔碱通过THP-1促进HOMF的纤维化表型Fig.2 ARE promotes HOMF fibroblast phenotype through THP-1 cells.A: Transwell assay for detecting the effect of THP-1 on HOMF migration after ARE stimulation (×200).B: Transcription levels of α-SMA and type I collagen in HOMF detected by RT-qPCR.C:Expression levels of α-SMA and type I collagen proteins in HOMF detected by Western blotting.*P<0.05 vs blank group,#P<0.05 vs control group.
2.3 槟榔碱通过THP-1细胞的外泌体促进HOMF细胞的纤维化表型
提取对照组及ARE刺激组THP-1细胞外泌体及无外泌体上清,NTA分析显示两组细胞外泌体颗粒大小及数量无显著差异(图3A)。将HOMF 细胞分别与ARE刺激24 h后的THP-1细胞培养上清、THP-1细胞外泌体以及THP-1 细胞无外泌体上清进行共培养。Transwell结果显示,与无外泌体上清组相比,ARE刺激后THP-1细胞培养上清组和外泌体组穿膜HOMF细胞数目均显著增多(图3B)。提取上述各组HOMF细胞总RNA及总蛋白,分别进行PCR与Western blotting检测,结果显示:与无外泌体上清组相比,全培养上清或外泌体刺激组HOMF 细胞内α-SMA 及I 型胶原蛋白的mRNA及蛋白表达水平显著升高(1.00±0.02vs13.17±0.08;1.00±0.07vs15.65±0.01,P<0.05,图3C、D)。分别提取ARE刺激前后THP-1细胞、THP-1外泌体以及经THP-1外泌体刺激后的HOMF细胞总RNA,检测miR-155-5p水平。结果显示,ARE刺激后THP-1及外泌体内miR-155-5p 水平较对照组显著升高[(1.00±0.02vs5.84±0.08;1.00±0.02vs14.17±0.92,P<0.05,图3E、F];同时,ARE刺激后THP-1所分泌的外泌体可显著上调HOMF细胞内miR-155-5p 水平(3.51±0.08vs11.24±0.08,P<0.05,图3G)。
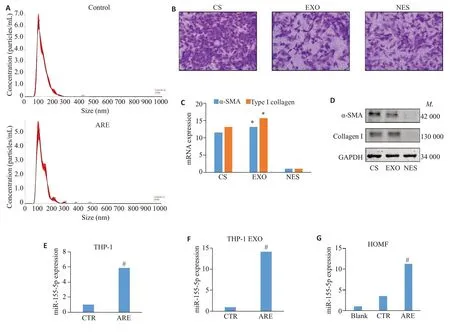
图3 槟榔碱经THP-1外泌体途径调控HOMF表型及胞内miR-155-5p水平Fig.3 Arecoline regulates HOMF phenotype and intracellular miR-155-5p through THP-1 exosome pathway.A:NTA detection of THP-1 exosomes before and after ARE stimulation.B:Transwell cell migration assay for detecting HOMF migration(×200).C:Transcription levels of α-SMA and type I collagen in HOMF detected by RT-qPCR.D:Expression level of α-SMA and type I collagen proteins in HOMF detected by Western blotting.E-G:miR-155-5p level detected by RT-qPCR.*P<0.05 vs NES group,#P<0.05 vs control group.
2.4 miR-155-5p 介导ARE 经THP-1 外泌体途径对HOMF细胞成纤维表型的调控
构建miR-155-5p 模拟物和抑制物(miR-155-5p mimics和miR-155-5p inhibitor)并转染HOMF细胞,检测二者对HOMF细胞内miR-155-5p水平的影响(1.10±0.19vs20.90±1.58;1.05±0.11vs0.08±0.01,P<0.05,图4A、D)。Transwell检测转染miR-155-5p mimics后HOMF细胞迁移能力,结果显示:与NC组相比,转染miR-155-5p mimics组HOMF细胞迁移能力显著增强,而转染miR-155-5p inhibitor组HOMF细胞在与ARE刺激后THP-1细胞外泌体共培养时的迁移能力则较NC组显著下降(图4B,E)。PCR结果显示,转染miR-155-5p inhibitor组HOMF细胞在与ARE刺激后THP-1细胞外泌体共培养后,细胞内α-SMA及I型胶原蛋白mRNA水平较NC组显著下调(5.84±0.08vs2.00±0.98;7.32±0.51vs2.33±0.43,P<0.05,图4F)。而WB检测结果显示,转染miR-155-5p mimics组HOMF较NC组α-SMA及I型胶原蛋白表达显著上调(图4C);转染miR-155-5p inhibitor则可显著下调与ARE刺激后THP-1细胞外泌体共培养的HOMF细胞内α-SMA及I型胶原蛋白表达水平(图4G)。
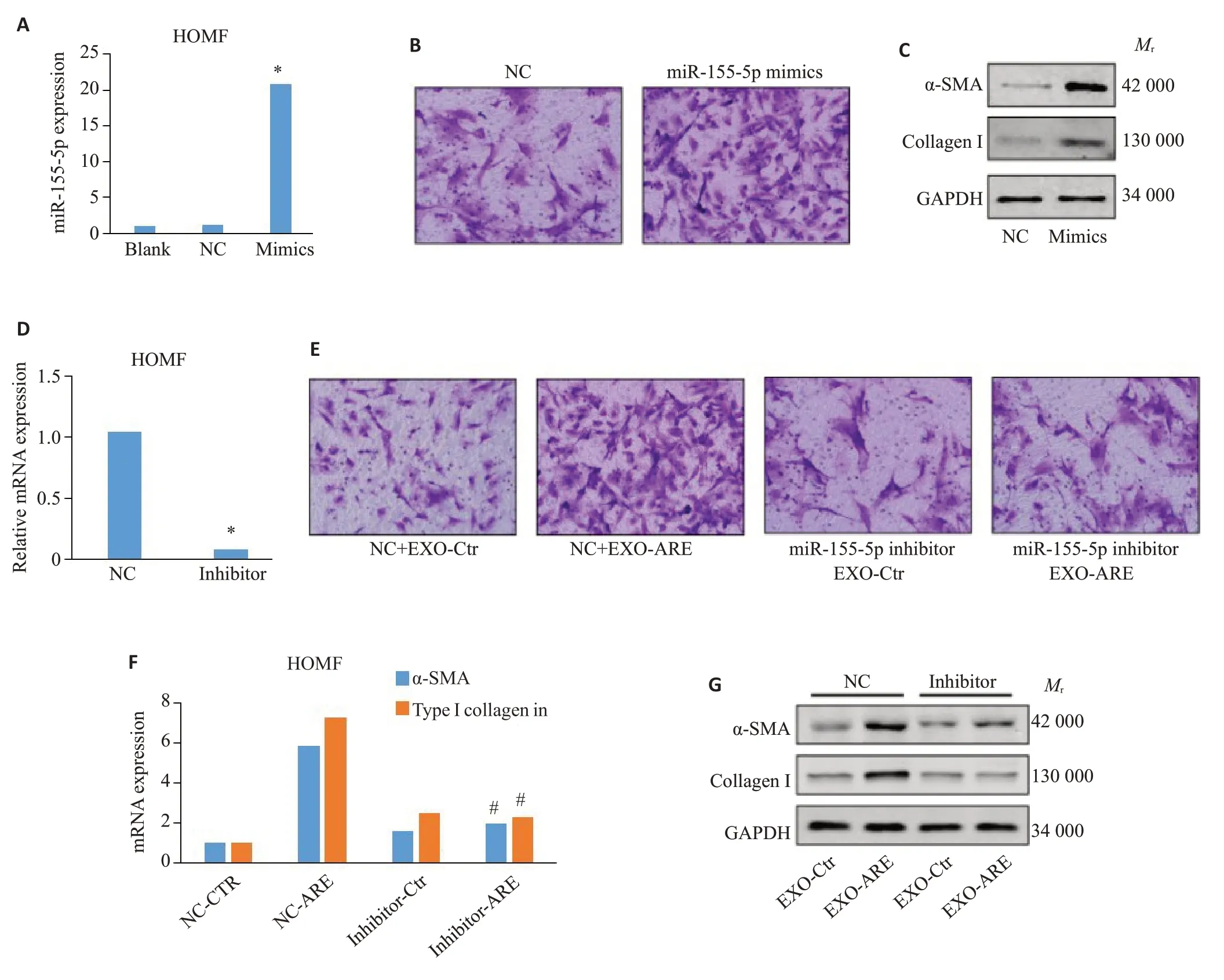
图4 miR-155-5p是ARE经THP-1外泌体诱导HOMF细胞纤维化表型的关键分子Fig.4 miR-155-5p is a key molecule in fibrotic phenotype of HOMF induced by exosomes from AREstimulated THP-1 cells.A,D:Levels of miR-155-5p in HOMF detected by RT-qPCR.B,E:Transwell for detecting HOMF migration(×200).C,G:Expression level of α-SMA and type I collagen protein in HOMF detected by Western blotting.F:Transcription levels of α-SMA and type I collagen in HOMF detected by RT-qPCR.*P<0.05 vs Control group,#P<0.05 vs NC-ARE group.
2.5 槟榔碱诱导的THP-1外泌体通过抑制HOMF细胞内SOCS1表达而上调胞内ROS水平并促进HOMF细胞纤维化表型
PCR及WB结果显示,与对照组(不加外泌体刺激或加入未经ARE诱导的THP-1外泌体)相比,经ARE诱导的THP-1外泌体刺激组HOMF细胞内SOCS1的mRNA和蛋白水平显著下调(1.08±0.06vs0.34±0.02,P<0.05,图5A、B)。与对照组相比,经ARE诱导的THP-1外泌体刺激组HOMF细胞内ROS水平显著上调(图5C)。过表达SOCS1可显著抑制ARE诱导的HOMF细胞内ROS堆积和α-SMA、I型胶原蛋白的表达(4.41±0.55vs2.08±0.33;2.03±0.10vs1.23±0.11,P<0.05,图5E~H)。
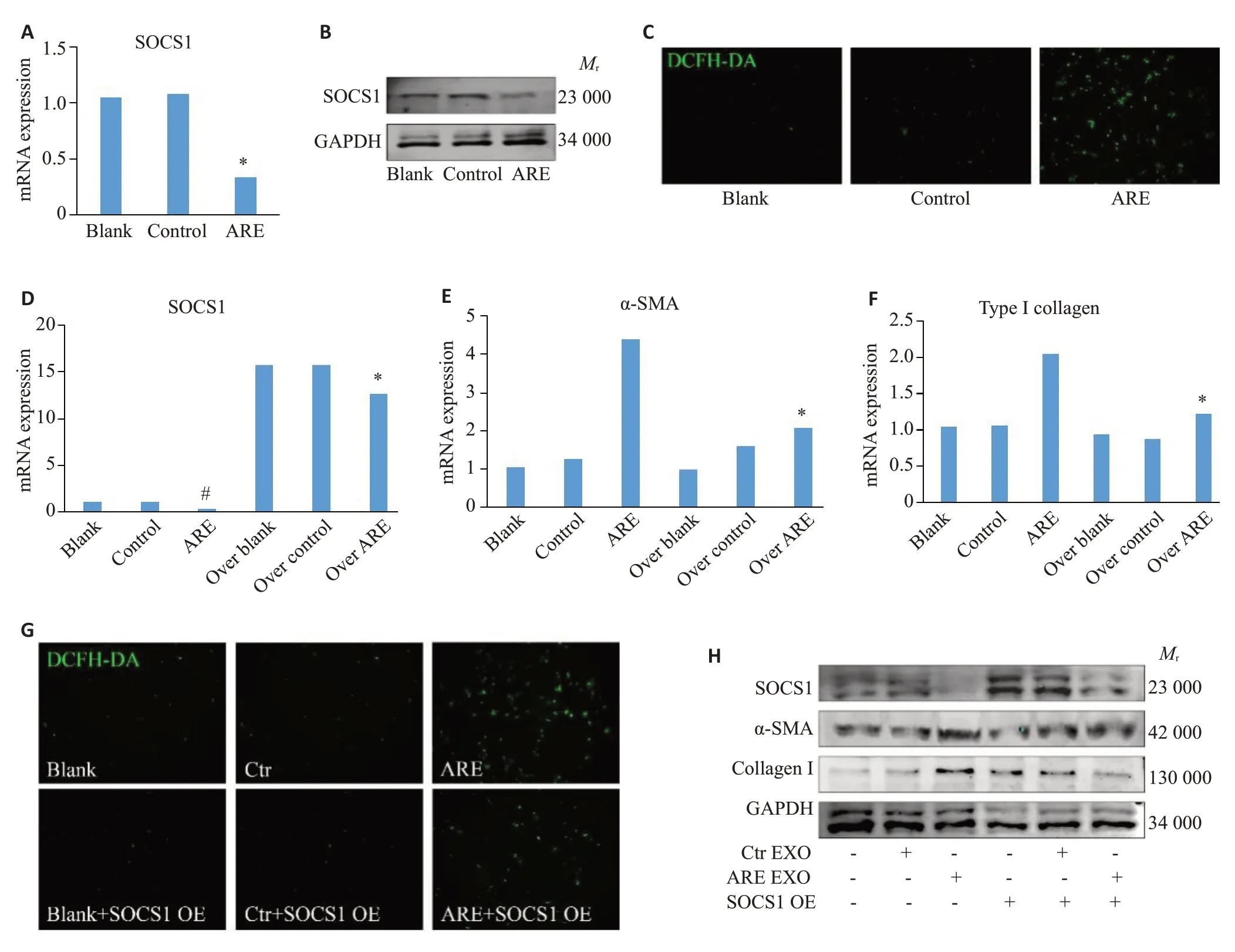
图5 SOCS1是ARE刺激后THP-1细胞外泌体诱导HOMF成纤维表型增强的重要靶点Fig.5 SOCS1 is an important target for enhancing HOMF fibroblast phenotype induced by exosomes from ARE-stimulated THP-1 cells.A,D-F:mRNA levels detected by RT-qPCR.B,H:Expression levels of SOCS1,α-SMA and type I collagen proteins in HOMFs detected by Western blotting.C,G:ROS levels in HOMFs measured using DCFH-DA kit(×100).&P<0.05 vs Control group,*P<0.05 vs ARE EXO group,#P<0.05 vs Ctr EXO group.
3 讨论
目前研究认为,病理性纤维化与慢性炎症密切相关。尽管已有研究证实槟榔碱可能通过诱导炎症细胞因子的分泌,促进成纤维细胞增殖[15],但槟榔碱调控炎症细胞的潜在机制及其对下游成纤维细胞的影响方式目前尚未完全阐明。本研究证实槟榔碱可通过THP-1细胞所分泌的外泌体途径上调HOMF细胞中miR-155-5p水平,进而增强HOMF细胞活性。机制研究结果表明,经槟榔碱刺激后的THP-1外泌体被HOMF摄取后,外泌体内miR-155-5p 可通过抑制HOMF 细胞内SOCS1 蛋白的表达导致细胞内氧化还原失衡,引起HOMF细胞内ROS水平的升高,最终导致HOMF细胞的进一步活化。鉴于此前报道的抑制人胚肺成纤维细胞中miR-155-5p水平,可通过恢复Smad5基因的表达,减少细胞增殖、促进细胞凋亡并抑制胞内I型和III型胶原蛋白的生成[16],本研究可能为阐明槟榔所诱导的口腔黏膜炎症及黏膜下纤维化相关机制提供新证据。
miRNA可通过结合于基因的3’UTR区域来参与调控基因的转录;此外,miRNA还可募集RNA相关沉默复合物以诱导靶标mRNA的降解,在转录后水平抑制相关蛋白的表达。因此,miRNA在维持组织与细胞的生理功能方面具有重要作用,并可参与多种病理过程的调控。在口腔黏膜下纤维化方面,Padacherri等[17]对OSF中miRNA的表达改变进行了综述,在OSF中发现了13个miRNAs的表达缺失,共有371个实验验证的基因被证明与OSF相关的miRNAs相互作用,miRNA及其靶基因的失调说明了miRNA在纤维化中的生理作用。由此可见,miRNA对OSF病变过程的调控可能具有重要意义。
miR-155是位于染色体21q21上的非编码基因,可调控多种下游靶基因参与细胞的增殖、凋亡等过程,是最早被研究的miRNA 之一[16]。目前研究认为,miR-155-5p是一种促纤维化因子,在多种纤维化相关疾病的调控中发挥重要作用。miR-155-5p通过抑制SIRT1信号通路促进梗阻性肾病肾间质纤维化[18]。敲除miR-155可减轻肺纤维化模型小鼠的纤维化水平[19]。此外,抑制miRNA-155可通过减少巨噬细胞炎症减弱内质网应激引起的心肌梗死后心肌细胞凋亡[20]。研究进一步证实miR-155在心梗后的心肌纤维化过程中同样发挥重要作用[21]。miR-155可通过对TP53INP1表达的调控,诱导心肌成纤维细胞的表型转化并抑制其凋亡,从而促进心脏成纤维细胞增殖及胶原合成,加重心肌纤维化与重构。本研究中发现与上述研究一致的现象,即miR-155-5p可通过靶向SOCS1促进HOMF细胞向成纤维表型转化。本研究中还值得关注的是槟榔碱并非直接改变HOMF细胞内miR-155-5p水平,而是通过上调THP-1细胞外泌体中miR-155-5p后,由HOMF细胞摄取外泌体而间接上调HOMF细胞内miR-155-5p,引起细胞内氧化还原失衡并最终向活化表型转化。
外泌体在调控细胞间信号转导、物质转运等方面的作用正受到越来越多研究人员的关注。外泌体中所包含的种类丰富的miRNA不仅参与细胞生物功能的调控,还为疾病诊断和预后评估提供了潜在生物标志物[22]。研究发现miR-155 可在耐药细胞中的外泌体内富集,并跟随外泌体转移到乳腺癌细胞[23]。急性肺损伤小鼠的血清外泌体可以将miR-155 传递到巨噬细胞,分别通过靶向SHIP1 和SOCS1 促进巨噬细胞增殖和炎症[24]。
本研究中,我们首次证实槟榔碱可诱导THP-1细胞分泌富含miR-155-5p的外泌体,该外泌体可进一步被HOMF细胞摄取并促进细胞向成纤维表型转化。这一发现拓展了槟榔碱诱导OSF的发病机制,口腔黏膜下炎症细胞与口腔成纤维细胞间外泌体通讯可能是治疗槟榔碱相关OSF的新靶点。
