外泌体微小RNA在糖尿病并发症中的作用及其运动干预*
2023-02-26唐韶慨耿元文林琴琴李若明王柏慧
唐韶慨 耿元文 林琴琴 李若明 王柏慧
(燕山大学体育学院,秦皇岛 066004)
糖尿病是一类由胰岛素分泌不足或胰岛素功能缺陷等多种原因引起的、以慢性高血糖为特征的代谢性疾病,其主要表现为胰岛素的绝对或相对缺乏以及靶细胞对胰岛素的敏感性降低[1]。根据国际糖尿病联合会的数据显示,到2045 年,全球糖尿病患者人数预计将增加至6.93亿[2]。持续的血糖水平慢性升高可造成广泛性血管损伤,从而导致各种“微血管”(肾病、视网膜病变和神经病变)和“大血管”(心血管疾病)并发症,严重损害患者身心健康,并给全球卫生系统带来巨大负担。目前,应用治疗性胰岛素和口服降血糖药是有效控制糖尿病患者血糖水平的主要方法[3]。然而,长期使用胰岛素和降糖药物会引起不同程度的副作用,外源性胰岛素仍然不足以代替内源性胰岛素的天然活性,同时存在低血糖、过敏反应、胰岛性水肿等风险。此外,胰岛移植是一种侵入性较小的替代方案,但在实现胰岛素独立性方面效果较差[4]。因此,深入探讨糖尿病并发症病理机制并筛选潜在的治疗靶点具有重要的基础理论和临床应用价值。
外泌体(exosomes,EXs)是一种几乎所有细胞均可分泌且具有磷脂双层膜结构的细胞外囊泡(extracellular vesicles,EVs),其直径约50~150 nm,包含母细胞来源的脂质、蛋白质、核酸等内容物[5]。其中微小RNA(microRNAs,miRNA)是EXs的重要功能内容物[6],具有治疗糖尿病并发症的潜力。例如,骨髓间充质干细胞来源EXs miR-146a 可直接靶向细胞命运决定子(NUMB,)激活β连环蛋白(β-catenin)信号,改善β细胞胰岛素分泌,进而保护糖尿病β 细胞功能障碍,miR-146a/NUMB/β-catenin信号通路是骨髓间充质干细胞EXs改善高血糖诱导β细胞功能障碍的关键介质[7]。近来研究表明,不同运动方式均可影响循环EXs的生物功能。运动可促进EXs 释放增加并进入到循环内,通过其携带的miRNA 及各种内容物增加抗氧化能力、改善心血管功能、维持葡萄糖稳态和增强脂肪酸氧化,进而在糖尿病并发症中发挥有益效应[8]。本文系统梳理不同细胞来源EXs miRNA 在糖尿病并发症中的作用,并全面总结不同运动方式对EXs miRNA的影响以及运动介导EXs miRNA调控糖尿病并发症的潜在分子机制,以期为运动防治糖尿病并发症的靶点筛选及预后诊断提供理论参考。
1 EXs组成及功能概述
EXs作为EVs的亚型之一,是在体外培养的绵羊网织红细胞向成熟红细胞分化过程中,在细胞上清液中发现并分离的磷脂双分子层小囊泡,其直径约30~150 nm(平均100 nm),密度在1.13~1.19 g/m之间,在透射电子显微镜下可以被识别为膜结合结构的异质群体(“杯状”或“碟状”)[5]。1983年,Pan 和Johnstone[9]首次发现此类功能囊泡,在1989 年被定义为EXs[10]。研究发现,原核和真核生物细胞在正常或异常的生理状态下均可释放EXs[11],血浆、尿液、精液、母乳、腹水、唾液、淋巴液、泪液和汗液等体液中均有EXs的分布。与其他EVs亚型(凋亡小体和微囊泡)相比,EXs在生物合成、起源、含量、形态、大小和包含内含物等方面存在差异。EXs是最小的EVs,其大小取决于不同的细胞源类型,可由细胞不断释放,而凋亡小体和微囊泡只能由活化或凋亡的细胞所释放[12]。EXs 可参与各种生物过程,如抗原呈递、免疫反应、肿瘤生长和细胞分化等[13]。
EXs的生物发生过程包括:a.细胞质膜的向内萌芽(胞吞)形成早期核内体;b.早期核内体产生晚期核内体;c.含有腔内囊泡的细胞内多囊泡体(multivesicular bodies,MVBs)。MVBs 与质膜融合后,腔内囊泡以EXs形式释放到细胞外,以多种形式转运至靶细胞,通过被靶细胞摄取利用,进而调控靶细胞生物功能,MVBs与溶酶体或自噬体融合后被降解[14]。通常情况下,转运必需核内复合物(endosomal complex required for transport,ESCRT),如ESCRT-0、ESCRT-I、ESCRT-II和ESCRT-III及其附属蛋白调控EXs 的生物发生、形成以及囊泡脱落[15]。独立于ESCRT机制,鞘脂神经酰胺[16]、二磷酸腺苷核糖基化因子6(ADPribosylation factor 6,ARF6)及其效应磷脂酶D2(phospholipases D2,PLD2)同样控制EXs 的生物发生[17]。RAB 家族蛋白对EXs 的分泌调控依赖于细胞环境,如RAB27A、RAB27B、RAB11、RAB35 和RAB7 均可调节EXs 分泌[18]。EXs 表面存在大量特殊的膜蛋白质,如四跨膜蛋白(CD9、CD63、CD81 等),携带有DNA、RNA、mRNA、miRNA 和其他非编码RNA、蛋白质、脂质和代谢物等多种物质,通过自分泌、旁分泌及内分泌等方式被靶细胞、靶组织或器官吸收[14]。EXs 以多种方式与靶细胞相互作用并调节其代谢表型(图1)。a.EXs通过表面蛋白质与靶细胞质膜受体相互作用并激活其下游信号转导;b.EXs与靶细胞的质膜融合,将物质输送到靶细胞的细胞质中;c.EXs被靶细胞吞噬或内吞,传递到靶细胞特定细胞器中[19]。研究证实,miRNA 在EXs 中的水平高于其母细胞[20],参与细胞间的信息传递和物质交流等进程,可作为疾病的潜在治疗靶点。

Fig.1 Formation and biological characteristics of EXs图1 EXs的形成与生物学特性
2 EXs miRNA与糖尿病并发症
miRNA 是一类长约18~24 个核苷酸的单链RNA 分子,为EXs 重要的功能内容生物分子,因其在基因表达中的调节作用而引起广泛关注。miRNA 可通过与靶mRNA 的3'-非翻译区(UTR)或开放阅读框(ORF)区域结合,在转录后水平参与基因表达调控[21]。EXs 因具有稳定性高、毒性及免疫原性低等特征且兼具特异靶向效应,因此被认为是最佳的递送载体。内源性miRNA 可以通过EXs从供体细胞功能性地递送至受体细胞,EXs的脂质双层可包被miRNA 免受核糖核酸酶(RNase)降解,保证miRNA 稳定性[6,22]。因此EXs 可充当miRNA 与靶细胞通信的载体。近年来诸多研究报道,不同细胞来源的EXs miRNA 在糖尿病并发症的病理发生发展中发挥重要的调节作用(表1),可能作为未来糖尿病并发症诊断、预后和个性化治疗的关键切入点。
2.1 EXs miRNA与糖尿病肾病
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病高发的慢性微血管并发症,严重患者可导致肾衰竭及肾功能不全,是糖尿病终末期肾脏疾病的主要原因之一。研究表明,尿液因具有便于收集等优点常被用于评估DKD 患者肾脏损伤程度的临床样本,尿液来源EXs miRNA可用于分析DKD患者的相关临床特征。与2 型糖尿病(diabetes mellitus type 2,T2DM)患者相比,DKD患者的尿液EXs 中miR-4534 和miR-19b-3p 表达明显升高,DKD 患者尿液EXs miR-4534 和miR-19b-3p 的表达水平与蛋白尿的严重程度呈正相关,说明尿液EXs miR-4534 和miR-19b-3p 可作为DKD 辅助诊断标准之一。此外,尿液EXs miR-4534 可能通过激活叉头框转录因子1(forkhead box,FOXO1)/硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)介导的氧化应激途径,加重足细胞损伤,参与DKD 病理进展[23-24]。与T2DM 肾功能正常患者相比,DKD患者尿液EXs miR-21-5p和miR-23b-3p 显著上调,miR-30b-5p 和miR-23b-5p表达显著降低[25],说明EXs miRNA 在DKD 患者尿液中的差异表达可作为潜在诊断生物标志物。另有研究证实,EXs miRNA是DKD生理病理发展进程的重要调节因子。DKD 患者血清来源EXs 可显著促进HK-2细胞中miR-4449及促炎细胞因子白介素-1β(interleukin-1β,IL-1β)和IL-18 表达上调,进而靶向抑制肿瘤高甲基化基因1表达,促进其焦变和氧化应激[26]。脂肪来源的干细胞EXs miR-215-5p 通过直接靶向抑制E 盒结合锌指蛋白2(e-box binding zinc finger protein 2,ZEB2)的表达,显著抑制葡萄糖升高诱导的足细胞迁移和凋亡,从而改善足细胞损伤诱导的DKD[27]。此外,足细胞损伤是DKD 发病的重要诱因,足细胞来源EXs miR-221 可靶向Wnt 信号通路调控因子Dickkopf基因2(dickkopf WNT signaling path-way inhibitor 2,DKK2),调节Wnt/β-catenin 信号介导DKD小鼠肾小管细胞分化损伤[28]。间充质干细胞衍生EXs miR-125a 可靶向组蛋白去乙酰化酶1(histone deacetylase 1,HDAC1),下调内皮素-1(endothelin-1,ET-1)表达,减轻DKD大鼠蛋白尿症状和肾脏损伤,保护肾功能[29]。
综上所述,尿液来源EXs miRNA 水平变化可反映DKD 的发展进程,而目前血液等易检测体液作为DKD 生物标志物研究相对较少。此外,EXs miRNA在DKD发生机制研究中多与肾小管上皮细胞、足细胞及干细胞相关,通过调节靶基因及信号通路改善肾脏组织细胞病理状态,但未见报道系膜细胞来源EXs miRNA促进DKD肾脏功能恢复的具体机制,有待深入研究。
2.2 EXs miRNA与糖尿病视网膜病变
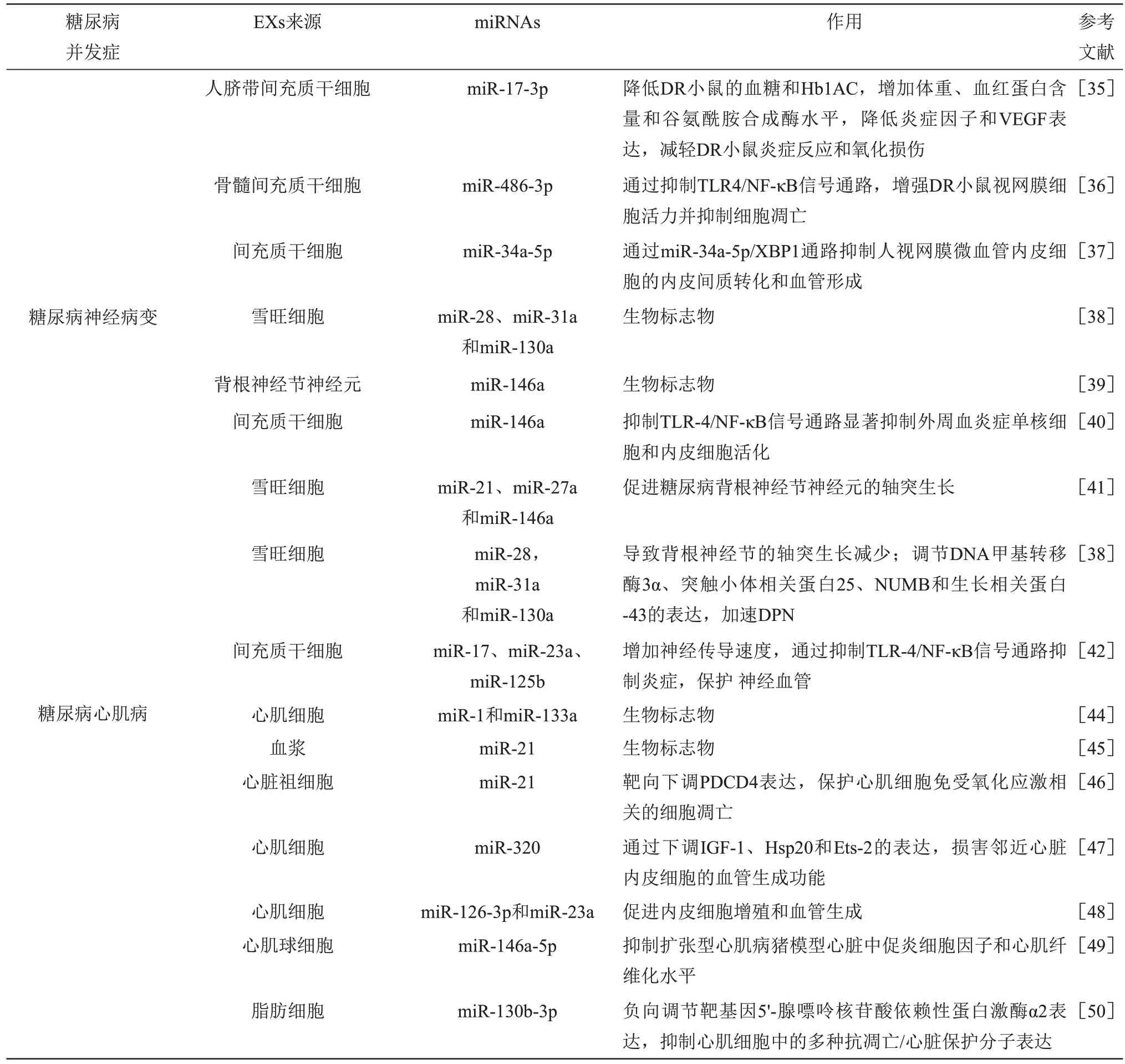
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的常见且具有潜在破坏性的微血管并发症,预计到2045 年,全球DR 成年患者可增加到1.605亿[30]。研究证实,EXs miRNA 可作为诊断DR的新型生物标志物。与健康患者及T2DM非DR患者相比,非增殖性DR 患者及增殖性DR 患者血液EXs miR-15a 显著升高,且EXs miR-15a 与DR患病严重程度呈正相关[31]。采用受试者工作特征曲线法分析血清EXs miR-377-3p对T2DM DR患者及T2DM患者的诊断价值,发现曲线下面积(AUC)为0.778 1(95%置信区间=0.638 3~ 0.918 0)[32],表明EXs miR-15a和miR-377-3p可能作为糖尿病视网膜损伤的候选生物标志物。研究发现,EXs miRNA在DR的发生发展过程中发挥重要作用,特别是在视网膜细胞功能障碍中。高糖处理的视网膜色素上皮细胞可分泌EXs,富含miR-202-5p的EXs可抑制人脐静脉内皮细胞的生长、转移和血管生成,通过转化生长因子β 受体2(transforming growth factor receptor 2,TGF)/母亲DPP同源物(mothers against decapentaplegic homolog,Smad)信号通路抑制内皮细胞间质转化,阻止增殖性DR患者视网膜纤维化的进展[33]。升高葡萄糖水平会降低视网膜细胞释放的EXs 中抗血管生成miR-106a-5p、miR-20a-5p 和miR-20a-3p 的水平,调节血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,从而促进视网膜光感受器的损伤[34]。另有研究证实,间充质干细胞来源EXs miRNA对于治疗DR具有良好的效果。注射过表达的人脐带间充质干细胞来源EXs miR-17-3p可降低DR 小鼠的血糖和糖化血红蛋白(glycosylated hemoglobin,HbAlc),增加体重、血红蛋白含量和谷氨酰胺合成酶水平,降低炎症因子和VEGF 表达,减轻DR小鼠炎症反应和氧化损伤,并通过抑制信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1)抑制视网膜细胞凋亡[35]。骨髓间充质干细胞来源EXs miR-486-3p可通过抑制Toll样受体4(tolllikeReceptor4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)信号通路,增强DR 小鼠视网膜细胞活力并抑制细胞凋亡,缓解DR小鼠的病理状态[36]。间充质干细胞衍生EXs lncRNA SNHG7可通过miR-34a-5p/X盒结合蛋白1(x-box binding protein-1,XBP1)通路抑制人视网膜微血管内皮细胞的内皮间质转化和血管形成[37]。
综上所述,DR患者中,血液EXs miRNA与眼部微血管状态相关。在病理状态下,外源性EXs miRNA 可参与内皮细胞损伤、血管炎症和视网膜细胞功能障碍等病理过程,上游细胞分泌EXs miRNA 可通过激活/抑制下游细胞凋亡、炎症及血管生成等信号通路,在DR的诊治进展中发挥重要作用,但其机制还有待完善。
2.3 EXs miRNA与糖尿病周围神经病变
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是由糖尿病患者神经元功能障碍引起的一组异质性疾病,是糖尿病患者中高度复杂的并发症之一。研究发现,miRNA 在EXs 中稳定存在且含量丰富,可作为DPN 预后评估的生物标志物。与非高糖处理的雪旺细胞来源EXs 相比,高糖处理的雪旺细胞来源EXs miR-28、miR-31a和miR-130a显著升高[38]。高血糖状态下DPN小鼠背根神经节神经元中miR-146a 的表达显著下调,且与白细胞介素1 受体相关激酶1(interleukin-1 receptor-associated kinase,IRAK1)和肿瘤坏死因子受体相关因子6(tumor necrosis factor receptorassociated factor 6,TRAF6)水平呈负相关[39]。此外,工程化的间充质干细胞来源EXs 富含miR-146a,可通过抑制TLR-4/NF-κB信号通路显著抑制外周血炎症单核细胞和内皮细胞活化,进而缓解患有DPN 的糖尿病小鼠神经血管功能障碍[40],表明EXs miR-28、miR-31a、miR-130a及miR-146a对于DPN的早期识别及诊断具有重要价值。诸多研究证实,雪旺细胞可与神经元轴突相互作用,其衍生EXs miRNA 与DPN 的病理发生发展密切相关。正常雪旺细胞来源的EXs miR-21、miR-27a 和miR-146a可通过促进糖尿病背根神经节神经元的轴突生长,改善T2DM 小鼠的DPN[41]。高糖处理的雪旺细胞来源EXs 含有高水平的miR-28、miR-31a 和miR-130a,可导致背根神经节的轴突生长减少。将EXs注射至糖尿病小鼠坐骨神经后,EXs miRNA 可调节DNA甲基转移酶3a(DNA methyltransferases 3a,DNMT3a)、突触小体相关蛋白25(synaptosomalassociated protein of 25 kDa,SNAP25)、NUMB 和生长相关蛋白43(growth associated protein 43,GAP43)的表达,进而促进DPN 的发展进程[38]。另有研究证实,间充质干细胞来源EXs miRNA 可保护DPN 神经血管功能。间充质干细胞来源EXs miR-17、miR-23a、miR-125b可显著降低糖尿病小鼠对热和机械刺激的阈值,增加神经传导速度。通过抑制TLR-4/NF-κB 信号通路进而抑制炎症,特异性保护DPN小鼠神经血管功能[42]。
综上所述,EXs miRNA 对于DPN 诊断方面的研究局限于雪旺细胞体外实验,尚无EXs miRNA临床试验诊断研究。在DPN 发展过程中,不同细胞来源EXs miRNA 可能通过EXs 转运到神经组织细胞中,如神经元、雪旺细胞等,通过促进/抑制神经元增长、抑制DPN 相关炎症等,为DPN 治疗提供可行性方案;其中雪旺细胞来源EXs miRNA与其受体轴突及靶基因的相互作用可能是治疗DPN 的关键作用机制,但相关研究尚少,仍需进一步探讨。
2.4 EXs miRNA与糖尿病心肌病
糖尿病心肌病(diabetic cardiomyopathy,DCM)是1972 年首次报道的一种特殊形式的心脏病,被定义为糖尿病、独立高血压和冠心病患者的心肌结构和功能异常[43]。研究发现,EXs miRNA可作为DCM 无创检测生物标志物。与正常饮食小鼠相比,高脂膳食诱导的胰岛素抵抗小鼠的循环miR-1和miR-133a水平显著升高,显示出更高的心肌脂肪变性。与健康患者相比,T2DM心肌脂肪变性患者心肌细胞中miR-1 和mi-133a 水平升高。此外,负载脂质的HL-1心肌细胞所释放的EXs miR-1和miR-133a 水平同样较高[44]。与T2DM 非DCM患者相比,DCM组血浆miR-21水平显著下调,且miR-21的诊断效率(AUC=0.899)显著高于HbA1C等参数[45]。此外,心脏祖细胞衍生的EXs miR-21 可通过靶向下调程序性细胞死亡因子4(programmed cell death factor 4,PDCD4)表达,保护心肌细胞免受氧化应激相关的细胞凋亡[46]。表明EXs miR-1、miR-133a 及miR-21 可能作为糖尿病心肌损伤的生物标志物。另有诸多研究证实,EXs miRNA在DCM进展中扮演重要角色,与心肌损伤和心肌血管生成障碍密切相关。心肌细胞富集的EXs miR-320可转移至小鼠心脏内皮细胞,通过下调胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)、热休克蛋白20(heat shock protein 20,Hsp20)和E26转录因子2(E-twenty six 2,Ets-2)的表达,损害邻近心脏内皮细胞的血管生成功能,表明EXs miR-320 具有抗血管生成功能[47]。葡萄糖匮乏可增加心肌细胞来源EXs miR-126-3p 和 miR-23a分泌,EXs miR-126-3p和miR-23a 可介导心肌细胞和内皮细胞通信建立,从而促进内皮细胞增殖和血管生成[48]。注射过表达心肌球源性细胞EXs miR-146a-5p 可显著抑制扩张型心肌病猪模型中心脏促炎细胞因子和心肌纤维化水平,恢复心功能[49]。糖尿病心肌缺血再灌注损伤小鼠心肌注射脂肪细胞来源EXs miR-130b-3p 可显著促进小鼠心肌细胞凋亡,扩大心梗面积。其机制为miR-130b-3p负向调节靶基因5'-腺嘌呤核苷酸依赖性蛋白激酶α 2表达,进而抑制心肌细胞中的多种抗凋亡/心脏保护分子表达,加剧糖尿病心肌缺血再灌注损伤[50]。
综上所述,EXs miRNA可能作为DCM诊断及预后检测的潜在生物标志物,且EXs miRNA 有望成为改善高糖条件下受损心脏功能的有效治疗靶点。但目前研究主要局限于心脏组织细胞来源EXs miRNA 调节内皮细胞功能、促进血管生成、抑制心肌细胞凋亡及炎症等病理进程,后续研究仍需对不同组织细胞来源EXs miRNA在DCM的诊断和治疗作用机制进行深入研究。
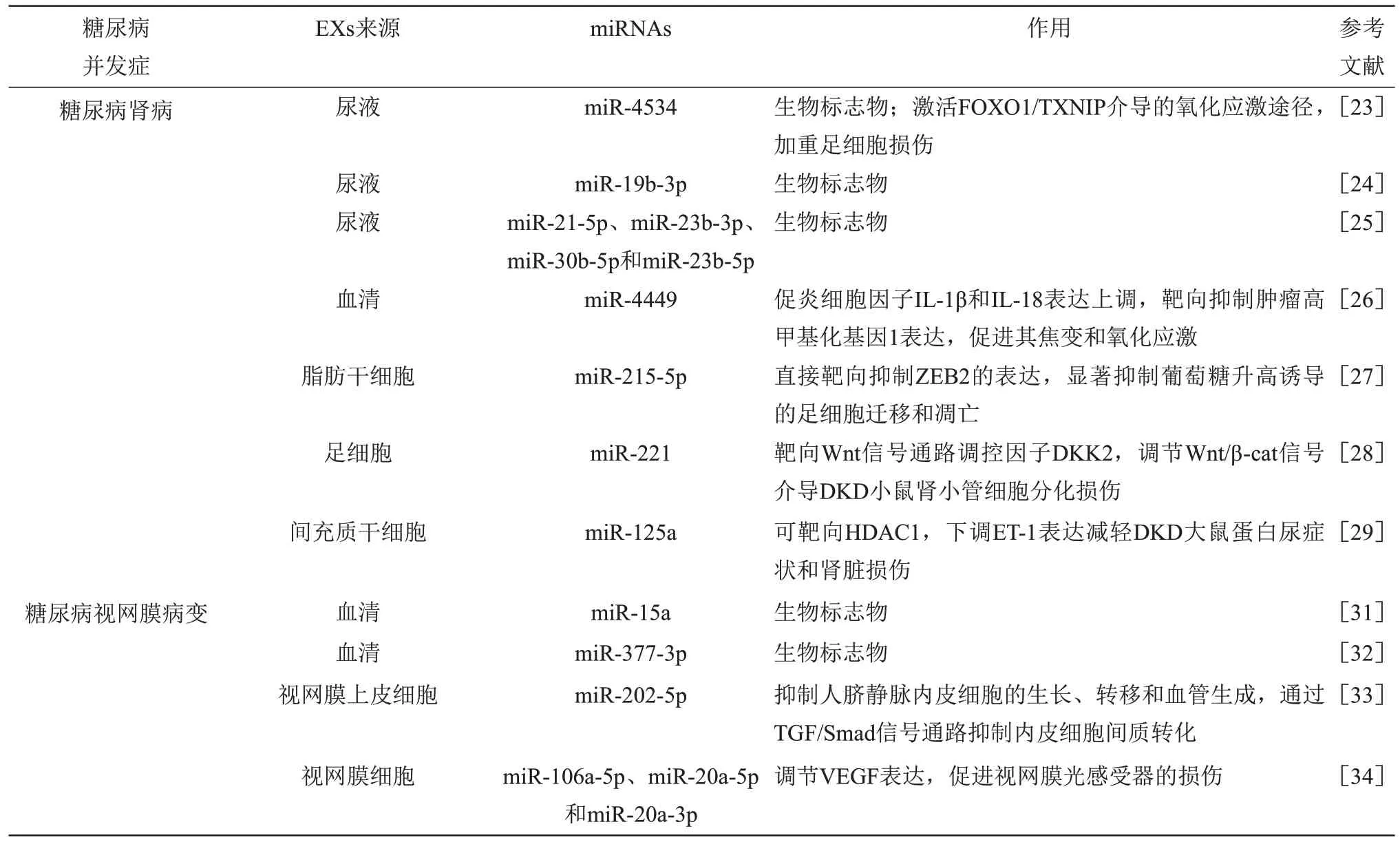
Table 1 Mechanisms of different cell-derived EXs miRNAs involved in diabetic complications表1 不同细胞来源EXs miRNA参与糖尿病并发症的作用机制
续表1
3 运动对EXs miRNA的影响
运动训练和身体活动被认为是预防和治疗疾病的基石,可作为糖尿病并发症除常规治疗外的非药物干预手段。EXs miRNA 作为运动与糖尿病并发症发生关联的关键介质,可作为糖尿病并发症的潜在治疗靶点。运动对EXs miRNA 的影响研究尚处于初始阶段,不同运动方式改变EXs及其内容物的释放被认为是系统适应性变化的标志[51]。因此,本文将从急性运动和长期运动两个维度进行归纳总结(表2)。
3.1 急性运动与EXs miRNA
研究表明,急性运动可上调EXs miRNA 表达水平。招募26名每周至少进行2次有氧运动的健康男性受试者进行一次全程马拉松比赛,采集运动员赛前、赛后、赛后2 h 和赛后1 d 血液并分离尿液EXs,发现EXs miRNA(如血浆中hsa-miR-424-5p、hsa-miR-361-5p、hsa-miR-223-3p和hsa-miR-223-5p,尿液中hsa-miR-218-5p、hsa-miR-3158-3p、hsamiR-3158-5p 和hsa-miR-517a-5p)以时间依赖性的方式发生显著增加,说明血浆或尿液中的EXs miRNAs可能是全程马拉松运动员生理应激的高度敏感生物标志物[52]。单次等惯性阻力训练可显著增加正常健康男性循环EXs 和EXs 包裹的miR-206和miR-146a 表达水平[53]。通过对有耐力训练史的老年男性进行40 min有氧运动和3 h急性运动后采集血浆并分离EXs,发现与久坐老年男性相比,训练史组老年男性血浆EXs中miR-486-5p、miR-215-5p和miR-941 较基线表达显著增加,而miR-151b 显著下降,此4个EXs miRNA在调节IGF-1的信号传导中起着重要作用[54]。10 名健康年轻男性进行单回合高强度间歇自行车运动后,血浆来源EXs miR-1-3p、miR-16-5p、miR-23a-3p、miR-23b-3p、miR-208a-3p、miR-105-5p、miR186-5p、miR-222-3p、miR-451a、miR-486-5p、miR-378a-5p及miR-126-3p在运动后增加[55]。有训练经历的3名男性和5名女性进行最大吸氧量(VO2max)、无氧阈值(AnaT)和有氧阈值(AerT)测试,AerT 测试后汗液EXs中miR-21 和miR-26 显著升高,AnaT 测试后血清EXs中miR-21和miR-222升高。有趣的是,汗液中EXs 携带的miR-26 在AerT 后升高10 倍,在AnaT后升高近30 倍,在VO2max 后显著升高40 倍,其随着运动负荷的增强而增加[56]。与上述研究相反,急性运动可下调EXs miRNA 表达。Wistar 大鼠历经急性有氧运动后,血清来源EXs rno-miR-128-3p、rno-miR-103-3p、rno-miR-148a-3p、rno-miR- 191a-5p、rno-miR-93-5p、rno-miR-25-3p、rnomiR-142-5p 和rno-miR-3068-3p 显著降低[57]。健康男性进行低负荷血流限制阻力运动后,血液EXs中hsa-miR-21-5p、hsa-miR-19b-3p、hsa-miR-17-5p、hsa-miR-221-3p、hsa-miR-150-5p 和hsa-miR-340-5p显著降低[58]。急性轻度至中度运动可显著降低健康男性运动后前24 h 内循环EXs 的miR-31 表达[59]。上述研究表明,急性运动可调控EXs miRNA差异性表达,且EXs miRNA表达与急性运动模式、运动方案、研究对象、EXs来源、EXs提取时间、EXs分离技术等影响因素有关。此外,目前研究多为急性有氧运动对血浆来源EXs miRNA影响研究,急性抗阻运动及急性间歇运动调控不同来源EXs miRNA 表达报道尚少,相关机制仍需深入探究。
3.2 长期运动与EXs miRNA
研究证实,长期运动可显著增加EXs miRNA表达水平。小鼠进行4周中等强度有氧运动后,内皮祖细胞来源EXs中miR-126显著升高,通过快速发育生长因子同源蛋白1(SPROUTY-related enabled/vasodilator-stimulated phosphoprotein homology1 domain 1,SPRED1)/VEGF途径降低内皮细胞凋亡,改善血管生成功能[60]。8周有氧运动显著上调db/db 小鼠心肌细胞来源EXs miR-455和miR-29b 表达,EXs miR-455 和miR-29b 可靶向下调基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)表达,减轻MMP9的下游效应应答,进而导致细胞外基质重塑[61]。最新实验研究发现,短暂性脑中动脉阻塞诱导缺血性脑卒中大鼠进行4周有氧运动后,大鼠脑脊液EXs 中16 个miRNA(如miR-370-3p、miR-92b-3p 和miR-92b-5p)表达上调。分析证实,这些EXs miRNA 与中风的病理生理过程有关,包括轴突引导、NF-κB信号通路、硫胺素代谢和丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)信号通路,表明调节多种信号通路的EXs miRNA 可能参与运动的神经保护作用,这些因运动而改变的miRNA 可能是脑缺血的治疗策略或靶点[62]。体内实验研究发现,4周游泳运动可显著增加心肌缺血再灌注损伤大鼠血浆EXs miR-342-5p表达水平,EXs miR-342-5p具有心肌保护作用。进一步通过离体心肌细胞实验证实,EXs miR-342-5p可靶向抑制促凋亡基因胱天蛋白酶9(caspace-9,CAP-9)和c-Jun 氨基末端激酶2(c-jun N-terminal kinase 2,JNK2)表达,增强心肌细胞生存信号蛋白激酶B(protein kinase B,Akt),减轻缺氧/复氧诱导的心肌细胞凋亡,缓解心肌损伤[63]。8周长期有氧运动显著增加肥胖健康女性血浆EXs中miR-150、miR-320a和miR-124a水平,其中EXs miR-124a和miR150水平与炎症标志物(如脂联素、肿瘤坏死因子α或IL-6)以及氧化应激标志物(亚硝酸盐)之间存在显著相关性[64]。与无运动训练史男性相比,有训练史男性进行定期运动后,25 年以上定期训练组中血清EXs miR-411-3p 显著上调[65]。另有研究证实,身体活动可显著降低EXs miRNA 水平。肥胖小鼠进行8 周长期有氧运动训练,采集小鼠血清并分离EXs,发现miR-122、miR-22 和miR-192 水平显著降低,其中miR-22 水平与脂肪生成和胰岛素敏感性标志物葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的表达呈负相关,miR-122水平与脂肪变性评分和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)表达呈负相关[66]。长期运动可显著降低短暂性脑中动脉阻塞诱导缺血性脑卒中大鼠脑脊液EXs 中miRNA(如miR-3068-5p、miR-665 和miR-136-5p)表达[62]。另有动物实验发现,高脂饮食诱导肥胖小鼠进行长期有氧运动后,小鼠血浆EXs miR-191-5p表达显著降低,且证实沉默miR-191-5p 可促进白色脂肪组织褐变[67]。综上结果可见,目前多数研究集中于长期有氧耐力运动对血浆来源EXs miRNA 的调控影响,长期间歇运动及长期抗阻运动调控不同细胞来源EXs miRNA 研究少见报道。此外,在疾病状态下,长期运动可介导EXs miRNA 通过调节炎性、脂肪生成及胰岛素敏感性等标志物,抑制细胞凋亡、促进白色脂肪组织褐变等发挥保护作用,但长期运动改变EXs miRNA 表达是否为机体对运动应激的适应性反应未见报道。

Table 2 Effects of different exercise on the regulation of EXs miRNAs from different sources表2 不同运动对不同来源EXs miRNA的调控影响
4 运动介导EXs miRNA干预糖尿病并发症的可能机制
运动是人类健康的基本组成部分,也是治疗和预防胰岛素抵抗等代谢疾病的非药物治疗方式。运动作为应激源可诱导不同类型细胞EXs 的释放增加,EXs 作为载体可携带miRNA 转移到邻近或远端的靶细胞以介导细胞间通讯,进而发挥调节作用[8]。运动介导EXs miRNA 缓解糖尿病并发症的作用是确切的,但其分子机制仍需进一步阐明。
4.1 运动介导EXs miRNA改善内皮细胞功能和胰岛素敏感性
内皮细胞功能障碍是糖尿病并发症的主要危险因素,内皮细胞功能改善有助于缓解糖尿病并发症。研究证实,运动可促进EXs 释放,改善内皮细胞病变。4周中等强度运动可促使健康小鼠内皮祖细胞来源EXs 中miR-126 显著升高,EXs miR-126 可靶向SPRED1/VEGF 信号通路,降低内皮细胞凋亡,修复内皮损伤并促进血管生成,保护内皮细胞功能,从而降低糖尿病心血管并发症风险因素[60]。另有研究证实,胰岛素敏感性紊乱和葡萄糖耐受不良作为糖尿病并发症主要诱因之一,运动可介导EXs miRNA 对胰岛素抵抗人群的胰岛素敏感性和葡萄糖耐受产生有益影响。C57BL/6J 雄性小鼠进行5周高强度间歇运动训练,肌肉细胞来源EXs miR-133a 和miR-133b 显著增加,且其靶向抑制小鼠肝脏中FoxO1表达,改善胰岛素敏感性和葡萄糖耐量,降低糖尿病并发症患病风险[68]。8周有氧运动显著上调肥胖小鼠血清来源EXs miR-22 和miR-122水平,EXs miR-22可抑制白色脂肪组织中CCAAT增强子结合蛋白A(CCAAT enhancer binding protein A,CEBPA)、PPARγ 和脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)基因的表达和三磷酸腺苷柠檬酸裂解酶的活性;EXs miR-122可抑制肝脏脂肪变性和PPARγ的表达,改善肥胖小鼠胰岛素敏感性[66]。另研究证实,有氧运动可促进肥胖小鼠脂肪组织来源EXs miR-99b被肝脏吸收,进而下调肝细胞中成纤维细胞生长因子21 的表达水平,维持肥胖小鼠全身葡萄糖和脂质稳态[69]。
综上所述,有氧运动可上调EXs miRNA表达,通过SPRED1/VEGF轴改善内皮细胞功能障碍。间歇运动和有氧运动均可促进EXs miRNA 上调,抑制其靶基因表达进而降低胰岛素敏感性。未来进一步探讨运动调控EXs 及其内容物miRNA 的分子机制,可为糖尿病并发症治疗提供多元化策略。
4.2 运动介导EXs miRNA改善脂肪代谢和细胞凋亡
脂肪代谢在糖尿病并发症的病理进展中扮演重要角色,其功能紊乱是糖尿病并发症病变的主要诱因之一。研究证实,运动可介导EXs miRNA 维持脂肪代谢平衡。8 周有氧运动可显著上调db/db 小鼠心肌细胞来源EXs miR-455 和miR-29b 表达,降低miR-455 和miR-29b 靶基因MMP9 的表达,减轻心脏纤维化和肌细胞解耦,缓解肪代谢平衡,改善糖尿病心脏并发症[61]。此外,运动通过EXs miRNA 可改善心血管功能。C57BL/6 小鼠接受大脑中动脉闭塞中风手术后进行4 周适度有氧运动,血浆和脑组织中循环内皮祖细胞来源的EXs水平及其携带的miR-126 显著上调,miR-126 水平与小鼠脑组织梗死体积和细胞凋亡呈负相关,而与微血管密度呈正相关。此外,循环内皮祖细胞来源的EXs miR-126 可通过磷脂酰肌醇3 激酶(phosphatidylinositol 3-kinase,PI3K)/Akt 信号通路抑制缺氧诱导的细胞凋亡,恢复受损的轴突生长能力,保护神经元,减轻动脉缺血导致的缺血性损伤[70]。赛艇男性运动员和无运动经验男性学员进行1年赛艇训练干预,结果发现两组血浆EXs直径均约在50~200 nm之间,与无运动经验学员运动组相比,运动员组血浆EXs miR-342-5p 水平增加80%。动物实验研究证实,通过对心肌缺血再灌注损伤大鼠单次心肌点注射外泌体后发现,与安静对照组相比,运动组大鼠循环外泌体显著减少心肌缺血再灌注引起的心肌梗死。PCR 测序发现,miR-342-5p 是运动外泌体发挥心肌保护作用的关键介质。体外研究进一步证实,EXs miR-342-5p可靶向抑制心肌细胞CASP-9 和JNK2 表达,下调Mg2+/Mn2+依赖性蛋白磷酸酶1F 信号表达,增强心肌细胞Akt信号,抑制心肌缺血再灌注诱导的心肌细胞凋亡,保护心功能[63]。
由此可见,长期运动可调控EXs miRNA含量。体内外实验证实,运动后EXs miRNA 表达上调可为脂肪代谢平衡和抗细胞凋亡信号传导创造条件,进而降低糖尿病并发症风险。因此推测,EXs miRNA 表达改变可能为运动防治糖尿病并发症的关键介质。
4.3 EXs作为“exerkines”潜在载体
运动刺激机体骨骼肌等内分泌器官释放的某些内源性细胞因子、抗凝血肽和代谢物称为运动因子(exerkines)[71]。目前已报到75%的运动因子存在于EXs中[72]。EXs 具有独特的包装保护作用,可帮助运动因子免受RNase的影响,装载运动因子转移至细胞外环境[73]。研究表明,EXs 可作为运动期间运动因子的重要载体,可携带运动因子发挥生物功能。葡萄糖剥夺条件下的心肌细胞可以释放含有葡萄糖转运蛋白1(glucose transporter-1,GLUT-1)和GLUT-4以及乳酸脱氢酶(lactate dehydrogenase,LDH)和甘油醛-3-磷酸脱氢酶的EXs,这些EXs被邻近的内皮细胞吸收,从而促进葡萄糖摄取、糖酵解和丙酮酸的产生[74]。将雄性Fisher 大鼠暴露于急性应激条件下,大鼠循环血浆EXs将包装Hsp72,促进Hsp72 浓度增加并减少EXs miR-142-5p和miR-203表达,改善大鼠免疫调节功能,抑制促炎细胞因子释放[75]。另有研究证实,运动可调控携带运动因子的EXs 释放,参与疾病发生发展进程。6 周耐力训练可促进健康雄性小鼠血液EXs 中Hsp60水平增加并释放到循环中,进而促进过氧化物酶体增殖物激活受体γ 及其共激活子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)和线粒体DNA 拷贝数的表达增加,改善机体代谢中的葡萄糖稳态[76]。有氧运动可显著降低老年雄性大鼠血液EXs 中CD63蛋白表达及超氧化物歧化酶(superoxide dismutase,SOD)活性,并提高乙酰胆碱酶活性,保护老年小鼠脑组织中受损细胞的氧化状态[77]。与肥胖健康男性相比,T2DM肥胖男性急性运动后血浆EXs 中携带的CD36 和脂肪酸转运蛋白4(fatty acid transport protein 4,FATP4)表达增加[78]。
综上可见,EXs可作为运动因子的载体,可装载运动因子释放至循环中。此外,运动可调控EXs介导其携带的生物活性因子促进组织-器官间“cross talk”,在糖尿病并发症的病理调控中发挥有益作用。然而,EXs-exerkines 途径与运动之间的分子机制仍有待探索。
5 结论与展望
综上所述,不同细胞来源EXs miRNA 在DKD、DR、DPN 和DCM 的发生发展中发挥关键作用,可能作为未来防治糖尿病并发症的新型生物标志物及治疗靶点。与此同时,运动作为糖尿病并发症的非药物干预手段,不同类型和不同强度的运动均可诱导EXs 释放,通过调控EXs miRNA 表达改善内皮细胞功能和胰岛素敏感性、维持脂肪代谢平衡和抑制细胞凋亡、促进血管生成和增强葡萄糖稳态等作用,参与糖尿病并发症的病理进程。
目前,EXs因其独特的细胞间通讯功能已受到广泛关注,但关于EXs miRNA、糖尿病并发症与运动之间的研究文献相对较少,仍存在诸多亟需阐明的问题。a.目前EXs常见的提取方法有超速离心法、沉淀法、分子筛层析法、密度梯度离心法等,每种方法的分离原理及优缺点各有不同。此外,EXs的鉴定可根据大小、浓度、形态以及标记物等多个方面进行分析,同时不同来源EXs携带有组织细胞的特异标记物,因此很难仅通过单一的方法获得纯度较高的EXs或根据单一依据鉴定EXs。b.目前部分研究显示,运动改善糖尿病并发症与长期有氧耐力运动调控血液来源EXs miRNA 有关,但长期或急性抗阻运动及间歇运动在不同运动强度下对不同细胞来源EXs miRNA 的影响及与糖尿病并发症的作用关系研究尚少,且运动后EXs miRNA 改变是否为机体对运动应激的适应性反应未见报道,高糖状态下运动如何影响EXs的形成与释放仍有待探索。c.EXs是运动因子的良好载体,可通过携带运动因子与组织-器官交互作用,在糖尿病并发症的病理调控中发挥有益功能,但运动因子与EXs之间的关系及运动介导EXs-exerkines 途径改善糖尿病并发症的分子机制仍不清晰。未来这些问题的探索与完善可为运动介导EXs miRNA 改善糖尿病并发症的相关研究提供崭新视角。
猜你喜欢
杂志排行
生物化学与生物物理进展的其它文章
- Similarity of Binding Potentials Between Plant DUF538 and Animal Lipocalin: Cholesterol Binding Ability of DUF538*
- 基于脑电信号的癫痫发作预测特征及识别*
- Comparative Proteomic Study on The Lesional and Non-lesional Epidermis From Vitiligo Patients*
- Different Durations of Simulated Weightlessness Induced Depressive-like Behaviors in Rats*
- 洋山港宏病毒组分析揭示CRISPR-Cas系统病毒靶标序列的特异性*
- BE-dot:为单碱基编辑设计sgRNA及预测脱靶图谱的工具*