DNA折纸纳米载体在药物递送中的应用*
2023-02-26梁钰陈天奇李凯樊丽李亮1
梁钰 陈天奇 李凯 樊丽** 李亮1,**
(1)中国农业科学院生物技术研究所,北京 100081;2)内蒙古农业大学园艺与植物保护学院,呼和浩特 010019;3)中国农业科学院农业质量安全与检测技术研究所,北京 100081)
关于脱氧核糖核酸(DNA)的研究已经广泛涉及到遗传学、生物技术、生物医学、癌症研究和诊断等领域。DNA 是大多数生物的遗传物质,作为一种纳米材料是一种新尝试。在纳米生物技术中,DNA 因具有独特的自组装性、生物相容性、可编程性、机械刚性、自分子识别性、结构稳定性、可预测性和可复制性等特性,引起研究者们广泛的兴趣[1]。20世纪80年代,Seeman[2]首次提出了稳定合理的Holliday 结合点设计,将DNA 变成了二维延伸的纳米级聚合物,实现了DNA 的人工定向折叠。这项工作象征着DNA 纳米技术的首次问世。随后,Andersen等[3]用DNA设计并组装了海豚的DNA 纳米形状、Zhang等[4]设计组装出中国地图的DNA纳米形状,DNA纳米技术得到不断发展。目前用DNA 自主装来人工搭建纳米结构主要有两种方法:a.设计和构建DNA-tile 纳米结构,结合黏性末端连接和分枝DNA 连接使DNA-tile 结构聚合来制造二维(2D)或三维(3D)晶格,此即tile自组装[5];b.将天然DNA单链中的长链进行反复折叠,并用短链加以固定,由此绘出一系列DNA 图形,此技术即DNA 折纸术[6]。与tile 自组装方法相比,DNA 折纸术降低了制作纳米结构的难度,并能够构建出复杂且形状多样的结构。本文主要介绍了DNA 纳米技术的分支——DNA 折纸术,归纳了DNA 折纸术在药物递送上的应用,及其进行药物装载与释放的方式,展望了面临的机遇和挑战,为推动药物递送的发展指明方向。
1 DNA折纸
1.1 DNA折纸的基本原理
DNA 折纸技术是DNA 纳米技术的一个分支,是具有前途、效能的技术。所谓的DNA 折纸术,就是把一根长的DNA 单链像折一张纸一样,绑定并铺展成某个形状。DNA 折纸术最早是在2006 年由Rothemund 提出,其技术使用的长DNA 单链是M13mp18 噬菌体的单链DNA,长度为7 249 个碱基,此链称为脚手架链(scaffold)。用来绑定的短链称为订书钉链(staple)或辅助链(helper),每个订书钉链有着多重的结构域,通过交叉碱基配对,将远距离的脚手架链结合在一起,就像编织一样折叠脚手架链(图1),Rothemund[7]用此方法成功折叠出三角形、长方形、五角星和笑脸等图案。一个典型的平面DNA 折纸结构包含大约200个具有特定序列和位置的订书钉链,它们可以在 8 000~10 000 nm2的面积内作为唯一的可寻址点[8]。此全局的寻址能力让DNA 折纸结构可以作为框架或者钉板,通过订书钉链上特定的功能部分,各种类型的材料可以定点放置在DNA 折纸结构的特定位置上[9]。DNA 折纸术构造图形并不是把一根长链弯曲成所设计图形的轮廓[10],而是采取光栅填充(raster-filling)的方式让整条链来回折叠。也就是说通过DNA 折纸术得到的图形是实心的,而不仅仅是框架而已。
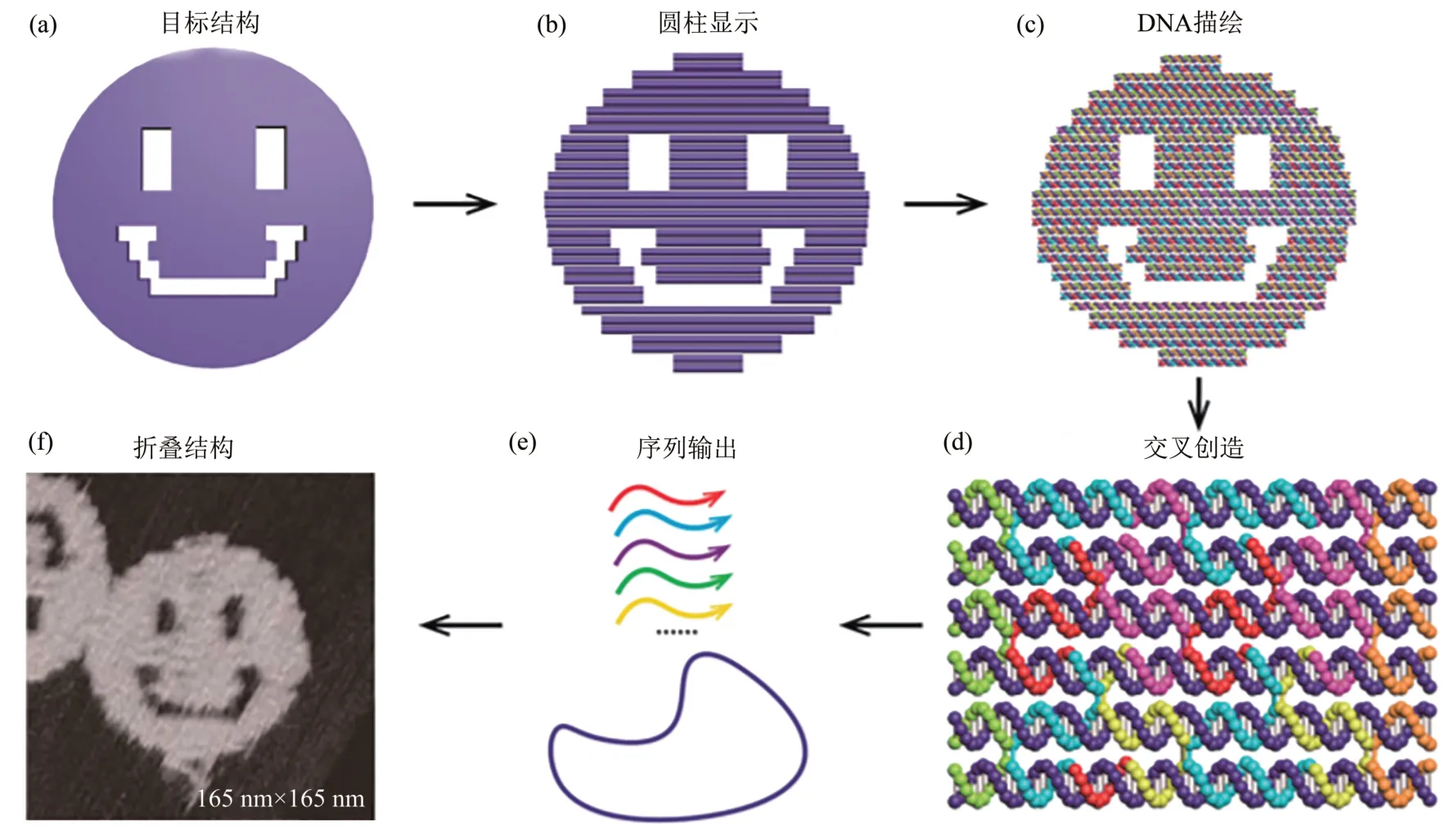
Fig.1 DNA origami design and assembly[11]图1 DNA折纸设计与组装[11]
1.2 DNA折纸的发展
DNA折纸技术代表了DNA纳米技术和分子自组装领域的重大进展。在2006 年Rothemund 首次提出后,基于DNA折纸技术的各种DNA纳米结构被许多研究小组报道,如可扭曲和弯曲的3D DNA折纸结构[12]、盒状DNA 折纸结构[13],还有利用DNA 折纸模板将碳纳米管自组装成二维几何图形[14]。在2010 年Gu等[15]研究发表了DNA 折纸上的步行者(walker),它可以在DNA 折纸轨道上移动,同时在途中收集近端货物分子,这启发了后来的DNA机器和机器人的研究。
DNA 折纸的一个重要特征是其表面优异的可寻址性,功能配体、生物分子和其他多种纳米尺度的物体可以精确地结合在DNA 折纸纳米结构的指定位置上。DNA 折纸技术可以用于构建各种大小和形状的功能纳米结构,但其自身还有局限性,标准的DNA支架长度会限制DNA折纸的大小,不能容纳大组分,为此研究者们开发了多种方法来制造更大更有效的DNA 纳米结构。Rajendran等[16]展示了一种新颖的自组装策略,在2D 空间中使用多个折纸结构,称为2D DNA拼图块,实现在空间中按比例放大折纸结构,该策略可以扩展到创建携带各种功能分子的自组装模块,以供实际应用。2D和3D的DNA折纸结构可以广泛地生产,并且可以保证其形状和尺寸保持一致,研究发现DNA 折纸结构可以应用在等离子体[17]、生物成像[17]、生物工程[18]和生物传感[19]等方面。Douglas等[20]在2012 年研究报告了一种可控的胶囊状DNA 折纸结构,此结构可以装载各种药物,并且药物的释放由结构中的适配体识别目标物所控制,这一进展可以作为DNA 折纸应用于药物递送的巨大飞跃。2014年Geary等[21]在《科学》(Science)杂志上发表了对单链RNA 进行折叠,形成人工构造的RNA 结构。这项研究展示了在生物系统中合成类似DNA折纸术的RNA 纳米结构的潜力。Gerling等[22]在2015 年研究表明,DNA 折纸结构可以通过形状互补而不是碱基配对进行组装,可进一步组装成更高阶的动态可重构结构。此研究为克服DNA 折纸的尺寸限制提供了一种方法。在2016~2018年间,更多基于DNA折纸技术的研究兴起,如DNA折纸结构自上而下的自动设计研制[23]、混合纳米器件中DNA 折纸的精确定位[24]、利用DNA 折纸技术创造超晶格金刚石[25]、DNA-蛋白质混合的纳米级自组装[26]、大型的单链DNA 和RNA 折纸[27]、DNA折纸的大规模生产[28]、利用DNA折纸进行智能肾脏治疗[29]等。Jiang等[30]开发了多臂DNA四面体纳米结构(TDNs),用于近红外荧光和单光子发射计算机断层扫描这两种模式的体内成像。通过实验能够实现荷瘤小鼠的非侵入性肿瘤靶向成像,这展现出未来DNA纳米结构在无创、多模式的体内成像方面拥有具有巨大的潜力。
基于DNA折纸技术已经发展出许多新型DNA纳米结构,如DNA自组装制备的DNA四面体,有研究基于DNA 四面体的微流控系统,提出了检测食源性致病菌的方法,此研究也为新型DNA 纳米结构在生物传感器制备、生物分析等研究领域的应用提供了新思路[31]。近三年,还有研究者开发了一种集成的一站式微流控生物传感器,结合微流控系统和框架核酸的优点,用于病原菌的监测[32]。蛋白质与DNA 纳米结构的有效结合之前是通过在DNA支架上放置几个相互靠近的适配体来实现的。有最新研究表明,几何形状和力学性质对基于DNA 折纸的多价结合位点有显著影响,该方法构建DNA折纸2D纳米空腔,在确定的距离和方向上携带具有已知力学性质的核酸配体来实现DNA 折纸结构与蛋白质得到结合[33]。Wang等[34]研究开发了一类结构明确的肽,可以在一定条件下保护DNA折纸,并研究了肽的结构和序列对DNA折纸稳定性的影响,这种使用肽链来保护DNA 折纸结构的方法在药物传递、生物成像和细胞靶向方面的适用性也得到了证实。对于DNA 折纸的有效保存方面,Xin等[35]研究发现,低浓度的低温保护剂甘油和海藻糖可以降低DNA 折纸的冷冻损伤。尽管2D DNA 折纸纳米结构在至少32 次冻融循环中保持了其结构完整性,但冰晶体的形成使DNA 折纸逐渐对恶劣的样品处理条件更加敏感,低温保护剂甘油和海藻糖可以有效地保护DNA 折纸纳米结构,并且对DNA折纸形状没有任何负面影响。
1.3 DNA折纸设计工具
在所有这些DNA 折纸组装中,研究人员必须注重控制主要寡核苷酸的序列,以便将脚手架链折叠成所需的形状,这就需要对所要合成的DNA 折纸结构进行设计[36]。为了解决这个问题,现在有许多开源软件包可以帮助研究人员开发特定DNA折纸结构所需的链和序列。DNA 折纸设计工具的出现推动了DNA纳米技术领域的发展。
第一代DNA 折纸设计工具caDNAno[37]被开发用于设计各种DNA 折纸结构,尤其是设计晶格状的DNA 折纸脚手架链。因其有着最简单的用户设计界面、半手动改造DNA 螺旋等特点,至今仍是设计DNA 折纸最常用和成熟的软件设备。但由于caDNAno 缺少改变单个碱基的3D 界面,导致3D 结构的设计较为困难,并且不适合设计非平行的螺旋结构,如3D线框图等。Tiamat[38]的出现弥补了部分caDNAno的缺点,Tiamat具有了3D设计界面并且能够单碱基改变,适用于几乎任何形状,如线框、DNA 晶体图案等,但也具有一些不足,如只需简单设计时泛用性不如caDNAno 广,目前只有Windows版本,没有macOS版本可用等。
第二代设计软件中,vHelix[39]针对以往的设计方法难以实现任意多边形结构的问题,创造了自动化设计方法。此软件可以根据用户绘制的多边形网格自动设计出复杂的3D 结构,并且不需要平行DNA螺旋,但它不适合用于简单的1D、2D结构设计,还需要依靠其他3D软件来创建网格进行设计,并且因为相对较新,在实验室的使用广泛度不如caDNAno 和Tiamat。DAEDALUS[23]是一个可以实现完全自动化的软件,不局限于球型拓扑结构,但它没有算法可以预测结构的折叠情况,每个DNA 结构臂必须包含至少两个螺旋,因此比vHelix需要更多的材料。
第三代设计软件ATHENA[40]是一个集成的平台,它包含了所有第二代的线框图DNA 折纸设计软件的功能,因此不管是2D还是3D结构,都可以使用一个软件来进行设计。并且ATHENA 可以与caDNAno 结合使用来实现自定义序列编辑。因为第三代设计软件是新研发,还未能在实验室内广泛测试使用,并且ATHENA与二代中的DAEDALUS同样需要结构臂包含两个螺旋,要耗费更多的材料。
2 运用DNA纳米结构的药物装载
2.1 有机小分子药物装载
DNA折纸结构的设计取决于发挥作用的类型,其稳定性取决于DNA折纸结构本身阳离子的浓度与订书钉链的数量[41],其装载货物的方式则取决于货物的分子种类。如果分子是反义链、CpG、阿霉素和适配体等小分子,则可以通过插入法、包载法、碱基替换法等多种方式与DNA 折纸纳米结构连接[42]。有研究通过将未甲基化的CpG 基序附加到3D DNA 四面体上,开发了功能强大的多价DNA纳米结构,这些小尺寸的功能纳米结构紧凑、机械稳定、无细胞毒性,已经证明了DNA 纳米结构可以抵抗核酸酶的降解,并且在胎牛血清和细胞中保持基本完整,时长可达数小时[43](图2)。
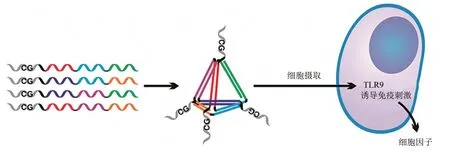
Fig.2 Schematic showing of the assembly of CpG bearing DNA tetrahedron and its immunostimulatory effect[43]图2 含CpG的DNA四面体组装及其免疫刺激作用示意图[43]
近几年,已有多种研究药物与DNA 折纸技术结合用于体内药物运输。其中研究最多的就是阿霉素(doxorubicin,DOX),它是一种蒽环类药物,用于癌症化疗,其机理是阿霉素能够引起细胞中DNA 的损伤和细胞死亡[44]。DNA 纳米结构和DOX 的结合可以通过两种方式实现,一是在G-C碱基中对间插入DOX,二是将DOX 结合到双链DNA 富含A-T 区域的小凹槽中(图3)[45]。Zeng等[46]研究了在不同温度下DOX 结合DNA 纳米结构的效率,他们将DOX和DNA折纸结构的混合物分别在25℃和37℃下孵卵24 h,发现在37℃时,相应折纸状的DOX 负载量效率比25℃高。Chang等[47]构建DNA 二十面体作为DOX 的纳米载体,核酸适配体偶联的DOX嵌入二十面体DNA纳米结构当中,实验显示了其对杀伤上皮癌细胞具有高效性和内化优势。
2.2 大分子药物装载
DNA 纳米结构通过生物素等配体的修饰,可以将链霉亲和素等大分子与其附着[48]。另一种装载蛋白质和配体的方法是将这些直接连接到DNA链上以开发DNA纳米结构[49]。Linko等[50]的研究中,对管状DNA 折纸纳米结构进行处理,使其内表面带有3个生物素结合位点,链霉亲和素修饰的Lucia荧光素酶(lucia luciferase enzymes,LUC)可以负载到DNA折纸结构,进而将LUC运输到细胞当中(图4)。还有研究采用组装后修饰策略,将功能性转铁蛋白-寡核苷酸偶联物(transferrinoligodeoxynucleotide conjugates,Tf-ODN)装载到DNA 矩形折纸结构中[51]。32 条DNA 订书钉链构成了DNA矩形的两列,通过DNA杂交处理可以使多达32个转铁蛋白附着到折纸结构上。Tf-ODN的制备采用DNA模板化的蛋白质偶联技术[52],这是一种位点选择性标记技术,利用蛋白质上的金 属结合位点来指示N-羟基琥珀酰亚胺(N-hydroxysuccinimide)修饰的DNA 链偶联,并且能够确保Tf分子的功能不变。
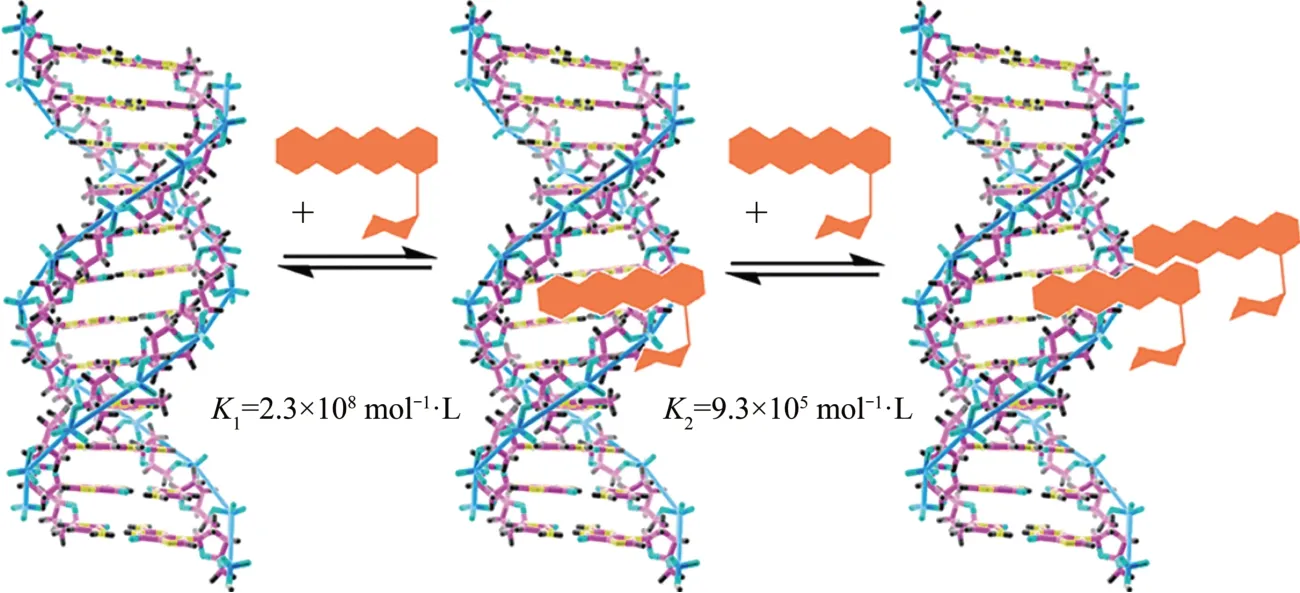
Fig.3 Binding of doxorubicin to DNA[45]图3 阿霉素与DNA的结合示意图[45]
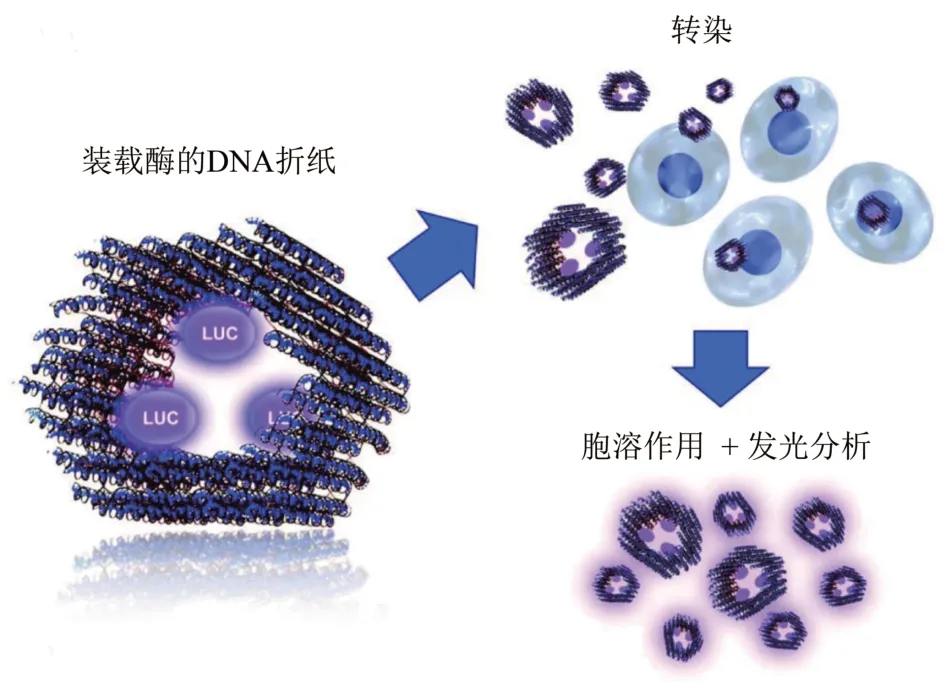
Fig.4 Large molecule drug loading图4 大分子药物装载
2.3 金属纳米颗粒装载
金属纳米颗粒具有缓释和强穿透性等特点,被用于药物治疗领域,可在不改变疗效的基础上大大降低药物的副作用。金属纳米颗粒结合DNA 分为3种基本不同的模式:非特异性的外部结合、沟槽结合,以及DNA 碱基之间的插入[53]。Jiang等[54]开发了一种能够自组装的DNA折纸-金纳米棒复合物(DNA Origami-gold nanorod,DO-GNR),该复合物能够实现双功能纳米诊疗方法。DO-GNR 通过DNA杂交将金纳米棒(gold nanorod,GNR)与DNA折纸相结合,DNA捕获链从三角形DNA折纸结构或管状DNA 折纸结构的一条边延伸出来结合一个GNR,结合位置被设计在DNA折纸结构的顶部平面上,以便于顺应GNR 的形状实现更好的结合。在双光子光源的激发下,DO-GNR 复合物在近红外区有局域表面等离子体共振(localized surface plasmon resonances,LSPR)峰,表现出宽的双光子发光(450~650 nm)。近红外光激发的双光子荧光使DO-GNR 复合体成为双光子成像的理想光学试剂,在早期和非侵入性癌症诊断中具有巨大的潜力。DO-GNR 复合物能够实现双光子细胞成像和光热治疗,表明该复合物有望在体外和体内用于癌症诊断和治疗。
Julin等[55]研究通过DNA 折纸结构引导阳离子AuNPs 高阶排列,并且具有可控和可编程性(图5)。实验人员采用了3种不同尺寸的M13mp18脚手架DNA 折纸:6 螺旋、24 螺旋和60 螺旋,以及合成了3种阳离子AuNPs,它们的尺寸分布都很窄。为了调节AuNPs 和DNA 折纸之间的静电相互作用,实验首先以高离子强度将二者混合在一起,从而有效地屏蔽了带电组分之间的静电相互作用,然后通过透析混合物来对抗逐渐降低的离子强度,创造出微米大小的有序组合。实验人员通过这种组装,在未来可以为构建各种具有独特性能的功能材料开辟新的机会,有望应用于作为药物载体进行纳米金属颗粒的递送。
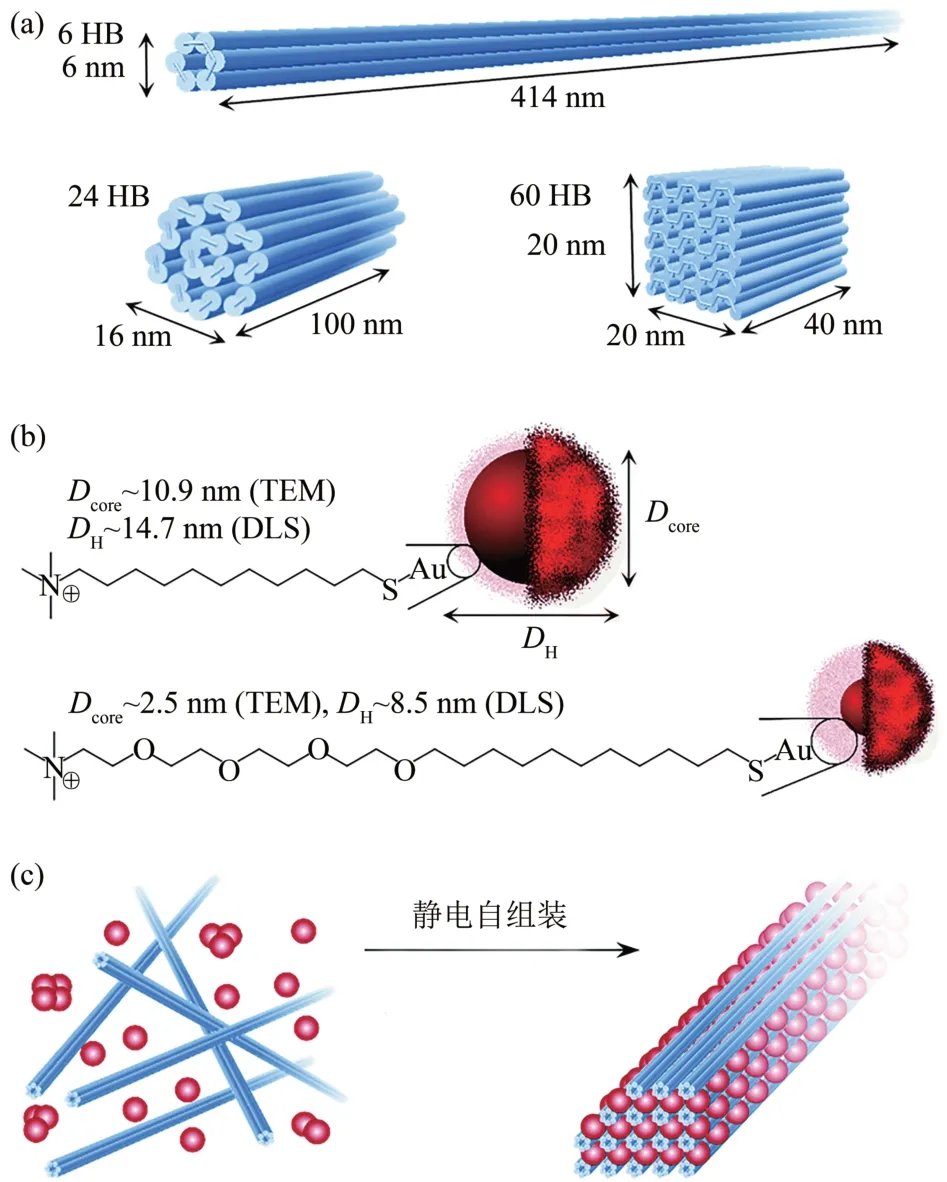
Fig.5 Nano metal loading图5 纳米金属装载
3 运用DNA纳米结构的药物释放
3.1 温度变化控制的药物释放
DNA 分子结构和动力学特性与环境因素密切相关,温度作为影响DNA 结构和特性的首要因素起着非常重要的作用。目前研究当中,大部分装载在DNA 纳米载体中的货物分子由温度的变化触发释放。有研究表明,使用预组装的共价封闭DNA纳米笼(Cagehp)状结构作为载体,在温度控制下可以封装和释放酶。所利用的DNA 纳米笼是一个八面体结构,由8个寡核苷酸组成。其中包含的发夹结构赋予了DNA 纳米笼足够的灵活性,使其能够实现与温度相关的构象转变,以促进辣根过氧化物酶(HRP)在37℃时进入中心腔,在4℃时将HRP 封闭在DNA 纳米笼内。研究通过凝胶电泳分析表明,在4℃时可以保持HRP 在DNA 笼内,在37℃时促进它的释放(图6)[56]。将HRP 包封在DNA 笼内,可以将其转染到昆虫细胞中,这是用裸酶无法实现的。因DNA 折纸固有的不稳定性和低载荷能力限制了其在生物医学领域的应用,有研究将矩形DNA 折纸材料和pH 响应性磷酸钙(Ca3(PO4)2)结合,来实现更好的药物递送[57]。DNA 折纸、金纳米棒和分子靶向药物被共同纳入Ca3(PO4)2纳米颗粒中。Ca3(PO4)2纳米颗粒上涂上一层薄磷脂,可以提供更好的生物相容性。制备的纳米复合材料具有较高的药物负载能力、良好的生物相容性、光热和pH 响应的有效载荷释放特性,并充分保护DNA折纸免于降解。DNA折纸与抗癌药物的组合传递可协同诱导癌细胞凋亡,降低耐药性,提高对人表皮生长因子受体2阳性细胞的靶向杀伤效率。在存在金纳米棒的情况下,DOX 在45℃时的释放速度明显快于在37℃时。这种纳米复合材料有望为各种临床和生物医学应用开辟新的领域。所提到的两种实验都设计出独特的DNA 折纸结构,能够通过控制温度有效地进行药物的装载和释放,但温控药物释放不适合在体内应用,其在疾病治疗上还需进一步地研究。
3.2 pH变化控制的药物释放
由于DNA 的聚电解质性质,所处溶液的酸碱度会影响其构象的稳定性,这种相关性在不同的实验条件下可以观察到,并且pH可引起DNA二级结构的转变。Zeng等[58]在模拟细胞内的3种不同pH值(pH=4.5、6.6 和7.4)情况下,研究了pH 值对DNA 折纸中DOX 释放的影响。发现在pH 为4.5时,DOX 的释放效率较高,这一观察结果表明,DNA 折纸载体释放DOX 是酸性反应过程。Cho等[59]合成了多种独特的能够结合抗癌药物的DNA折纸结构(发夹形、Y 形、X 形),并通过分层(layer-by-layer,LbL)沉积的方法与肽组装形成纳米膜。多聚-L-赖氨酸(PLL)是弱聚电解质,当PLL和DNA折纸组装的纳米膜浸在胎牛血清中时,pH的变化导致带正电荷的PLL和带负电荷的DNA之间的静电相互作用发生变化,纳米膜结构的解体,从而导致与DNA结合的DOX被释放,达到药物释放的效果。Liu等[60]开发了一种可以在溶液pH变化下可逆组装解离的DNA四面体结构,这种环境响应行为将对DNA 折纸纳米结构的潜在应用(如按需药物释放)非常重要(图7a)。能够实现pH控制组装解离的关键因素是DNA折纸结构中含有胞嘧啶(cytosine,C)的DNA三链,其对pH敏感。在酸性溶液中(如pH=5.0),C 被半质子化为C+,可以形成Hoogsteen 氢键(图7d),C+与G-C碱基对相互作用形成C+G-C 三联体(图7b,c);当溶液变成中性(如pH 8.0)时,失去质子的C+变成C,不能与正常的G-C 碱基对形成Hoogsteen 氢键,因此C+G-C三联体分解成一个C和一个G-C碱基对。
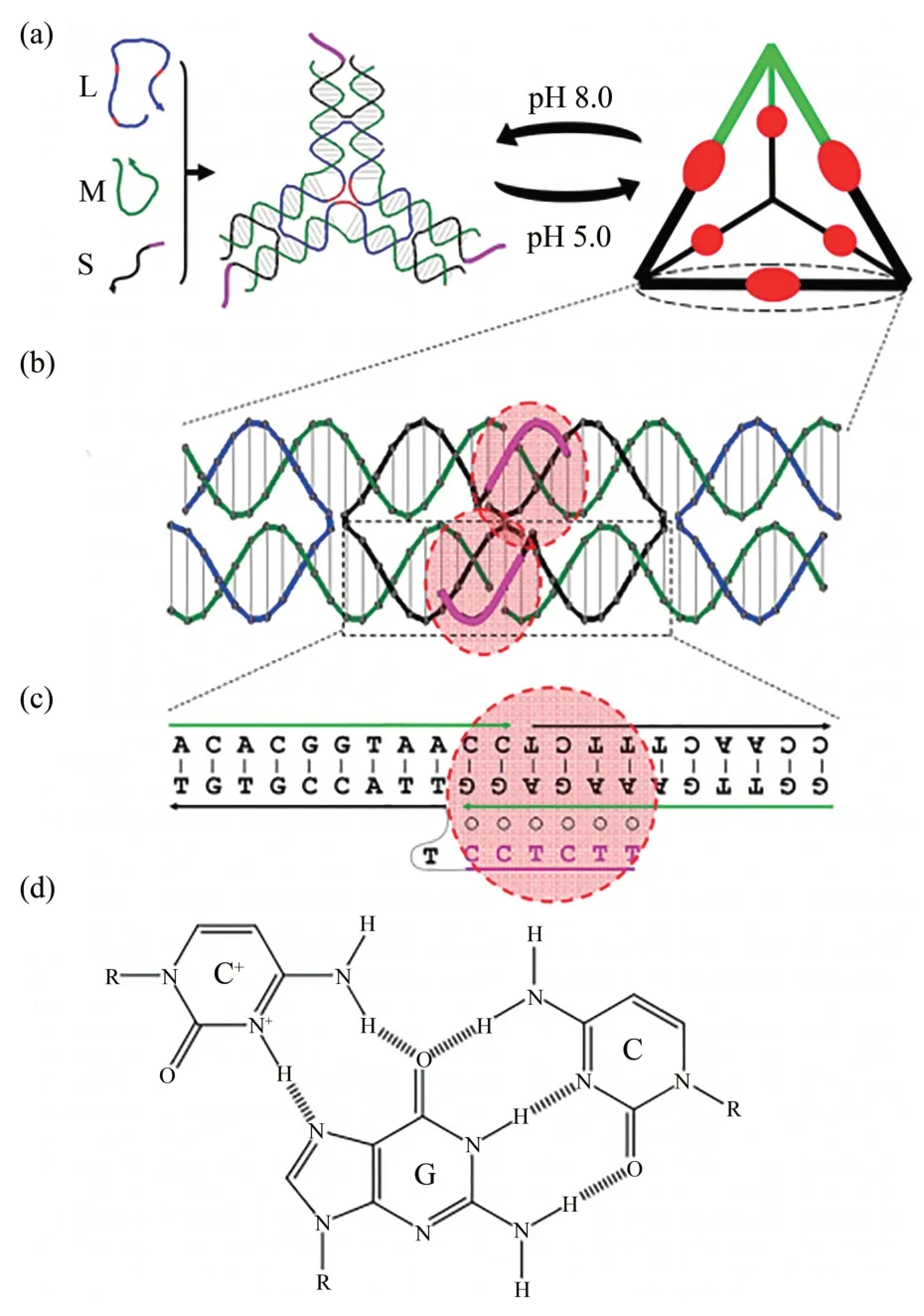
Fig.7 Reversible assembly/dissociation of a DNA tetrahedron in response to solution pH changes[60]图7 响应溶液pH变化的DNA四面体可逆组装/解离[60]
还有研究设计了一种动态DNA折纸纳米胶囊,可以在不同pH 的溶液下打开和关闭,用来装载和展示货物分子[61]。DNA 纳米胶囊是由8 064 个核苷酸(nt)支架折叠而成的一个单一结构,纳米胶囊的外部尺寸约为31×28×33 nm3,使其大致呈球形,它包含一个尺寸为11×12×13 nm3的内腔,纳米胶囊的壁由两层DNA 双螺旋结构组成,以确保维持装载货物所需的刚性和稳定性。实验在胶囊半之间的界面设计了8对pH门闩DNA序列,门闩序列的一部分是DNA 双链,它是由互补的多嘌呤和嘧啶组成的20 bp的发夹基序;另一部分是20 nt多嘧啶DNA 寡核苷酸单链,跟双链DNA 形成平行DNA 三链体。每个锁扣都设计有一个独特的碱基序列,但是T-A·T在三链体结构中的含量相同,以确保所有锁扣将在相同的pH值下打开。对于DNA 折纸是如何释放药物,需要对其技术进行批判性的评估,并且需要注意pH 值对药物本身物理、化学等性质的影响[62]。
3.3 酶控的药物释放
酶作为一类极为重要的生物催化剂,对其底物具有高度特异性和催化效能,有研究通过酶解来促进DNA 纳米结构对装载货物的释放。Ijas等[62]通过合理设计DNA折纸的上层结构和调整DOX的负载浓度,可以使常用治疗药物DOX在DNase I酶切作用下从DNA 折纸纳米结构中释放出来,在DNase I酶切过程中,核酸酶将DNA折纸纳米结构裂解成短的ssDNA片段,当双螺旋DNA结构解体时,结合的DOX被释放(图8)。Sun等[63]等开发了一种由脱氧核糖核酸酶(DNase)、DNA纳米孔结构(NCl)和酸性响应的DNaseI纳米胶囊(NCa)构成的蚕茧状药物递送结构,用于癌症治疗。其中NCl由DNA链组装而成,其能负载DOX,带负电荷的DNase I包裹在带正电荷的酸降解纳米凝胶中,通过静电相互作用结合到NCl中。在酸性条件下,纳米凝胶降解致使DNase I活性被激活,导致NCl降解,促进DOX的释放达到治疗效果。
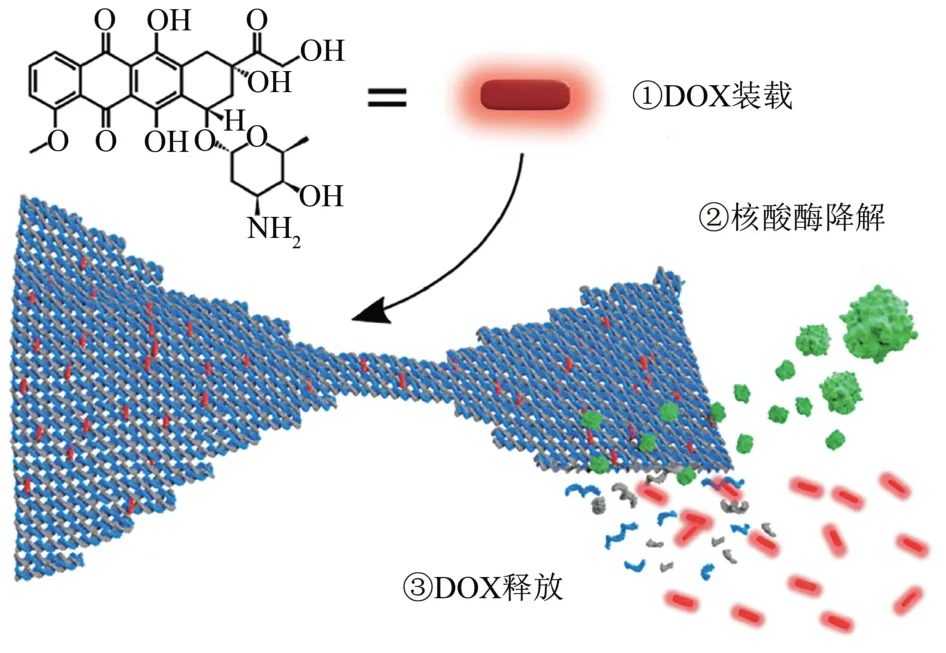
Fig.8 Schematic of the doxorubicin(DOX)loading into a DNA origami nanostructure and subsequent release upon enzymatic degradation[62]图8 阿霉素(DOX)加载到DNA折纸纳米结构和酶降解后释放的示意图[62]
3.4 状态切换控制的药物释放
双股螺旋状态和三股螺旋状态之间的切换能力已经用于不同的DNA 结构打开和关闭,并提供了捕获、封装或释放不同底物的能力[64]。Han等[65]首先证明了这一点,他们设计了一对分子镊子,其中包含一个三重形成区域,可以捕获DNA 目标(图9a)。Del利用钳作为一种手段来调节各种靶向反应性核酸适配体,这些核酸适配体可以检测三磷酸腺苷(ATP)、可卡因或庆大霉素等用于治疗各种细菌感染的抗生素[66](图9b)。在细胞摄取后,DNA 折纸纳米结构通过内吞酶体途径降解,能够有效释放DOX并促进其在细胞核发挥作用[58]。降解的时间和地点与DNA纳米结构的摄取途径有关,这取决于多种因素包括DNA 纳米结构的大小、形状、化学和物理性质,以及摄取DNA 折纸结构的细胞类型[67]。
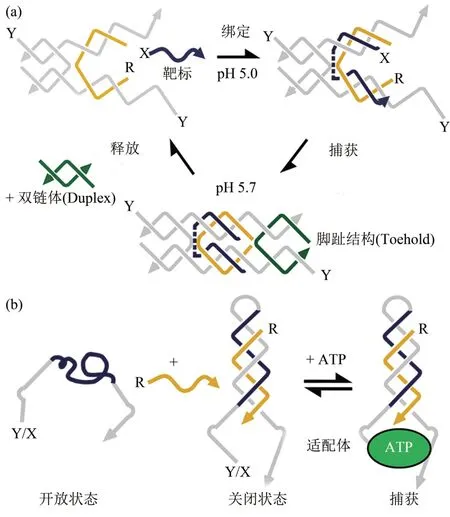
Fig.9 Triplex-based devices capable of capturing and releasing molecules图9 能捕获和释放分子的三重器件
3.5 链置换控制的药物释放
当加入特定的DNA链时,通过与DNA纳米结构上的发夹结构互补,改变支架的孔隙大小,自发释放出装载的纳米粒子[68]。纳米笼的表面孔隙率能够可逆转换的能力将允许控制物质进出纳米笼,Zhang等[69]研发了一种自组装DNA四面体(TET),基于DNA 氢化和链置换可以改变其表面孔隙,进而达成货物的装载和释放。4个三点星基序可以自组装成TET(图10)。因为每面有3 条尾巴(tail),所以TET被命名为带尾TET(tail-TET)。每个TET 面都可以通过碱基配对与包含1个环状长链(CL)和3个短链(CS)的DNA 帽基序(capping motif,CM)结合,形成封盖TET。可以通过添加帽去除链(cap-removal strand,CR)来去除帽。这种非脚趾结构(toehold-free)机制将成为动态DNA纳米结构(如DNA纳米机械设备和生物传感器)的强大工具,对于扩大DNA 折纸纳米笼在药物控制传递、纳米物体封装和刺激响应性货物释放方面的应用具有重要意义。但此链置换方式要应用到临床还面临着诸多问题,如在细胞水平如何实现链置换方式,置换的链要如何达到待释放的DNA 折纸纳米结构附近等。链置换控制的药物释放方案还需进一步研究。
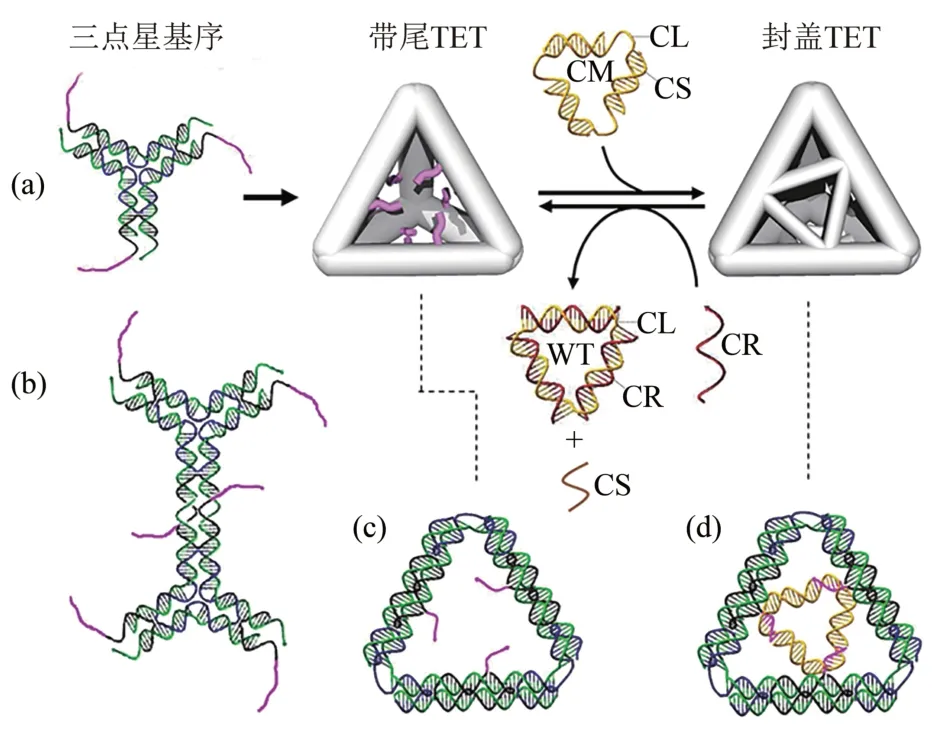
Fig.10 Reversible capping and uncapping of the faces of a DNA tetrahedron(TET)[69]图10 DNA四面体(TET)表面的可逆封盖和非封盖[69]
4 展 望
理想情况下,药物递送载体应该能够携带一种及以上的药物进行协同治疗且穿透细胞膜和屏障,避免有害的化学和酶降解药物,以及不良毒性和免疫原性,并表现出靶向和受控的药物释放。虽然基于DNA 折纸技术的药物递送治疗方案尚未应用于临床,但它们目前正在快速发展,并在癌症治疗中显示出巨大的潜力。其优势在于:靶向配体修饰DNA 折纸纳米结构后可以提高其对癌细胞的靶向能力;单一药物往往不能很好地治疗癌症,DNA折纸结构可以通过合理的设计,开发出纳米多药供给系统以提高疗效;为了实现精确的治疗,研究人员构建了刺激响应纳米系统,可以对诸如光、小活性物质或生物标记物等刺激作出反应,并改变其构象以释放药物。DNA 折纸纳米载体是一种新型纳米载体,与脂质体或无机纳米粒子等某些通用载体相比,具有优越的生物相容性、高靶向性和优良的生物安全性等突出优势,但其体内稳定性有待进一步提高(表1)。

Table 1 Comparison between different drug carrier表1 不同药物载体比较
各种DNA 纳米载体不断出现并通过实验对其在药物递送上的效果进行评估,但要进一步推动DNA 纳米材料在治疗方面的应用,还存在一些关键问题需要解决。进一步研究基于DNA 折纸纳米结构的更具有生物相容性、活体稳定性和实用性的纳米系统在肿瘤治疗中的临床应用仍是当务之急。DNA 纳米材料的体内特性如何,包括其循环半衰期、药代动力学和清除机制,还未阐明[70]。尽管药物可以直接插入到DNA纳米结构中,但DNA纳米结构不能对装载的药物进行定量或定性控制。DNA 纳米结构如若作为药物载体广泛应用,大规模生产是另一个重要挑战。解析DNA 纳米结构组装的动力学和热力学、控制折叠路径、实现高度纯化的结构都是大规模制备DNA 纳米结构作为潜在药物载体的关键[42]。
临床环境下DNA 纳米载体运载药物的下一步研究关键点是跟踪药物在肿瘤内的释放和渗透、影像引导的聚焦治疗,以及监测治疗反应。随着现代纳米医学的发展,人们越来越专注于为单个患者量身定制治疗方案。DNA 纳米结构的研究将从实验室条件下转化至临床环境,并将这些科学进展从实验室引入临床,持续在医疗领域发挥作用。
杂志排行
生物化学与生物物理进展的其它文章
- Similarity of Binding Potentials Between Plant DUF538 and Animal Lipocalin: Cholesterol Binding Ability of DUF538*
- 基于脑电信号的癫痫发作预测特征及识别*
- Comparative Proteomic Study on The Lesional and Non-lesional Epidermis From Vitiligo Patients*
- Different Durations of Simulated Weightlessness Induced Depressive-like Behaviors in Rats*
- 洋山港宏病毒组分析揭示CRISPR-Cas系统病毒靶标序列的特异性*
- BE-dot:为单碱基编辑设计sgRNA及预测脱靶图谱的工具*