土壤中邻苯二甲酸酯的高效液相色谱检测方法
2023-02-24林家宝孙雨豪高彦征
林家宝,孙雨豪,王 建*,高彦征
土壤中邻苯二甲酸酯的高效液相色谱检测方法
林家宝1,2,孙雨豪1,王 建1*,高彦征1
(1.南京农业大学资源与环境科学学院,土壤有机污染控制与修复研究所,江苏 南京 210095;2.江苏省环保集团有限公司,江苏省环境工程技术有限公司,江苏 南京 210019)
为了更加高效、快捷、经济地检测土壤中的邻苯二甲酸酯(PAEs),本文构建并优化了超声萃取-高效液相色谱(UE-HPLC)检测方法.选取美国环保署优先控制的邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二正丁酯、邻苯二甲酸丁基苄基酯、邻苯二甲酸二(2-乙基己基)酯、邻苯二甲酸二正辛酯为实验对象,通过对6种PAEs的最大紫外吸收波长值进行测定、优化高效液相色谱运行条件,进而构建了土壤中6种PAEs的HPLC检测方法,具体参数如下:检测时间为30min;进样量为20μL;分离系统以乙腈-UP水为流动相、初始流速为1.0mL/min,采用梯度洗脱的方式分离PAEs,柱温为40℃;检测系统采用紫外检测器检测、开启波长切换模式,波长分别为205和290nm.采用线性回归方程及相关系数、加标回收率、相对标准偏差和检出限对方法进行评价.结果表明,该方法具有较宽的线性范围,最大质量浓度范围在0.1~100mg/L,相关系数均在0.999以上.1和5mg/kg的6种PAEs加标回收率范围分别为73.03%~91.89%和72.59%~90.70%,相对标准偏差范围分别为1.78%~12.46%和0.30%~7.56%.采用3倍噪音值法、液相色谱仪检定规程所得的6种PAEs检出限浓度范围分别为0.99~19.80和9.49~25.11μg/kg.
高效液相色谱;邻苯二甲酸酯;土壤;检测方法;超声萃取
邻苯二甲酸酯(PAEs),广泛应用于塑料制品的生产和加工环节,也可以作为油漆、化妆品、润滑剂、粘合剂和杀虫剂的添加剂[1-2].据报道,全球PAEs年消耗量大约为600~800万t,此外,全球固体塑料年产量约为3亿t,其中大约50%会被抛弃,由于PAEs与塑料产品是通过非共价键形式结合,其稳定性差,容易从塑料产品中释放并迁移到环境中,造成环境污染[3-6].目前,PAEs在土壤[7]、水体[8]、大气[9]、沉积物[10]和生物体[11-12]等环境介质中广泛存在.
PAEs可以通过塑料薄膜、农药、化肥、污水灌溉、污泥资源化利用、大气沉降等方式进入土壤,造成土壤污染[13].研究发现,我国土壤及农田土壤中PAEs浓度高达1232,157.62mg/kg,其中DEHP和DnBP是主要的PAEs污染物[14].PAEs是一类内分泌干扰物,即使在极低浓度下也存在致癌、致畸、致突变的可能性[15-17].鉴于PAEs对人类健康的潜在危害,美国环保署(US EPA)已将邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二正丁酯(DnBP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸二正辛酯(DnOP)等6种PAEs列为优先污染物,并制定了相应的控制及治理标准;我国也将DMP、DnBP、DnOP等PAEs列入优先污染物控制黑名单[18].
为了人群健康,精准测定土壤中PAEs的种类和浓度水平至关重要.气相色谱(GC)和高效液相色谱(HPLC)由于具有良好的分离能力,被广泛应用于PAEs的检测[19].GC存在对样品纯度要求高、灵敏度偏差大、易受到待测组分干扰等不足,虽然将其与质谱(MS)联用可以更好地进行分离和定性,但GC-MS成本昂贵,许多实验室不具备使用该仪器的条件[20-21].HPLC具有准确度高、精密度高、测定快速、具有大批量测试能力、成本相对低的优点,具有大规模应用的潜力.基于对PAEs污染土壤大批量检测的需求,本文旨在建立一种经济、高效、精确的超声萃取-高效液相色谱(UE-HPLC)检测方法,以期为土壤中PAEs检测提供技术支持.
1 材料与方法
1.1 仪器与设备
LC-20AT HPLC仪器、5μm×4.6mm×250mm Inertsil ODS-P液相色谱柱、万分之一分析天平(岛津,日本);5μm×4.6mm×250mm Venusil MP C18(2)色谱柱(博纳艾杰尔,中国);冷冻干燥机(CHRIST,德国);759S紫外-可见分光光度计(棱光,中国);RV10旋转蒸发仪(艾卡,中国);KQ-500DE超声波清洗仪(超声仪器,中国);TD5A-WS离心机(卢湘仪,中国); NUIII-20T超纯水机(优普,中国).
1.2 材料与试剂
DMP、DEP、DnBP、BBP、DEHP、DnOP标准品(百灵威,中国);无水硫酸钠(南试,中国);300目硅胶(鼎康,中国);丙酮、正己烷、甲醇(国药,中国),乙腈(TEDIA,美国),均为色谱级;实验用水均为超纯水(UP水).
1.3 溶液配制及标准曲线
标准储备液的配制:分别称取6种PAEs标准品,用甲醇溶解并定容到100mL棕色容量瓶中,配置成1000mg/L的标准储备液,置于4℃冰箱中保存.
标准工作溶液的配制:使用甲醇将标准储备液稀释成0.1, 0.2, 0.5, 1, 2, 5, 10, 20, 50, 100mg/L梯度浓度标准工作溶液,分别以PAEs的峰高对浓度进行线性回归分析,得到PAEs的标准工作曲线及线性范围.
1.4 污染土壤的制备
供试土壤:采自南京市秦淮区南京农业大学牌楼实验基地某试验田表层(0~20cm).将采集的土壤样品平铺于牛皮纸上,剔除砾石、动植物残体等杂质,阴凉处风干2周以上.将风干后的土样再次去除杂质,充分打散混匀,并研磨过20目筛.向制备好的土壤样品中添加6种PAEs的丙酮溶液,并充分混匀,待丙酮挥发完全后,老化土壤3个月以上,保存备用.
1.5 样品的前处理方法
样品前处理方法:样品的前处理方法包括提取、净化和浓缩.(1)提取:取2g制备好的土壤样品于20mL玻璃螺口瓶中,添加15mL体积比为1:1的正己烷-丙酮溶液,盖紧瓶盖后置于涡旋振荡仪上涡旋混匀0.5~1min,充分振荡后转移至超声波清洗仪中,在100Hz、常温条件下水浴超声萃取45min,随后将样品放置于离心机中,以2000r/min离心10min,取上清液.(2)净化:将上清液倾倒入已活化(预先采用10mL正己烷分两次淋洗层析柱)的层析柱中,层析柱上层为2g无水硫酸钠,下层为2g硅胶(200~300目),层析柱下方放置100mL旋转蒸发瓶,洗脱之后再分3次添加总体积为15mL的体积比为9:1的正己烷-丙酮溶液,萃取液和洗脱液收集至100mL旋转蒸发瓶.(3)浓缩:在旋转蒸发仪处于40℃、100r/min条件下浓缩至干,移取2mL甲醇润洗定容,随后倒入带有0.22μm有机相滤头(滤头经过甲醇浸泡处理并沥干)的玻璃注射器,过滤进2mL液相小瓶,使用HPLC分析.
秀容月明见过梨友多次了,每次见到,都不敢相信眼前之人就是以暴虐嗜血闻名的屠夫。梨友三十来岁,身材修长,面容清秀,笑的时候,带着几分羞怯,一双手像刚剥了皮的葱,白,嫩,滑。
1.6 质量控制与保证
为了降低实验条件对实验结果的干扰,实验过程中,避免塑料制品的使用,玻璃器皿均在超声波清洗仪中超声1h,随后使用超纯水冲洗3遍,放置于烘箱中烘干24h.实验过程中,每组实验设置3个平行样,同时设置空白组实验,进而保证实验结果的准确性.采用线性回归方程、相关系数、准确度、精密度、检出限评价建立的PAEs检测方法.
1.7 6种PAEs的最大紫外吸收波长值测定
采用759S紫外-可见分光光度计分别对100mg/L的DMP、DEP、DnBP、BBP、DEHP、DnOP标准工作溶液进行紫外波长扫描,确定每种PAE的最大紫外吸收波长值.
1.8 6种PAEs的HPLC检测方法条件优化
采用LC-20AT HPLC仪器对10mg/L的6种PAEs混合标准工作溶液进行分离洗脱,HPLC检测方法条件优化过程包括:色谱柱优选(5μm×4.6mm×250mm Inertsil ODS-P液相色谱柱、5μm×4.6mm×250mm Venusil MP C18(2)色谱柱);流动相类型优选(甲醇/水、乙腈/水);流动相体积比例优化(60/40、75/25、95/5、60/40~95/5、75/25~95/5);检测波长切换等.
1.9 方法评价及程序
采用质量控制中各项指标衡量建立的6种PAEs的HPLC检测分析方法程序的可靠性.采用前处理方法处理两种污染土壤,随后采用已建立的6种PAEs的HPLC检测分析方法对其测定.6种PAEs的HPLC检测分析方法程序:色谱柱为4.6mm× 250mm Inertsil ODS-P液相色谱柱,检测时间为30min;进样系统的进样量为20μL;分离系统以乙腈-UP水为流动相、初始流速为1.0mL/min,采用梯度洗脱的方式分离PAEs,柱温为40℃;检测系统采用紫外检测器检测,开启波长切换模式.
2 结果与讨论
2.1 6种PAEs的最大紫外吸收波长值
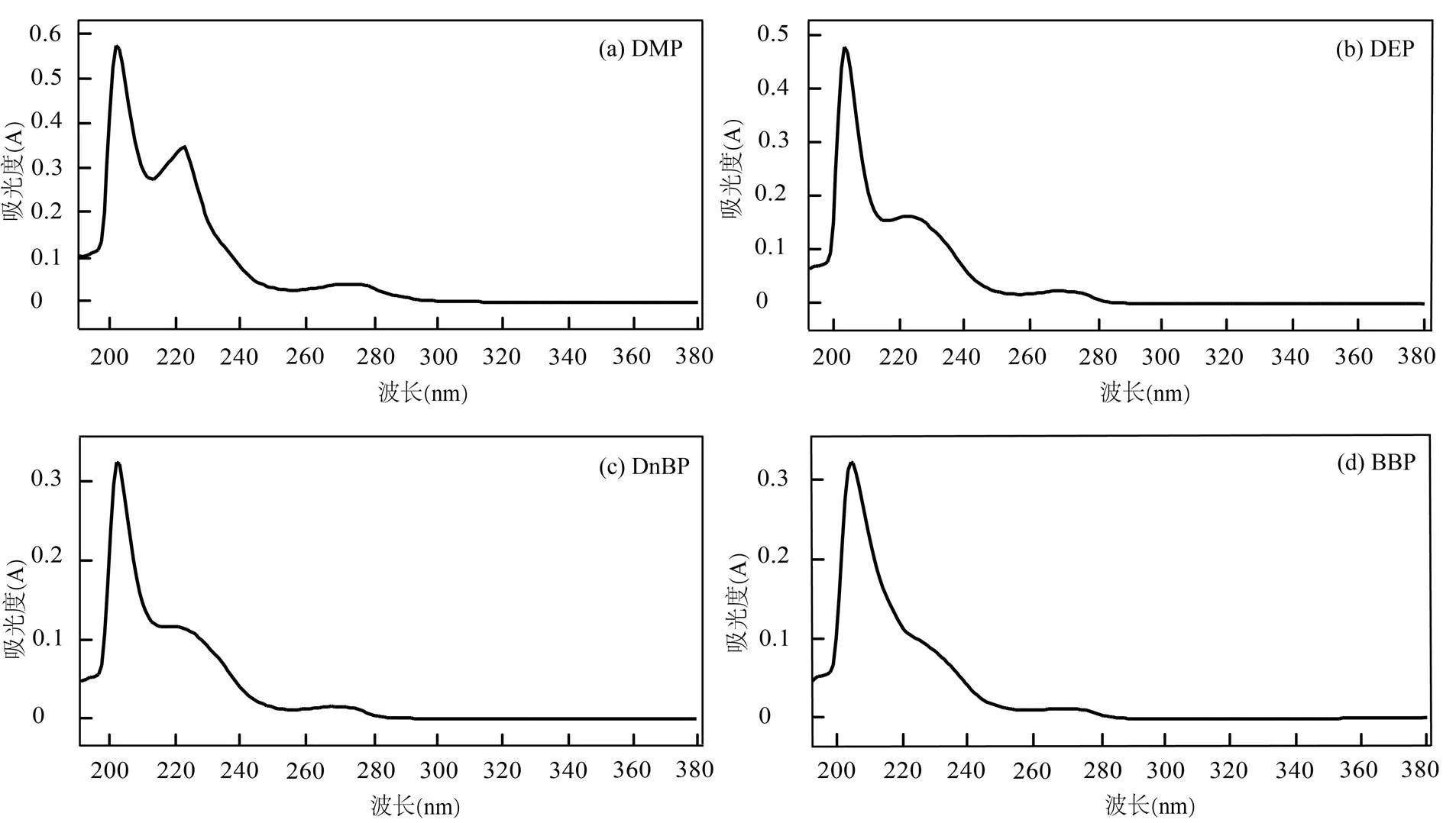
最大紫外吸收波长值的优选是HPLC检测方法定量分析PAEs的重要基础.采用紫外-可见分光光度计分别对100mg/L的DMP、DEP、DnBP、BBP、DEHP、DnOP标准工作溶液进行紫外波长扫描,如图1所示,6种PAEs的最大紫外吸收波长处于200~ 205nm之间;其中,DMP、DEP和DnBP的最大紫外吸收波长值为202nm,BBP、DEHP和DnOP的最大紫外吸收波长值为203nm,如表1所示.由HPLC测定实验得知,紫外波长值较低可能造成基线漂移的问题,因此,从PAEs的最大紫外吸收波长值选择和控制基线漂移的角度考虑,选取205nm作为6种PAEs的HPLC检测方法程序中的最大紫外吸收波长值.

表1 6种PAEs的最大紫外吸收波长(nm)
2.2 6种PAEs的HPLC检测方法条件优化
6种PAEs的HPLC检测方法条件优化包括挑选合适的色谱柱、优选流动相及其比例、确定梯度洗脱的范围、切换检测波长等.
图2为6种PAEs的HPLC检测方法条件优化,当流动相为甲醇-UP水(60/40)时,Venusil MP C18(2)色谱柱可以洗脱出2种PAEs,而Inertsil ODS-P色谱柱可以洗脱出3种PAEs;当流动相为乙腈-UP水(60/40)时,两种色谱柱均可以洗脱出4种PAEs,但Inertsil ODS-P色谱柱分离出的PAEs吸收峰高于Venusil MP C18(2)色谱柱.因此,优选Inertsil ODS-P色谱柱作为6种PAEs的分析色谱柱.
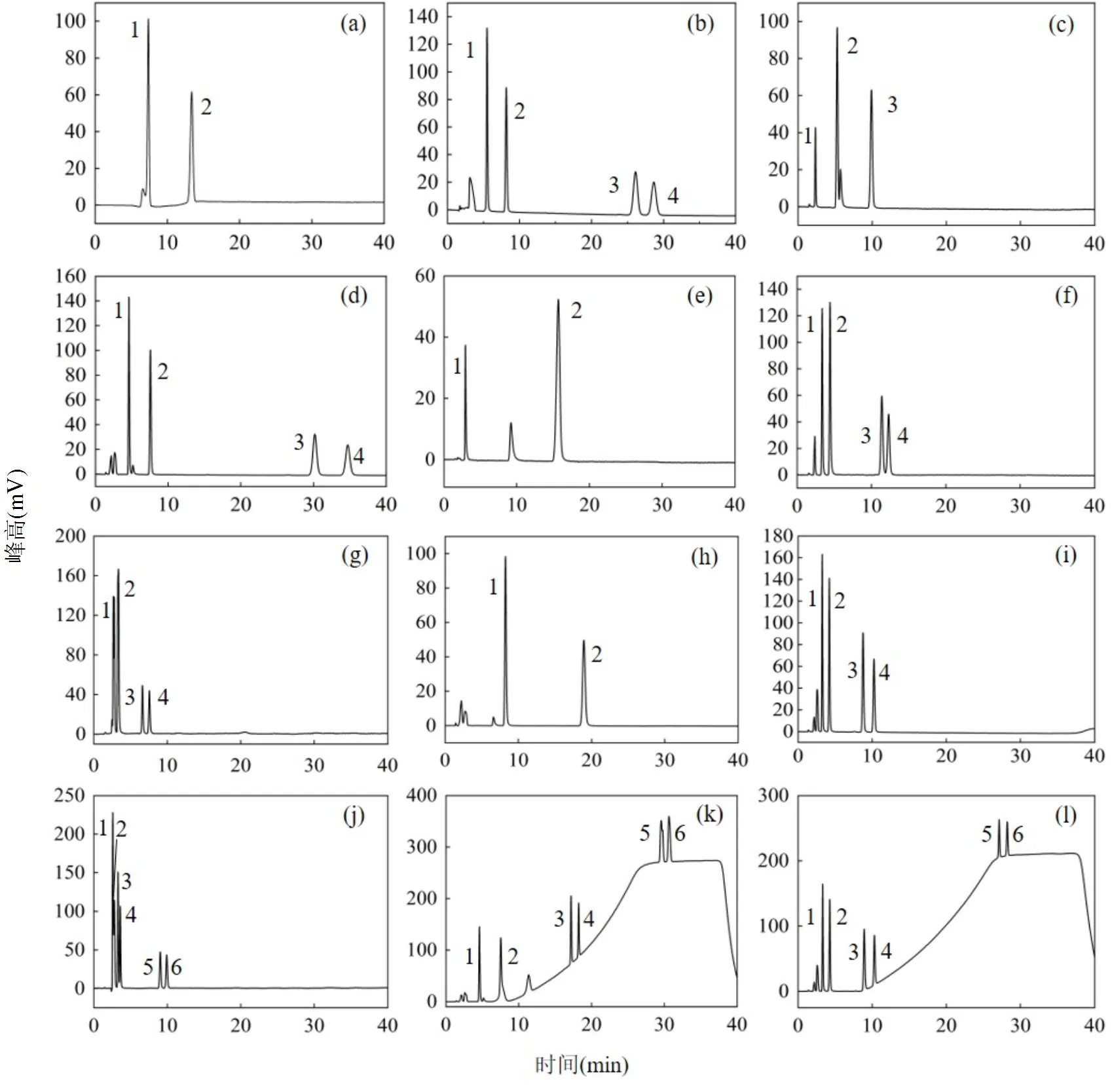
图2 6种PAEs的HPLC检测条件优化
1DMP; 2DEP; 3DnBP; 4BBP; 5DEHP; 6DnOP.色谱柱:(a)、(b)为Venusil MP C18(2),其余均为Inertsil ODS-P.流动相:(a)、(c)、(e)、(f)、(g)为甲醇-UP水,体积比(v/v)分别为:60/40、60/40、45/55、75/25、95/5;(b)、(d)、(h)、(i)、(j)、(k)、(l)为乙腈-UP水,体积比(v/v)分别为:60/40、60/40、45/55、75/25、95/5、60/40~95/5、75/25~95/5
利用HPLC分析PAEs时,流动相中有机相的比例影响着PAEs的洗脱及分离.如图2所示,随着甲醇比例由45%上升至95%,PAEs的洗脱数量由2个上升至4个,但无法完全洗脱出6种PAEs;随着乙腈比例由45%上升至95%,PAEs的洗脱数量由2个上升至6个,但前4种PAEs无法完全分离,仍需要进一步优化方法.通过对比不同浓度的甲醇-UP水和乙腈-UP水对6种PAEs的洗脱情况可以得知,乙腈-UP水可以洗脱6种PAEs,明显优于甲醇-UP水,此外,乙腈-UP水作为流动相时,HPLC具有压力低的优点.因此,优选乙腈-UP水作为6种PAEs的HPLC检测方法的流动相.
利用梯度洗脱的方法可以有效分离6种PAEs.由图2(d)、2(i)和2(j)可以发现,当乙腈比例为60%和75%时,可以有效洗脱并分离前4种PAEs,当乙腈比例为95%时,可以洗脱6种PAEs.因此,采用梯度洗脱的方式可以洗脱并分离6种PAEs,图2(k)和2(l)中乙腈比例分别从60%和75%上升至95%,之后乙腈以95%的比例运行至6种PAEs全部洗脱,由图可知,两种条件下均可以有效分离6种PAEs,但在乙腈初始比例为75%时,6种PAEs都出峰所需时间更短,因此,优选乙腈-UP水初始比例为75/25.

表2 6种PAEs的HPLC/UV检测方法程序
采用梯度洗脱的方式分离6种PAEs有可能造成基线漂移,如图2(k)和2(l),此时,可以通过更改6种PAEs出峰时间段之外区域的紫外吸收波长解决此问题.
优化之后的6种PAEs的HPLC检测方法程序如表2所示,该方法采取梯度洗脱和紫外检测器串联的方式分离检测6种PAEs,检测时间为30min,进样系统的进样量为20μL;分离系统以乙腈-UP水为流动相、初始流速为1.0mL/min,柱温为40℃;检测系统采用紫外检测器检测、开启波长切换模式,波长分别为205和290nm.
采用表2中6种PAEs的HPLC检测方法对10mg/L的6种PAEs进行分离检测.如图3所示, DMP、DEP、DnBP、BBP、DEHP、DnOP的出峰时间分别为3.197, 4.038, 7.638, 8.942, 23.777, 24.865min. 6种PAEs在30min内完全出峰,峰形对称、尖锐,分离效果好,该检测方法具有较好的应用性.

图3 6种PAEs的HPLC图
1DMP; 2DEP; 3DnBP; 4BBP; 5DEHP; 6DnOP
2.3 方法评价
2.3.1 线性回归方程 采用检测方法对浓度范围为0.1~100mg/L的6种PAEs进行测定,以峰高对浓度进行定量分析,得到6种PAEs的线性回归方程,相关系数均大于0.999,如表3所示.
2.3.2 准确度和精密度 为了分析检测方法的准确度及精密度,分别向两份未污染土壤中添加6种PAEs混合标准工作溶液,使得土壤中6种PAEs的理论浓度分别达到1和5mg/kg,测定其加标回收率及相对标准偏差.

表3 6种PAEs的线性回归方程及相关系数
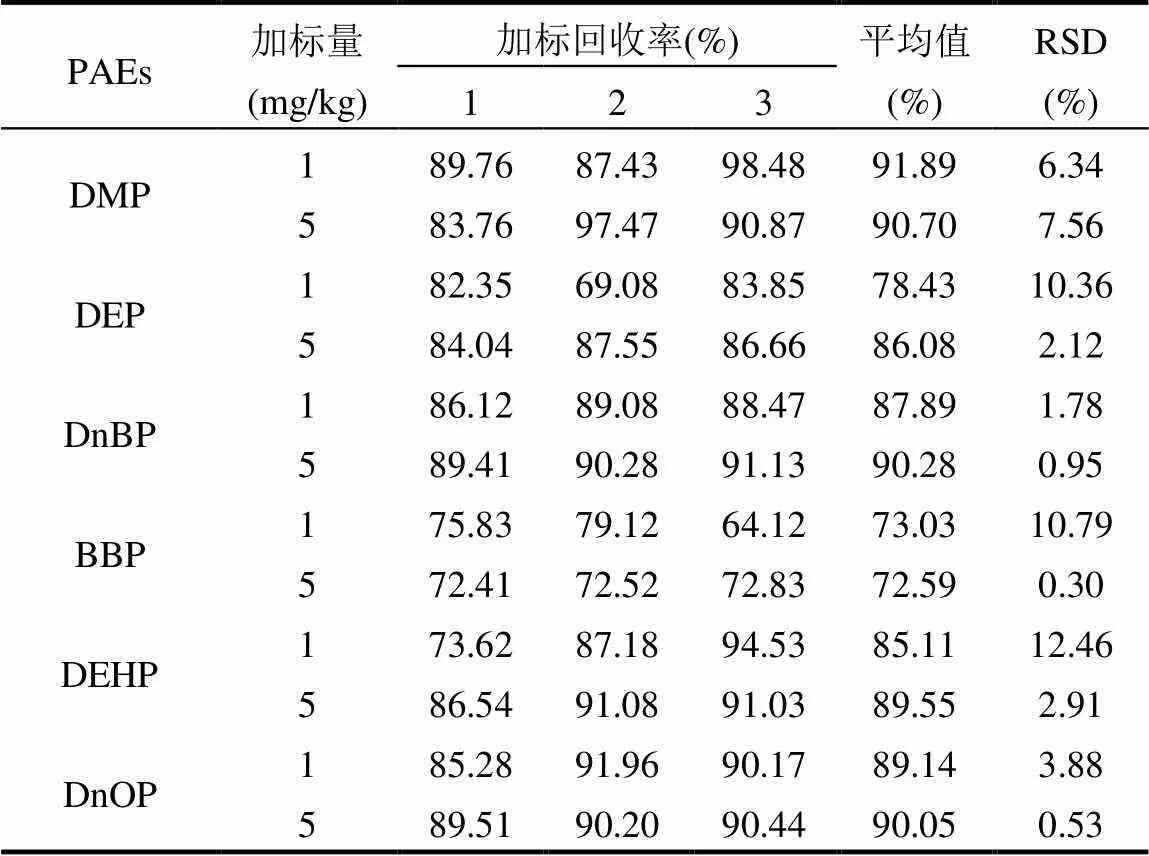
表4 土壤中6种PAEs的加标回收率
如表4所示,1mg/kg的6种PAEs的加标回收率处于73.03%~91.89%,相对标准偏差处于1.78%~ 12.46%;5mg/kg的6种PAEs的加标回收率处于72.59%~90.70%,相对标准偏差处于0.30%~7.56%.由GB/T 39234-2020[22]可知,土壤样品加标回收率范围应处于60%~130%,相对标准偏差应低于15%,本研究6种PAEs加标回收率均满足要求,具有较好的准确度,相对标准偏差均满足要求,具有良好的精密度.
GB/T 39234-2020中1mg/kg红壤样品的DMP和DEP加标回收率为70%和76%,本研究为91.89%和78.43%,加标回收率比其更高.孙文闪等[23]采用改良QuEChERS-GC-MS测定土壤中PAEs含量,6种PAEs加标回收率处于72.5%~92.4%,尽管与本研究相近,但该方法步骤繁琐、检测成本较高.郭文建等[24]采用快速溶剂萃取(ASE)-凝胶净化(GPC)-HPLC测定土壤中6种PAEs含量,其加标回收率处于66.5%~ 102%,其中3种不同浓度DMP的加标回收率均在70%以下,远低于本研究的90.70%~ 91.89%.
2.3.3 检出限 采用3倍噪音值法和液相色谱仪检定规程两种方法对检测方法的检出限进行计算.3倍噪音值法是HPLC仪器中估算检出限常用的方法之一[25-27].即测定信号等于空白溶液测定信号标准偏差3倍时的样品浓度为检出限(LOD)[28].
LOD=(3-)/(1)
式中:代表多次测定的空白响应信号的标准偏差;代表低浓度范围标准曲线的截距;代表低浓度范围标准曲线的斜率.
液相色谱仪检定规程[29]中的检出限公式如下:
LOD=(2××)/(20×)(2)
式中:为基线噪声峰高;为标准溶液浓度;为进样体积,μL;20为标准进样体积,μL;为标准物质峰高.
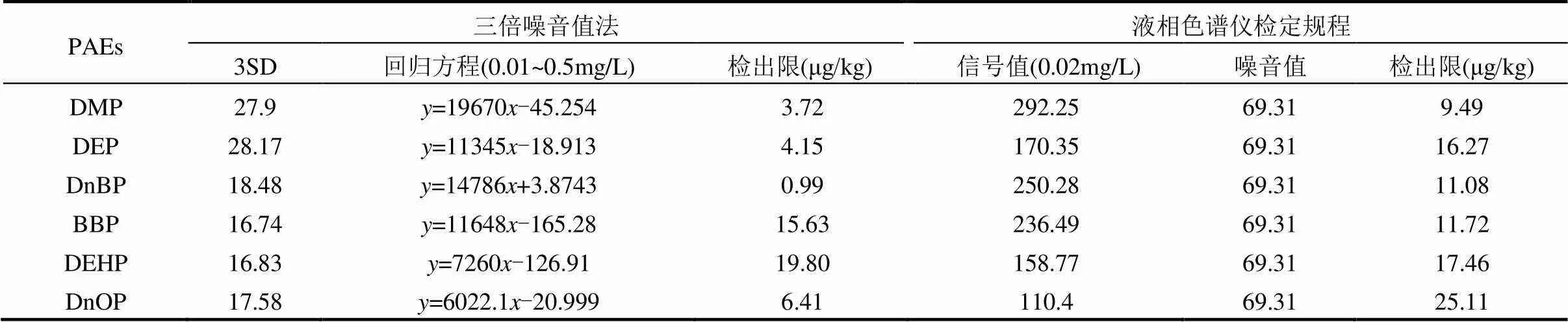
表5 6种PAEs的检出限
如表5所示,由3倍噪音值法和液相色谱仪检定规程计算所得,本方法对6种PAEs的检出限范围分别为:0.99~19.80, 9.49~25.11μg/kg,而GB/T 39234- 2020中6种PAEs的检出限为20~70μg/kg,其检出限明显高于本方法,该方法的建立为检测土壤中较低浓度的PAEs提供技术支持.Laturnus等[30]采用GC-MS测定土壤中PAEs含量,其中DEP、DnBP、DEHP的检出限分别为4.3, 9.3, 43.0μg/kg,均高于本研究中3倍噪音值法所得的检出限,且GC-MS检测价格高于HPLC.王兴磊等[31]采用GC-MS检测土壤中PAEs,该方法对6种PAEs的检出限分别为30, 30, 20, 30, 30, 30μg/kg,明显高于本方法6种PAEs的检出限.综上所述,本方法对土壤中US EPA优先控制6种PAEs的检出限较低、回收率较高、精密度及稳定性较好,同时还具有周期短、操作简便等优势,具备一定的推广应用潜力.
2.4 污染土壤样品的测定
对老化3个月以上的两种PAEs污染土壤进行测定,测定结果如表6所示.土壤样品1中DMP、DEP、DnBP、DEHP、DnOP均超过美国土壤中PAEs的治理标准,土壤样品2中的6种PAEs均超过美国土壤治理标准.

表6 污染土壤中PAEs浓度检测(mg/kg)
3 结论
3.1 本研究建立了检测土壤中US EPA优先控制6种PAEs的超声萃取-高效液相色谱法.该方法具有较宽的线性范围,最大质量浓度范围在0.1~100mg/L之间,相关系数均在0.999以上;1和5mg/kg的6种PAEs加标回收率分别处于73.03%~91.89%和72.59%~90.70%之间,相对标准偏差分别处于1.78%~12.46%和0.30%~7.56%之间;采用三倍噪音值法及液相色谱仪检定规程计算所得的本方法对6种PAEs的检出限浓度范围为0.99~19.80和9.49~ 25.11μg/kg.
3.2 超声萃取-高效液相色谱法具备较好的准确度及精密度,较低的检出限.该方法成本较低,检测周期短,操作简便,可以快速、大批量测定土壤中6种PAEs.
[1] 杨 彦,于云江,李定龙,等.太湖流域(苏南地区)农业活动区人群PAEs健康风险评估 [J]. 中国环境科学, 2013,33(6):1097-1105.
Yang Y, Yu Y J, Li D L, et al. PAEs health risk assessment of agriculture area in Taihu Lake Basin (Southern Jiangsu Province) [J]. China Environmetal Science, 2013,33(6):1097-1105.
[2] Peng X, Feng L, Li X. Pathway of diethyl phthalate photolysis in sea-water determined by gas chromatography-mass spectrometry and compound-specific isotope analysis [J]. Chemosphere, 2013,90(2): 220-226.
[3] Garcia J M, Robertson M L. The future of plastics recycling chemical advances are increasing the proportion of polymer waste that can be recycled [J]. Science, 2017,358(6365):870-872.
[4] 林家宝.多环芳烃、邻苯二甲酸酯污染土壤的化学氧化修复联合地力恢复技术研究[D]. 南京: 南京农业大学, 2022.
Lin J B. Chemical oxidation remediation combined with soil fertility restoration for soils contaminated with polycyclic aromatic hydrocarbons or phthalic acid esters [D]. Nangjing: Nangjing Agricultural University, 2022.
[5] Net S, Sempéré R, Delmont A, et al. Occurrence, fate, behavior and ecotoxicological state of phthalates in different environmental matrices [J]. Environmental Science & Technology, 2015,49(7):4019-4035.
[6] Kong S, Ji Y, Liu L, et al. Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China [J]. Environmental Pollution, 2012,170:161-168.
[7] 张小红,王亚娟,陶 红,等.宁夏土壤中PAEs污染特征及健康风险评价[J]. 中国环境科学, 2020,40(9):3930-3941.
Zhang X H, Wang Y J, Tao H, et al. Study on pollution characteristics and health risk assessment of phthalates in soil of Ningxia [J]. China Environmental Science, 2019,40(7):3378-3387.
[8] 朱冰清,高占啟,胡冠九,等.太湖重点区域水环境中邻苯二甲酸酯的污染水平及生态风险评价[J]. 环境科学, 2018,39(8):3614-3621.
Zhu B Q, Gao Z Q, Hu G J, et al. Contamination levels and ecological risk assessment of phthalate esters(PAEs) in the aquatic environment of key areas of Taihu lake [J]. Environmental Science, 2018,39(8): 3614-3621.
[9] Wang X K, Tao W, Xu Y, et al. Indoor phthalate concentration and exposure in residential and office buildings in Xi'an, China [J]. Atmospheric Environment, 2014,87:146-152.
[10] G Selvaraj K K, Sundaramoorthy G, Ravichandran P K, et al. Phthalate esters in water and sediments of the Kaveri River, India: Environmental levels and ecotoxicological evaluations [J]. Environmental Geochemistry and Health, 2015,37:83-96.
[11] 廖晨曦,刘 炜,张佳玲,等.儿童尿液中PAEs代谢物浓度与居室装饰材料的关联 [J]. 中国环境科学, 2017,37(8):3166-3174.
Liao C X, Liu W, Zhang J L, et al. Associations between urinary concentrations of PAEs metabolites and residential decoration materials [J]. China Environmental Science, 2017,37(8):3166-3174.
[12] Chang W H, Herianto S, Lee C C, et al. The effects of phthalate ester exposure on human health: A review [J]. Science of the Total Environment, 2021,786:147371.
[13] Wang J, Luo Y M, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film [J]. Environmental Pollution, 2013,180: 265-273.
[14] Sun J, Pan L, Tsang D C W, et al. Organic contamination and remediation in the agricultural soils of China: A critical review [J]. Science of the Total Environment, 2018,615:724-740.
[15] Becker K, Seiwert M, Angerer J, et al. DEHP metabolites in urine of children and DEHP in house dust [J]. International Journal of Hygiene and Environmental Health, 2004,207(5):409-417.
[16] Caldwell J C. DEHP: Genotoxicity and potential carcinogenic mechanisms-A review [J]. Mutation Research/Reviews in Mutation Research, 2012,751(2):82-157.
[17] Mariana M, Feiteiro J, Verde I, et al. The effects of phthalates in the cardiovascular and reproductive systems: A review [J]. Environment International, 2016,94:758-776.
[18] 周文敏,傅德黔,孙宗光.中国水中优先控制污染物黑名单的确定[J]. 环境科学研究, 1991,4(6):9-12.
Zhou W M, Fu D Q, Sun Z G. Determination of black list of China's priority pollutants in water [J]. Research of Environmental Sciences, 1991,4(6):9-12.
[19] Guo Z, Wei D, Wang M, et al. Determination of six phthalic acid esters in orange juice packaged by PVC bottle using SPE and HPLC-UV: Application to the migration study [J]. Journal of Chromatographic Science, 2010,48(9):760-765.
[20] 张 悦,袁 骐,蒋 玫,等.邻苯二甲酸酯类毒性及检测方法研究进展[J]. 环境化学, 2019,38(5):1035-1046.
Zhang Y, Yuan Q, Jiang M, et al. Research progress in toxicity and detection methods of phthalic acid esters [J]. Environmental Chemistry, 2019,38(5):1035-1046.
[21] Liang P, Xu J, Li Q. Application of dispersive liquid-liquid microextraction and high-performance liquid chromatography for the determination of three phthalate esters in water samples [J]. Analytica Chimica Acta, 2008,609(1):53-58.
[22] GB/T 39234-2020 土壤中邻苯二甲酸酯测定气相色谱-质谱法[S].
GB/T 39234-2020 Determination of phthalate esters in soil-Gas chromatography-mass spectrometry(GC-MS) [S].
[23] 孙文闪,董叶箐,钟寒辉,等.改良QuEChERS-气相色谱-串联质谱法同时测定土壤中17种邻苯二甲酸酯[J]. 分析科学学报, 2022,38(1): 77-82.
Sun W S, Dong Y Q, Zhong H H, et al. Simultaneous determination of 17phthalic acid esters in soil by gas chromatography-tandem mass spectrometry with improved QuEChERS [J]. Journal of Analytical Science, 2022,38(1):77-82.
[24] 郭文建,张 慧,朱 晨,等.快速溶剂萃取-凝胶净化-高效液相色谱法测定土壤中6种邻苯二甲酸酯[J]. 中国环境监测, 2018,34(3): 134-140.
Guo W J, Zhang H, Zhu C, et al. Determination of phthalate esters in soil samples by high performance liquid chromatography with accelerated solvent extraction and gel permeation chromatograph cleanup [J]. Environmental Monitoring in China, 2018,34(3):134-140.
[25] Zhang H, Chen X, Jiang X. Determination of phthalate esters in water samples by ionic liquid cold-induced aggregation dispersive liquid- liquid microextraction coupled with high-performance liquid chromatography [J]. Analytica Chimica Acta, 2011,689(1):137-142.
[26] Luo X, Zhang F F, Ji S L, et al. Graphene nanoplatelets as a highly efficient solid-phase extraction sorbent for determination of phthalate esters in aqueous solution [J]. Talanta, 2014,120:71-75.
[27] 曾宪远,宁焕焱,尹 艳,等.高效液相色谱串联质谱法测定花生及制品中的五种真菌霉素[J]. 现代食品科技, 2014,30(1):217-221.
Zeng X Y, Ning H Y, Yin Y, et al. Determination of five mycotoxins in peanuts and products by HPLC-MS/MS [J]. Modern Food Science and Technology, 2014,30(1):217-221.
[28] 贾离离,祁志红,彭立军,等.超高效液相色谱仪器检出限计算方法的比较分析[J]. 现代食品科技, 2018,34(2):212-217.
Jia L L, Qi Z H, Peng L J. et al. Comparison analysis of the calculation methods of detection limit for UPLC [J]. Modern Food Science and Technology, 2018,34(2):212-217.
[29] JJG 705-2014 液相色谱仪[S].
JJG 705-2014 Liquid chromatographs [S].
[30] Laturnus F, Gron C. Organic waste products in agriculture-Monitoring the waste constituents phthalate esters in soil-crop system by gas chromatography and ion trap tandem mass spectrometry [J]. Journal of Environmental Engineering and Landscape Management, 2007,15(4): 253-260.
[31] 王兴磊,李 芳,刘云庆,等.快速溶剂萃取/气相色谱-质谱联用法测定土壤中15种邻苯二甲酸酯类增塑剂[J]. 环境化学, 2018,37(5): 1157-1164.
Wang X L, Li F, Liu Y Q, et al. Determination of 15phthalate esters residues in soil by accelerated solvent extraction/gas chromatography- mass spectrometry [J]. Environmental Chemistry, 2018,37(5):1157- 1164.
[32] 蔡全英,莫测辉,李云辉,等.广州、深圳地区蔬菜生产基地土壤中邻苯二甲酸酯(PAEs)研究[J]. 生态学报, 2005,25(2):283-288.
Cai Q Y, Mo C H, Li Y H, et al. The study of PAEs in soils from typical vegetable fields in areas of Guangzhou and Shenzhen, South China [J]. Acta Ecologica Sinica, 2005,25(2):283-288.
Study on the high-performance liquid chromatography detection method of phthalic acid esters in soils.
LIN Jia-bao1,2, SUN Yu-hao1, WANG Jian1*, GAO Yan-zheng1
(1.Institute of Organic Contaminant Control and Soil Remediation, College of Resources and Environment Science, Nanjing Agricultural University, Nanjing 210095, China;2.Jiangsu Environmental Engineering Technology Co., Ltd., Jiangsu Environmental Protection Group Co., Ltd., Nanjing 210019, China)., 2023,43(2):756~763
In order to detect phthalic acid esters (PAEs) in soils more efficiently, quickly and economically, an ultrasonic extraction-high-performance liquid chromatography (UE-HPLC) method was established and optimized. Dimethyl phthalate, diethyl phthalate, di-n-butyl phthalate, butyl benzyl phthalate, bis (2-ethylhexyl) phthalate, di-n-octyl phthalate were selected as experimental subjects, which were under the priority control of US Environmental Protection Agency. By measuring the maximum ultraviolet absorption wavelength of six types of PAEs and optimizing the operating conditions of high-performance liquid chromatography, the high-performance liquid chromatography detection method of six types of PAEs in soils was established. The specific parameters of the method are as follows: the detection time was 30min; the injection volume of the injection system was 20 μL; the separation system used acetonitrile and ultrapure water as mobile phases, and the initial flow rate was 1.0mL/min. PAEs was separated by gradient elution, and the column temperature was 40℃. The detection system used ultraviolet detector to detect, and the wavelength switching mode was switched on, and the wavelength was 205 and 290nm respectively. The method was evaluated by linear regression equation, correlation coefficient, recovery rate, relative standard deviation and detection limit. The results showed that the method had a wide linear range, with the maximum mass concentration ranging from 0.1 to 100mg/L, and the correlation coefficients were above 0.999. The spiked recoveries of 1 and 5mg/kg were 73.03%~91.89% and 72.59%~90.70%, respectively, and the relative standard deviations were 1.78%~12.46% and 0.30%~7.56%. The detection limits of six types of PAEs were calculated by triple signal-to-noise ratio method and verification regulation of liquid chromatographs. The detection limits of PAEs were 0.99~19.80 and 9.49~25.11μg/kg, respectively.
HPLC;phthalic acid esters (PAEs);soil;detection method;ultrasonic extraction (UE)
X830.2
A
1000-6923(2023)02-0756-08
林家宝(1996-),男,安徽阜阳人,南京农业大学硕士研究生,主要研究方向为土壤有机污染控制与修复.
2022-06-29
国家自然科学基金资助项目(42007104,22161132011);江苏省碳达峰碳中和科技创新专项资金资助项目(20220013)
* 责任作者, 讲师, wj308119@njau.edu.cn
