毒死蜱暴露对蚯蚓的亚慢性神经毒性研究
2023-02-24杨易梅周世萍李惠娟李奇生武自强杨广斌朱鑫泽
杨易梅,周世萍*,李惠娟,李奇生,武自强,杨广斌,朱鑫泽
1.西南林业大学,西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明 650224
2.西南林业大学,云南省森林灾害预警与控制重点实验室,云南 昆明 650224
毒死蜱是有机磷类农药的重要品种,由于具有良好的广谱性、无内吸作用,在世界范围内得到了广泛应用.但随着研究的深入,毒死蜱的潜在环境风险越来越被人们重视.近年来,一些国家已采取行动限用或禁用毒死蜱.我国农业农村部也颁布了2032号公告,宣布自2016年12月31日起,禁止毒死蜱在蔬菜上使用[1-2].
目前毒死蜱的使用主要集中在水稻、玉米、小麦以及棉花上,尽管在蔬菜上被禁用,但对其使用总量影响较小[2].研究[3-4]显示,施用的毒死蜱只有不到1%能作用于靶标生物,大部分将进入大气、土壤、水体环境.土壤是毒死蜱在环境中的主要归宿,毒死蜱在土壤环境中的残留必然对以蚯蚓为代表的土壤生物产生潜在威胁,也会对土壤生态系统造成一定的影响.
蚯蚓是土壤环境的重要指示动物,蚯蚓既能反映土壤的污染状况,又能鉴定指示各种有害物质的毒性.利用蚯蚓生物标志物评价污染物对土壤动物的危害,从而对土壤生态系统的风险进行评价,已成为环境研究领域较受关注的研究热点之一[5-8].近年来,关于毒死蜱对蚯蚓毒性的研究已有许多报道.研究表明,毒死蜱为神经毒性杀虫剂,蚯蚓能够吸收并蓄积土壤中的毒死蜱[9],毒死蜱对蚯蚓的神经毒性可以导致蚯蚓死亡,毒死蜱对蚯蚓的LC50值为118.5~148 mg/kg[10-11].Booth等[12]研究表明,按照乐斯本(40 EC,陶氏益农公司)的田间单次推荐施用剂量施用时,土壤毒死蜱的最大浓度相当于4 mg/kg,远低于毒死蜱对蚯蚓的LC50值.虽然毒死蜱对蚯蚓的神经毒性会导致蚯蚓死亡,但由于实际土壤中毒死蜱的持留量一般达不到蚯蚓的致死剂量,因此土壤中持留的毒死蜱对蚯蚓主要表现为低剂量的慢性毒性威胁.目前,虽然毒死蜱对蚯蚓慢性毒性的相关研究较多,但主要针对蚯蚓的生长、生殖等不同功能层次的慢性毒性进行研究[6-7,9,11-13],很少涉及蚯蚓的慢性神经毒性研究,对毒死蜱慢性神经毒性引发的蚯蚓神经行为变化以及相关机制的研究较为鲜见.
研究[14]表明,长期暴露于低剂量的毒死蜱会影响哺乳动物神经系统的正常功能,引发动物的神经行为障碍.动物的神经行为受神经系统支配,是一种综合性的神经高级活动,可以综合反映动物的神经损伤,是动物健康状况评价的重要指标[15].暴露于低剂量的毒死蜱对蚯蚓的慢性神经毒性是否会影响蚯蚓神经系统的正常功能,从而引发蚯蚓的运动、学习记忆等神经行为障碍,以及由此带来的生态影响是目前尚未明确的问题.
因此,该研究拟从毒死蜱暴露引发的蚯蚓脑部神经递质(乙酰胆碱、多巴胺、5-羟色胺、谷氨酸)、离子通道特征酶(Ca2+-Mg2+-ATP酶、Ca2+-ATP酶)变化入手,研究毒死蜱对蚯蚓神经损伤导致的运动、学习记忆等神经行为变化,并运用综合毒性指数(IBR)评价蚯蚓生物标志物变化,探究毒死蜱暴露对蚯蚓的亚慢性神经毒性,以期为毒死蜱污染安全性评价及土壤环境质量评价提供参考.
1 材料与方法
1.1 供试材料
供试农药:毒死蜱标准品(纯度>98%)购自美国Sigma公司.
供试土壤:土壤采自云南红河地区蚯蚓采集地2~15 cm耕作层.在采样地设5个采样点,取样后充分混合,得到试验用土样.土壤类型为红壤,土壤经分析未检出毒死蜱,土壤中有机质含量为17.86 g/kg,阳离子交换量为10.1 cmol/kg,质地为黏壤土,pH为6.55.
供试生物为云南红河地区采集的皮质远盲蚓(Amynthas corticis),试验蚯蚓为体质量为 0.4~0.5 g,具有成熟环带的健康蚯蚓.培养条件:温度控制20 ℃;土壤含水量为田间最大持水量60%.试验前将蚯蚓在供试土壤中适应1周后取出,用纯水冲洗放入铺有湿润灭菌纱布的玻璃皿中,恒温(24 ℃)暗室培养24 h备用.
1.2 毒死蜱亚慢性毒性试验
毒死蜱对蚯蚓的亚慢性毒性试验除了使用人工土壤代替天然土壤外,其余均参照世界经济合作与发展组织(OECD)蚯蚓亚慢性毒性试验方法(OECD 207)进行.试验中土壤毒死蜱暴露浓度根据毒死蜱的实际施用进行设置,按照毒死蜱的田间单次推荐施用剂量施用时,土壤毒死蜱的最大浓度相当于4 mg/kg[11],由于毒死蜱施用次数一般为2~3次,因此将土壤毒死蜱暴露浓度设置为8、12 mg/kg.
根据土壤毒死蜱暴露浓度计算毒死蜱需要量,以丙酮溶解后搅拌混匀于50 g土壤中,待丙酮完全挥发后再与450 g土壤混匀,放入500 mL培养瓶内,加入蒸馏水将土壤含水量调节为土壤田间最大持水量的60%,将备用蚯蚓随机放入对照组和处理组,每瓶放入10条蚯蚓,以预留换气孔的保鲜膜封口.在相对湿度为60%,温度为24 ℃的条件下培养,每隔7 d给予5 g磨碎的干牛粪作为饵料,以丙酮空白为对照组,每个浓度及对照设4个重复.
1.3 毒死蜱亚慢性神经毒性蚯蚓标志物测定
1.3.1 神经行为测试
于毒死蜱亚慢性毒性试验的第28、56天,随机从对照组和处理组中取出蚯蚓,进行蚯蚓记忆行为和运动行为测试.蚯蚓的记忆行为测试前先进行蚯蚓学习训练.蚯蚓学习训练是基于蚯蚓对振动刺激不敏感,厌恶白光刺激的特性,采用白光与振动刺激配对训练,让蚯蚓学习通过加速运动来阻止白光刺激出现的策略.如蚯蚓经过学习训练后到达指定阈值的时间小于训练前到达指定阈值的时间,则表明蚯蚓已领会通过加速运动阻止白光刺激出现的策略.
蚯蚓的学习训练方法参考文献[15].蚯蚓学习训练装置如图1所示.测试台放置于测试盒底部,为模拟蚯蚓在土壤中的移动环境,测试台上铺有带圆形凸起的40 cm×40 cm塑胶垫(圆形凸起高度为0.5 cm,相邻凸起点的距离为3 cm),底部设有振动频率为180 Hz的振动马达.测试台上方安装可以定时控制的喷雾装置(喷雾量 20 mL/h)以及功率均为3 W的红色灯和白炽灯各1个.
蚯蚓学习训练时移动位移阈值设定为9 cm,每个训练周期包括30 s振动、30 s白光、30 s振动、30 s白光、30 s振动、30 s白光.白光刺激训练时,若蚯蚓在30 s内能够移动到指定阈值,则立即关闭白灯至30 s结束后进入振动刺激.每个学习周期结束后蚯蚓休息恢复时间为7 min.当蚯蚓到达指定阈值的时间小于训练前到达时间的次数达3次时,表明蚯蚓已领会通过加速运动阻止白光刺激出现的策略,学习训练结束.学习训练结束24 h后进行蚯蚓的记忆行为测试,测定蚯蚓30 s振动、30 s白光、30 s振动、30 s白光、30 s振动、30 s白光刺激期间蚯蚓到达阈值的时间.蚯蚓的运动行为测试除不需要进行学习训练外,其余条件与记忆行为测试条件一致.
1.3.2 神经递质标志物测定
将完成记忆测试的蚯蚓冲洗后,置于70%乙醇中使其麻醉,在冰盘上解剖,取脑、称量.按照质量与体积比为1∶9的比例加入预冷的生理盐水,匀浆,取匀浆液离心(12 000 r/min)10 min,取上清液,采用荧光分析法测定蚯蚓脑部多巴胺(DA)、5-羟色胺(5-HT)含量[16-17].采用分光光度法测量蚯蚓脑组织中乙酰胆碱(Ach)的含量变化[18],蚯蚓脑组织中谷氨酸(Glu)的含量变化采用高效液相色谱法测定[19].
1.4 数据分析
数据结果用平均值±标准偏差的方式表示.根据蚯蚓神经毒性标志物测定数据计算毒死蜱的综合毒性指数(IBR)[20],采用SPSS 26.0软件进行单因素方差分析和多因素比较分析,数据分析采用SPSS 26.0和OriginPro 8.0软件进行.综合毒性指数(IBR)的计算参考文献[21].
2 结果与讨论
2.1 毒死蜱对蚯蚓的学习记忆及运动损伤
移动位移阈值是蚯蚓应激状态下能够达到的移动阈值[16],本研究中该阈值设定为9 cm.毒死蜱暴露对蚯蚓到达移动位移阈值的时间影响如图2所示.由图2可见,暴露期内对照组和毒死蜱处理组的蚯蚓经过学习训练后到达阈值的时间均显著低于训练前(P均小于0.05),表明训练后的蚯蚓已领会通过加速移动阻止白光刺激出现的策略.训练结束24 h后,对照组中蚯蚓到达移动位移阈值的时间与训练结束时并无显著差异,表明对照组中蚯蚓仍存在加速运动可阻止白光刺激出现的记忆,测试时通过加速移动避免了白光刺激的出现,因此蚯蚓到达移动位移阈值的时间与学习训练结束时蚯蚓到达移动位移阈值时间相似;而毒死蜱处理组中蚯蚓到达移动位移阈值的时间较训练结束时显著增加(P均小于0.05),但与蚯蚓学习训练前无显著差异,表明毒死蜱暴露导致蚯蚓出现了记忆障碍,丧失了加速移动可阻止白光刺激出现的学习记忆,测试时不能通过加速移动来避免白光刺激出现.
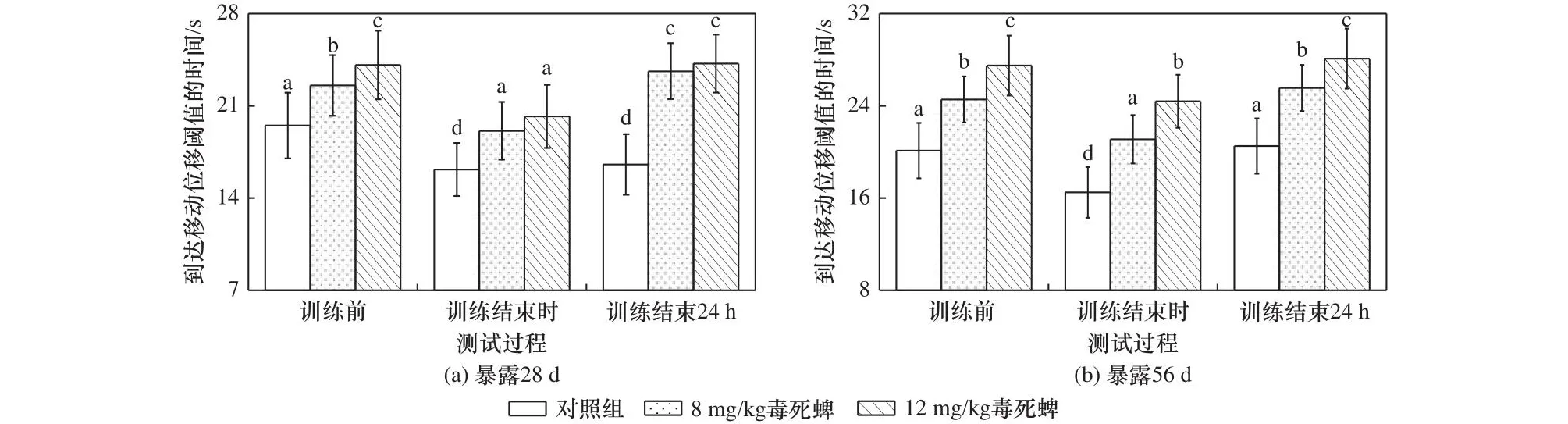
图2 毒死蜱暴露对蚯蚓到达移动位移阈值时间的影响Fig.2 Effect of chlorpyrifos exposure on the threshold time of earthworm reaching displacement
虽然蚯蚓的脑容量较小,但试验发现蚯蚓通过训练可以获得学习记忆,这与以往蚯蚓的学习记忆研究结果[22-24]一致.Yerkes[23]首次通过试验证实了蚯蚓(Allolobophora foetida)的学习记忆能力,随后的研究也表明陆正蚓(Lumbricus terrestris)和赤子爱胜蚯蚓(Eisenia foetida)等不同种属的蚯蚓均具备一定的学习记忆能力[22,24].笔者研究对照组中蚯蚓通过训练获得了加速移动可以阻止白光刺激出现的学习记忆,测试时可以借助记忆产生适应性变化,通过加速移动避免白光刺激出现;而毒死蜱处理组中的蚯蚓由于记忆丧失,测试时难以通过加速移动来避免白光刺激出现,导致蚯蚓到达阈值时间较训练结束时到达阈值的时间显著增加(P<0.05).
暴露于毒死蜱不仅影响了蚯蚓的学习记忆,还对蚯蚓的运动造成了不利影响.由图2可见,毒死蜱处理组中无论是学习训练前、训练结束时或训练结束24 h,蚯蚓到达移动位移阈值的时间均显著高于对照组(P均小于0.05),表明毒死蜱处理组中蚯蚓移动速率较对照组下降,移动缓慢,毒死蜱暴露损伤了蚯蚓的运动能力.
记忆行为与运动行为均受神经系统支配,其行为变化可以综合反映动物的神经损伤[25].毒死蜱暴露条件下,蚯蚓能够吸收并蓄积土壤中的毒死蜱,在毒死蜱浓度为12 mg/kg的土壤暴露56 d时,蚯蚓体内毒死蜱浓度为3.73 mg/kg[9],蓄积在蚯蚓体内的毒死蜱会诱发蚯蚓的神经损伤.笔者研究中毒死蜱暴露引发的蚯蚓记忆丧失和运动迟缓均表明蚯蚓的神经受到了损伤,这种损伤导致了蚯蚓的记忆障碍和运动损伤.蚯蚓因记忆障碍不能对获取信息进行提取,难以借助生活经验发生适应性变化.此外,毒死蜱暴露引发的蚯蚓运动损伤会导致蚯蚓运动迟缓,难以快速找到食物、躲避天敌,活动范围变小,不利于蚯蚓占据更丰富的资源和更适合的生存空间.以上行为变化将严重影响蚯蚓的生存质量,由于蚯蚓在土壤生态系统中的重要作用,蚯蚓种群质量的下降将加剧土壤生态系统风险[6].
2.2 毒死蜱对蚯蚓神经递质变化影响
毒死蜱暴露对蚯蚓神经递质变化的影响如图3所示.由图3可见,暴露期内所有处理组中蚯蚓脑部谷氨酸(Glu)含量均显著低于对照组(P均小于0.05),且12 mg/kg毒死蜱处理组中蚯蚓脑部Glu含量均显著低于8 mg/kg处理组(P均小于0.05).相同暴露浓度处理组中暴露56 d的蚯蚓脑部Glu含量均显著低于暴露28 d的Glu含量(P均小于0.05),表明毒死蜱暴露引发了蚯蚓脑部Glu含量的下降,毒死蜱暴露浓度越大,对蚯蚓脑部Glu含量的抑制越显著,随着暴露时间的增加,毒死蜱对蚯蚓脑部Glu含量的抑制加重.
Glu是一种具有神经递质功能的氨基酸,长期研究[25]表明,Glu是生物神经系统中内源性氨基酸含量最丰富的一种,其可作为兴奋性神经递质发挥作用,在生物的学习和记忆功能中起着重要的作用.Fisher等[26]在研究神经发育障碍时发现,学习记忆功能的衰退与谷氨酸的变化有密切关联.Crupi等[27]研究表明,学习记忆功能的衰退和大脑皮层兴奋性的降低均与Glu含量失调有关,Glu含量的降低会导致生物学习记忆能力下降与视觉障碍.笔者研究中毒死蜱暴露对蚯蚓脑部Glu含量的抑制是导致蚯蚓记忆障碍的因素之一.
暴露28 d时,所有毒死蜱处理组中蚯蚓脑部的5-HT、DA含量均显著低于对照组(P均小于0.05),但12 mg/kg毒死蜱处理组中这两种神经递质的含量与8 mg/kg毒死蜱处理组中并无显著差异.随着暴露时间的增加,这两种神经递质含量均持续降低,暴露56 d时毒死蜱不同暴露浓度处理组中蚯蚓脑部DA含量差异显著(P均小于0.05),但不同处理组中蚯蚓脑部的5-HT含量无显著差异〔见图3〕.

图3 毒死蜱对蚯蚓神经递质的影响Fig.3 Effects of chlorpyrifos on neurotransmitters in earthworms
5-HT、DA均为单胺类神经递质,5-HT在学习记忆过程中以兴奋作用为主,可触发学习记忆能力的易化作用[28],DA与记忆的关系初步推测是通过调节精神活动、情绪、识别、思维和推理过程间接影响记忆能力[29].大脑中5-HT、DA等单胺类神经递质含量减少会导致神经元的缺失、细胞死亡和退化变质,进而引起学习记忆等认知功能障碍[30].此外,DA除了参与学习记忆等神经行为外,还与肌肉协调能力联系密切,DA含量下降会导致运动能力受损[29].笔者研究中毒死蜱暴露引发的蚯蚓脑部5-HT、DA分泌抑制,不仅导致蚯蚓的学习记忆障碍,还导致蚯蚓的运动能力受损、移动缓慢,毒死蜱处理组中无论是学习训练前、训练结束时或训练结束24 h的蚯蚓,其到达移动位移阈值的时间均显著高于对照组.
乙酰胆碱(Ach)是中枢胆碱能神经系统的一种重要递质,由神经末梢胞浆中的胆碱和乙酰辅酶A在胆碱转移酶作用下生成并进入囊泡贮存.当接受外界刺激时,在Ca2+的参与下突触小泡与突触前膜融合被释放至突触间隙后再与突触后膜的Ach受体作用,从而介导信息的传递,参与学习记忆功能的完成.由图3可见,暴露期内毒死蜱处理组中蚯蚓脑部的Ach含量均显著高于对照组(P均小于0.05),且随着暴露时间的增加,毒死蜱处理组中蚯蚓脑部Ach含量持续升高,表明毒死蜱暴露导致蚯蚓脑部Ach含量的异常升高.
毒死蜱作为有机磷农药,由于其分子中具有亲电子性磷原子和带有正电荷的部分,其正电荷部分与胆碱酯酶氨基酸的侧链结合,亲电子性磷原子与活性中心酯解部分(丝氨酸残基的羧基)结合,Ach分子中的羰基碳与乙酰胆碱酯酶酯解部位的丝氨酸中的羟基以共价键结合生成磷酰化胆碱酯酶,使乙酰胆碱酯酶发生乙酰化作用,造成Ach的大量积累,导致蚯蚓脑部Ach含量的异常升高.
Ach积累会引起突触传递受阻,引起突触传递受阻,无法及时在神经元间进行信号传递,出现学习记忆等行为障碍.如果Ach积累严重,神经冲动传导的过度刺激将使神经纤维长期处于兴奋状态,引发一系列的神经系统中毒导致生理失调甚至死亡[31].笔者研究中由于毒死蜱的暴露剂量较小,试验中并未出现蚯蚓中毒死亡现象,但暴露组中蚯蚓出现了记忆障碍、运动迟缓等神经行为变化,结合毒死蜱暴露诱发蚯蚓神经递质的异常变化推测毒死蜱对蚯蚓的神经损伤主要是由于Ach、DA等神经递质的异常变化所致.
2.3 毒死蜱对蚯蚓神经离子通道特征酶活性影响
毒死蜱对蚯蚓神经离子通道特征酶活性影响如图4所示.由图4可见,暴露期内毒死蜱处理组中蚯蚓脑部的Ca2+-ATP酶、Ca2+-Mg2+-ATP酶活性与对照组均无显著差异,表明毒死蜱暴露对蚯蚓的神经离子通道特征酶(Ca2+-ATP酶、Ca2+-Mg2+-ATP酶)的活性并无显著影响.

图4 毒死蜱对蚯蚓神经离子通道特征酶活性的影响Fig.4 Effect of chlorpyrifos on the activity of characteristic enzymes of neural ion channels in earthworms
钙离子在神经系统中起十分重要的作用,它可影响轴突运输、神经递质释放及神经质膜的稳定性.研究[32]显示,Ca2+在学习记忆功能的突触模型—海马长时程增强(LTP)的诱导和维持中起重要作用,动物学习记忆的下降与海马突触内Ca2+超载有关.正常情况下,神经膜内外Ca2+分布是不同的,呈膜外高于膜内的特征.而Ca2+在膜内外的调节主要依靠Ca2+-ATP酶、Ca2+-Mg2+-ATP酶完成[33].
Ca2+-ATP酶可以催化质膜内侧的ATP水解,释放出能量驱动细胞内的Ca2+泵出细胞或泵入内质网腔中储存,以维持细胞内低浓度的游离Ca2+.由于其活性依赖于ATP与Mg2+的结合,所以与Ca2+-Mg2+-ATP酶一起构成了钙泵,是维持神经细胞内低Ca2+稳态的重要基础.研究[34]表明,Ca2+-ATP酶可以水解ATP,使细胞内Ca2+泵到细胞外,以维持细胞内相对较低的Ca2+浓度,Ca2+-Mg2+-ATP酶、Ca2+-ATP酶活性的下降,可能会导致神经膜内外Ca2+分布的异常,出现胞内钙超载,从而导致记忆障碍.笔者研究中毒死蜱暴露对蚯蚓Ca2+-Mg2+-ATP酶、Ca2+-ATP酶的活性均无抑制作用,表明Ca2+-Mg2+-ATP酶、Ca2+-ATP酶活性抑制引发的胞内钙超载并不是毒死蜱暴露诱发的蚯蚓记忆障碍存在的可能机制.
2.4 毒死蜱对蚯蚓的亚慢性神经毒性IBR分析
用Ach、Glu、DA等6种神经毒性生物指示物含量、酶活性及记忆行为的变化率做雷达图(见图5),比较不同暴露浓度的毒死蜱对蚯蚓各指示物的影响程度.由图5可见,蚯蚓Ach、Glu等神经递质含量对毒死蜱的响应较显著,而神经离子通道特征酶—Ca2+-ATP酶、Ca2+-Mg2+-ATP酶活性对毒死蜱无响应作用.

图5 毒死蜱对蚯蚓神经毒性标志物的影响Fig.5 Effects of chlorpyrifos on neurotoxic markers of earthworms
运用蚯蚓神经毒性标志物的综合毒性指数(IBR)来评价蚯蚓生物标志物变化,评估毒死蜱对蚯蚓的亚慢性神经毒性.由图6可见:暴露28 d时,8、12 mg/kg毒死蜱对蚯蚓的亚慢性神经毒性IBR值分别为3.227 5、4.524 6;暴露56 d时,IBR值分别为3.884 8、5.899 5.结果表明,12 mg/kg毒死蜱对蚯蚓的亚慢性神经毒性大于8 mg/kg毒死蜱,随着暴露时间的增加,不同暴露浓度的毒死蜱对蚯蚓的亚慢性神经毒性增强.毒死蜱对蚯蚓的亚慢性神经毒性会导致蚯蚓的神经损伤,但这种神经损伤是否会随着暴露消除而修复,还有待进一步研究.

图6 毒死蜱对蚯蚓亚慢性神经毒性综合毒性指数的影响Fig.6 Subchronic neurotoxicity IBR values of chlorpyrifos to earthworms
3 结论
a) 毒死蜱对蚯蚓的神经损伤导致了蚯蚓的运动迟缓和学习记忆障碍.暴露28~56 d内 ,毒死蜱处理组中蚯蚓脑部的Ach含量均显著高于对照组(P<0.05),而蚯蚓脑部DA、5-HT、Glu含量均显著低于对照组(P均小于0.05).随着暴露时间的增加,毒死蜱对这4种神经递质含量的影响加重,毒死蜱暴露诱发的蚯蚓神经递质异常是蚯蚓运动迟缓、学习记忆障碍神经行为变化的可能机制之一.
b) 暴露 28 d时,8、12 mg/kg毒死蜱对蚯蚓的IBR值分别为3.227 5、4.524 6,暴露56 d时的IBR值分别为3.884 8、5.899 5,毒死蜱对蚯蚓的亚慢性神经毒性随着毒死蜱的暴露浓度、暴露时间增加而增强.
