丹参多酚酸盐对大鼠离体心脏心肌缺血再灌注损伤的保护作用及其机制
2023-02-22王永贤贾敏高景峰霍涛许立刚
王永贤,贾敏,高景峰,霍涛,许立刚
丹参始载于《神农本草经》,主要作用是活血化瘀,临床广泛用于心、脑血管疾病的治疗,丹参及其组分具有扩张冠状动脉、增加冠状动脉血流量、清除自由基等作用。目前丹参的活性成分丹参多酚酸盐已用于冠心病、心绞痛、心肌梗死及其他心血管疾病的治疗[1-2]。研究证明,丹参及其活性成分具有调节机体钙平衡、清除自由基、保护线粒体以及抗氧化等生理活性[3-4]。研究表明,丹参对心肌缺血再灌注损伤及在体心脏有一定的保护作用[5],但作用机制尚未明了。心肌细胞能量代谢障碍是缺血再灌注损伤发生的主要机制之一,己糖激酶Ⅱ(hexokinases Ⅱ,HKⅡ)是调节机体糖酵解的关键酶,早期研究认为,HKⅡ是癌细胞增殖的潜在治疗靶点[6],而近期研究发现,HKⅡ在心肌缺血再灌注损伤中同样扮演着重要角色,在低流量缺血或缺氧时,葡萄糖代谢为三磷酸腺苷(adenosine triphosphate,ATP),此时HKⅡ是调节该步骤的关键酶[7]。发生心肌缺血再灌注损伤后,胞质和线粒体中HKⅡ含量升高,该现象由Akt激活引起,其可促进机体生成ATP,恢复缺血再灌注区能量代谢。此外,HKⅡ还可以结合于线粒体外膜,参与调节压敏电阻器阴离子通道(voltage-dependent anion channel,VDAC),影响线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP),抑制心肌细胞凋亡[8-9]。有研究表明,丹参多酚酸盐可以抑制线粒体能量损伤[10],但其机制尚不明确,因此本研究基于HKⅡ探讨丹参多酚酸盐对大鼠离体心脏心肌缺血再灌注损伤的保护作用,现报道如下。
1 材料与方法
1.1 实验时间 本实验时间为2021年2—8月。
1.2 实验材料
1.2.1 实验动物 选取50只SD雄性大鼠,平均体质量为(180±20)g,大鼠购自河北医科大学实验动物中心,SPF级环境下适应性饲养7 d后用于后期实验。
1.2.2 药品与试剂 丹参多酚酸盐(上海绿谷制药有限公司),3-bromopyruvate(HKⅡ抑制剂,美国Sigma公司),细胞色素C检测试剂盒(江苏碧云天生物技术有限公司),ATP、二磷酸腺苷(adenosine diphosphate,ADP)、单磷酸腺苷(adenosine monophosphate,AMP)(美国Sigma公司),HKⅡ、Bax单克隆抗体(ab131196,Abcam),MSETB缓冲液(210 mmol/L甘露醇,70 mmol/L蔗糖,0.5 mmol/L乙二胺四乙酸,10 mmol/L Tris-HCl,0.2%牛血清白蛋白,pH值为7.4)、SET缓冲液(280 mmol/L蔗糖,0.5 mmol/L乙二胺四乙酸,10 mmol/L Tris-HCl,pH值为7.4)(上海酶联生物科技有限公司),磷二亚硫酸钠、高氯酸(上海化学试剂有限公司试剂一厂)。
1.2.3 仪器与设备 Langendorff离体心脏灌流装置(美国RADONTI公司),生物机能检测记录仪(PowerLab system,AD Instrument Ltd.澳大利亚),酶标仪(BioTek公司,美国),Western blotting化学成像系统(Biored,美国)。
1.3 分组及大鼠模型制备 将50只SD雄性大鼠采用简单随机抽样法分为假手术组、模型组、丹参多酚酸盐组、HKⅡ抑制剂组、HKⅡ抑制剂+丹参多酚酸盐组,每组10只。各组大鼠腹腔注射1 000 U/kg肝素抗凝,腹腔注射50 mg/kg戊巴比妥钠麻醉;取出心脏置于0~4 ℃的0.9%氯化钠溶液中,悬挂于Langendorff离体心脏灌流装置上,逆行恒压灌注,剪开右心房,使冠状动脉流出液自然流出;采用95% O2+5% CO2混合气饱和的K-H缓冲液(pH值7.35~7.40)在恒温(37 ℃)、恒压〔100 cm H2O(1 cm H2O=0.098 kPa)〕条件下灌注;剪开左心耳,将连接有测压导管的心室球囊送入左心室,另一端连接生物机能检测记录仪;灌流液及心脏周围温度用恒温循环水浴维持在(37.0±0.5)℃;平衡灌注30 min,待心脏各项功能稳定,关闭灌流液停止灌流,造成全心缺血,31 min后打开灌流液再次灌流30 min,制备离体心脏心肌缺血再灌注损伤模型[11]。其中假手术组不关闭灌流液;模型组建模后给予含有0.9%氯化钠溶液(20 mg/kg)的灌流液灌流;丹参多酚酸盐组建模后给予含有丹参多酚酸盐(20 mg/kg)的灌流液灌流;HKⅡ抑制剂组建模后给予含有HKⅡ抑制剂(10 mg/kg)的灌流液灌流;HKⅡ抑制剂+丹参多酚酸盐组建模后给予含有丹参多酚酸盐(20 mg/kg)及HKⅡ抑制剂(10 mg/kg)的灌流液灌流。
1.4 实验方法
1.4.1 心脏组织细胞色素C含量检测 取100 mg大鼠心脏组织,4 ℃条件下采用PBS匀浆,按照细胞色素C检测试剂盒说明书,分别取0.1 mmol/L细胞色素C标准品0.2、0.4、0.6、0.8、1.0 ml加蒸馏水至1.5 ml,再加入磷二亚硫酸钠1 ml,采用酶标仪检测520 nm处吸光度值,绘制标准曲线计算细胞色素C含量。
1.4.2 心脏组织腺苷酸含量检测 取300 mg大鼠心脏组织,4 ℃条件下采用PBS匀浆,收集到1.5 ml EP管中,12 000 r/min离心3 min(离心半径115 mm),去除上清液,加入200 μl高氯酸于冰上处理心脏组织匀浆液45 min;4 ℃ 12 000 r/min离心3 min(离心半径115 mm),取上清液,经过0.22 μm微孔滤膜过滤后通过高效液相色谱(high performance liquidchromatography,HPLC)法检测ATP、ADP、AMP含量。
1.4.3 心脏组织线粒体制备 取100 mg大鼠心脏组织,放入玻璃匀浆器中,加入MSETB缓冲液10 ml/g,手动匀浆10次。所得匀浆液以2 000 r/min离心3 min(离心半径115 mm),取上清液,12 000 r/min离心8 min(离心半径115 mm),所得沉淀即为线粒体,以MSETB缓冲液将所得沉淀洗涤1次。将沉淀按10∶1(V/W)悬于SET缓冲液中,整个线粒体制备过程均在4 ℃下进行。
1.4.4 mPTP吸光度检测 采用肿胀液(120 mmol/L KCl,10 mmol/L Tris-HCl,20 mmol/L MOPS,50 mmol/L KH2PO4,pH值为7.4)将线粒体稀释至蛋白终浓度为0.25 g/L,25 ℃下将200 μmol/L CaCl2作用于线粒体,采用紫外可见分光光度计观察520 nm 处mPTP吸光度,mPTP吸光度可反映mPTP开放情况[12]。
1.4.5 Western blotting法检测线粒体中HKⅡ、Bax表达水平 取200 mg大鼠心脏组织,置于冰上,剪成小块,加入1 ml RIPA裂解液,匀浆2 min,12 000 r/min离心8 min(离心半径115 mm),取上清液,提取蛋白质,行十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),电泳条件为60 V 25 min,150 V 2 h。电泳结束后以电转移法将蛋白从凝胶转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,采用5%脱脂奶粉封闭过夜,分别加入一抗兔抗鼠HKⅡ及Bax单克隆抗体各10 ml(工作液稀释比例为1∶1 000)并室温孵育2 h,然后加入二抗鼠抗兔多克隆抗体10 ml(工作液稀释比例为1∶5 000)并室温孵育2 h,最后将PVDF膜用ECL化学发光试剂盒(美国Viagene公司)处理并显影,检测HKⅡ、Bax表达水平。
1.5 统计学方法 采用SPSS 13.0统计学软件进行数据处理。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞色素C含量 假手术组心脏组织细胞色素C含量为(257.8±23.2)μmol/mg,模型组为(357.7±31.1)μmol/mg,丹参多酚酸盐组为(289.0±17.2)μmol/mg,HKⅡ抑制剂组为(389.5±22.3)μmol/mg,HKⅡ抑制剂+丹参多酚酸盐组为(365.2±24.1)μmol/mg,五组比较差异有统计学意义(F=166.32,P<0.05);其中模型组高于假手术组,丹参多酚酸盐组低于模型组,HKⅡ抑制剂组高于模型组,HKⅡ抑制剂+丹参多酚酸盐组高于丹参多酚酸盐组,差异有统计学意义(P<0.05)。
2.2 腺苷酸含量 五组心脏组织AMP含量比较,差异无统计学意义(P>0.05)。五组心脏组织ATP、ADP含量比较,差异有统计学意义(P<0.05);其中模型组心脏组织ATP、ADP含量低于假手术组,丹参多酚酸盐组心脏组织ATP、ADP含量高于模型组,HKⅡ抑制剂组心脏组织ATP含量低于模型组,HKⅡ抑制剂+丹参多酚酸盐组心脏组织ATP、ADP含量低于丹参多酚酸盐组,差异有统计学意义(P<0.05),见表1。
表1 五组心脏组织腺苷酸含量比较(±s,μmol/mg)Table 1 Comparison of adenylate content in heart tissues among the five groups
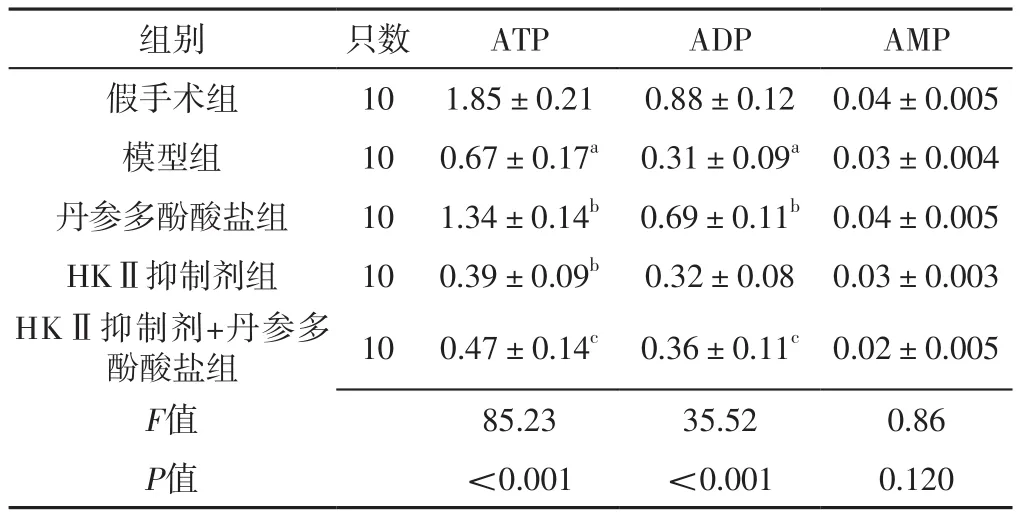
表1 五组心脏组织腺苷酸含量比较(±s,μmol/mg)Table 1 Comparison of adenylate content in heart tissues among the five groups
注:HKⅡ=己糖激酶Ⅱ,ATP=三磷酸腺苷,ADP=二磷酸腺苷,AMP=单磷酸腺苷;a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与丹参多酚酸盐组比较,P<0.05
组别 只数 ATP ADP AMP假手术组 10 1.85±0.21 0.88±0.12 0.04±0.005模型组 10 0.67±0.17a 0.31±0.09a 0.03±0.004丹参多酚酸盐组 10 1.34±0.14b 0.69±0.11b 0.04±0.005 HKⅡ抑制剂组 10 0.39±0.09b 0.32±0.08 0.03±0.003 HKⅡ抑制剂+丹参多酚酸盐组 10 0.47±0.14c 0.36±0.11c 0.02±0.005 F值 85.23 35.52 0.86 P值 <0.001 <0.001 0.120
2.3 mPTP吸光度 假手术组mPTP吸光度为(0.032±0.012),模型组为(0.065±0.013),丹参多酚酸盐组为(0.042±0.011),HKⅡ抑制剂组为(0.067±0.025),HKⅡ抑制剂+丹参多酚酸盐组为(0.064±0.016),五组比较差异有统计学意义(F=16.21,P<0.05);其中模型组高于假手术组,丹参多酚酸盐组低于模型组,HKⅡ抑制剂组高于模型组,HKⅡ抑制剂+丹参多酚酸盐组高于丹参多酚酸盐组,差异有统计学意义(P<0.05)。
2.4 HKⅡ、Bax表达水平 五组线粒体中HKⅡ、Bax表达水平比较,差异有统计学意义(P<0.05);其中模型组线粒体中HKⅡ表达水平低于假手术组、Bax表达水平高于假手术组,丹参多酚酸盐组线粒体中HKⅡ表达水平高于模型组、Bax表达水平低于模型组,HKⅡ抑制剂组线粒体中HKⅡ表达水平低于模型组,HKⅡ抑制剂+丹参多酚酸盐组线粒体中HKⅡ表达水平低于丹参多酚酸盐组、Bax表达水平高于丹参多酚酸盐组,差异有统计学意义(P<0.05),见表2、图1。

图1 五组线粒体中HKⅡ、Bax表达电泳图Figure 1 Electrophoresis of HKⅡ and Bax expression in mitochondria among the five groups
表2 五组线粒体中HKⅡ、Bax表达水平比较(±s)Table 2 Comparison of HKⅡ and Bax expression levels in mitochondria among the five groups

表2 五组线粒体中HKⅡ、Bax表达水平比较(±s)Table 2 Comparison of HKⅡ and Bax expression levels in mitochondria among the five groups
注:a表示与假手术组比较,P<0.05;b表示与模型组比较,P<0.05;c表示与丹参多酚酸盐组比较,P<0.05
组别 只数 HKⅡ Bax假手术组 10 1.00±0.01 1.00±0.02模型组 10 0.21±0.02a 4.30±0.04a丹参多酚酸盐组 10 0.73±0.04b 2.60±0.05b HKⅡ抑制剂组 10 0.16±0.03b 3.90±0.08 HKⅡ抑制剂+丹参多酚酸盐组 10 0.21±0.05c 4.20±0.05c F值 37.45 18.32 P值 <0.001 <0.001
3 讨论
己糖激酶(hexokinases,HK)是机体中调节糖酵解的关键限速酶。在哺乳动物细胞中,HK家族主要有以下4种亚型:Ⅰ、Ⅱ、Ⅲ和Ⅳ。在正常组织细胞中,HK及其同工酶表达水平均较低,其中表达水平最高的是HKⅠ。HKⅡ属胰岛素敏感型,正常情况下,仅在心脏、骨骼肌和脂肪组织中微量表达[13]。HKⅠ及HKⅡ均具有与线粒体结合的能力,参与调节线粒体的功能,但HKⅢ和HKⅣ没有相关报道[14]。近年研究发现,HKⅡ除具有催化糖酵解活性的作用外,还有拮抗细胞凋亡的作用,HKⅡ可与VDAC、Bcl-2家族成员等构建mPTP,调控线粒体膜通透性,拮抗线粒体途径的细胞凋亡[15]。所以围绕HKⅡ在癌症发生及发展中的研究相对较多,但近年研究发现,HKⅡ保护心肌线粒体功能,特别是在心脏缺血、低氧条件下同样发挥重要作用[16-17]。丹参多酚酸盐是已上市的用于治疗心绞痛、冠心病等心脏病的有效药物,研究表明,丹参多酚酸盐在心肌缺血再灌注损伤中同样具有良好的保护作用,可以降低心脏氧化应激的发生率,升高超氧化物歧化酶水平,改善机体抗自由基功能,减轻心肌内质网应激,恢复线粒体ATP能量供应等[18-20],但是其具体作用机制尚不清楚。HKⅡ还可参与调控线粒体功能,而线粒体是细胞能量的合成器[21]。本研究结果显示,丹参多酚酸盐组心脏组织细胞色素C含量低于模型组,丹参多酚酸盐可以降低心肌缺血再灌注损伤模型大鼠心脏组织细胞色素C含量。细胞色素C是线粒体损伤的标志,当线粒体发生损伤后,线粒体中的细胞色素C含量升高[22]。给予HKⅡ抑制剂后,丹参多酚酸盐的保护作用降低。说明丹参多酚酸盐可能通过调控HKⅡ发挥作用。本研究结果还显示,丹参多酚酸盐可以明显影响心脏组织的能量代谢,丹参多酚酸盐可以恢复心肌缺血再灌注损伤模型大鼠心脏组织ATP供应,而给予HKⅡ抑制剂后,其调控作用降低。mPTP是线粒体内膜实现通透性转换的主要途径。HK是组成mPTP的主要蛋白,近年研究发现,HKⅡ在心肌细胞中是构成mPTP的主要蛋白,当HKⅡ表达降低,mPTP开放增多,可以使线粒体内膜通透性急剧上升[23],相对分子量>1.5 kDa的大分子物质可以非选择性地通过线粒体内膜,导致线粒体膜去极化、线粒体内膜跨膜电位持续下降以及呼吸链氧化磷酸化解偶联,进而出现ATP合成障碍、活性氧生成过多、基质肿胀,随着线粒体肿胀进一步加重,折叠的内膜被打开,最终导致线粒体外膜破裂,导致线粒体中大量细胞色素C被释放,从而诱导细胞凋亡[24-25]。本研究结果显示,丹参多酚酸盐可减少mPTP开放,恢复线粒体能量供应,而给予HKⅡ抑制剂后,丹参多酚酸盐的上述作用减弱。Western blotting法实验结果显示,丹参多酚酸盐可以有效提高HKⅡ表达水平,并抑制凋亡蛋白Bax表达水平,说明丹参多酚酸盐可以提高心肌细胞中HKⅡ表达水平,促进细胞能量代谢的增加,从而恢复细胞的能量供应,减少心肌缺血再灌注损伤的发生。HKⅡ是机体中调节糖酵解的关键限速酶,其参与细胞糖酵解反应,而糖酵解反应是细胞能量供应在无氧条件下的主要方式之一,因此丹参多酚酸盐可能通过促进细胞糖酵解反应,补充能量代谢,发挥其保护作用,但其作用机制还有待明确。
综上所述,丹参多酚酸盐可降低大鼠离体心脏心肌缺血再灌注损伤模型心脏组织细胞色素C含量、mPTP吸光度、线粒体中Bax表达水平,升高心脏组织ATP、ADP含量、线粒体中HKⅡ表达水平,丹参多酚酸盐可以通过调控HKⅡ,进而改善心肌细胞线粒体能量供应,发挥改善大鼠离体心脏心肌缺血再灌注损伤的作用,但是丹参多酚酸盐如何参与调控HKⅡ的分子机制还有待进一步明确,其作用靶点需在后续的研究中发现。
作者贡献:贾敏进行文章的构思与设计,负责文章的质量控制及审校,对文章整体负责、监督管理;王永贤进行研究的实施与可行性分析,资料收集;高景峰进行资料整理;王永贤、霍涛进行论文的撰写及修订;许立刚进行统计学处理。
本文无利益冲突。
