光照对动物季节性繁殖影响的研究进展
2023-02-22刘懿慧周宇桥张佩华
刘懿慧,周宇桥,周 智,张佩华*
(1. 湖南农业大学 动物科学技术学院,湖南 长沙 410128;2. 湖南农业大学 化学与材料科学学院,湖南 长沙 410128)
自然界环境的变化呈现季节性(周期性)波动状态。生物体具有感知外部环境变化并灵活调整个体状态的能力,该能力源于机体内部存在生物钟系统[1]。生物钟受气候、温度、光照、进食等多种外源节律因子调节[2],同时也具有内源节律性,即不受外源节律因子影响也会产生节律性波动,且周期为24 h,因此也被称为昼夜节律[3]。内源节律与外源节律往往是同步的,当这种平衡被破坏后,机体将会受到负面影响,出现代谢紊乱、疾病等现象[4]。
光周期(24 h中黑暗与光照的时间分配比例)作为机体内源节律响应外源节律变化最敏感的线索[3],极大程度上影响着动物的生理和行为活动,其中很典型的是动物季节性繁殖现象。本文分别梳理光照调控动物繁殖活动的通路,以便更好的理解不同类别脊椎动物的繁殖机制,并就畜禽生产中人工光照应用现状进行归纳,为在畜禽生产中科学应用光照提供参考。
1 动物的季节性繁殖现象
动物的繁殖活动受下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadalaxis,HPGA)的调控[5](图1)。当光照时长达到或超过临界值时,HPGA被激活,导致性腺发生变化。有研究表明,仓鼠处于12.5 h或更长时间的光照才能看到睾丸生长;日本鹌鹑超过11.5 h的光照时间可以刺激睾丸生长[6];扬州鹅的繁殖活动也受长光照调控[7];这与啮齿动物和禽类在春、夏长日照季节繁殖的现象相一致。家畜中呈季节性繁殖最明显的动物是羊,繁殖活动主要发生在秋季;其性腺也是在短光照条件下更大[8];马、兔的繁殖虽无明显的季节性,但长光照条件更能促进繁殖活动[9-10]。当光照时长不处于临界范围时(繁殖季节过后),它们的HPGA自动关闭,性腺也开始退化[11],繁殖活动暂时停止。动物间不同的繁殖特性都是为了确保后代可以在气候适宜、食物充足的季节出生,继而提高繁殖成功率及后代生存率。但现在仅依靠动物季节性繁殖无法满足市场对畜禽产品的需求,通过调控光照、注射激素等方法可以提高动物繁殖力,使畜禽产品产量满足市场需求,进而获得较高的经济效益[12]。
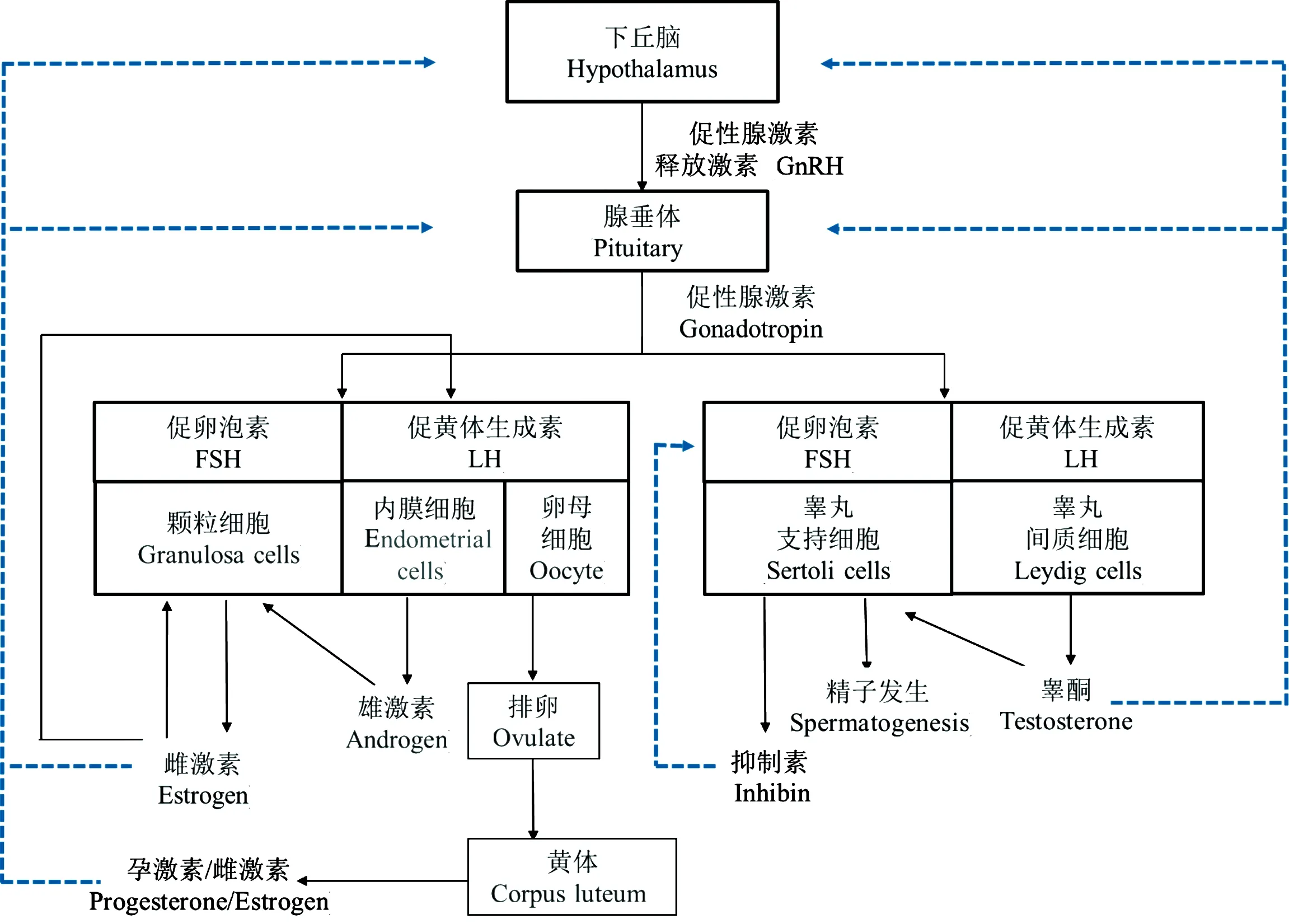
图1 下丘脑-垂体-性腺轴
关于光照调控动物季节性繁殖的研究方向一直处于稳定发展状态(图2),随着光化学与动物学等相关研究的深入,研究者们进一步确定动物季节性繁殖能力受光照具体参数-光强度与光波长(光色)影响,且光照调控哺乳动物与禽类的季节性繁殖机制还存有差别。
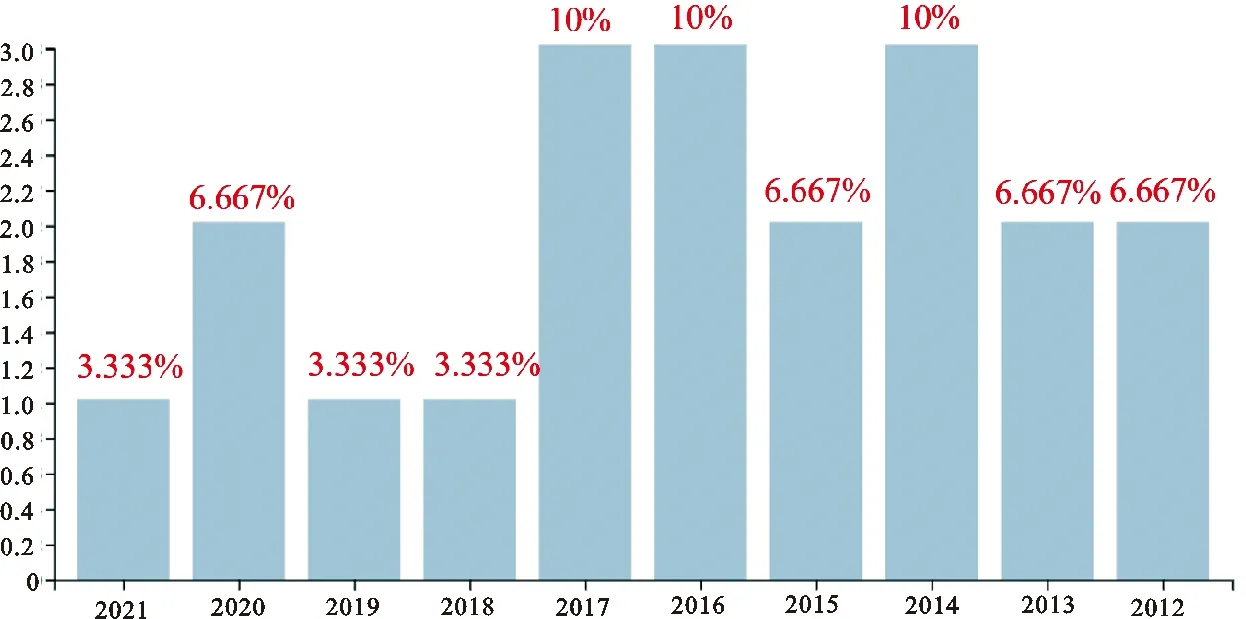
图2 光照调控动物季节性繁殖研究发展趋势(2012-2021)
2 动物的光感受器
2.1 哺乳动物的光感受器
哺乳动物对光的感知仅依赖于视网膜中的光感细胞[11]。其中,含有视紫红质的视杆细胞与含有视锥蛋白的视锥细胞主要发挥着成像作用,而能够合成OPN4(视黑蛋白,一种非视觉蛋白)的自主感光视网膜神经节细胞(intrinsically photosensitive retinal ganglion cells,ipRGCs)则在昼夜节律调控中扮演着重要角色[13]。
2.2 禽类的光感受器
禽类的光感受器较哺乳动物复杂,包括眼部感光器和大脑深部感光器[14]。研究者最先在禽类松果体(pineal gland,PG)和下丘脑上发现了OPN4的存在[15],之后VA-opsin(脊椎动物古老视蛋白)和OPN5(神经视蛋白)也相继被发现存在于下丘脑中[16]。经过一系列致盲、戴帽、松果体切除、局部照射等试验后,确定与禽类季节性繁殖相关的脑深部光感受器存在于下丘脑中[17]。
OPN4虽然存在于下丘脑中,但表达量低于PG且其光谱最大敏感度为476~484 nm[18],这一范围不在繁殖光谱范围(483~492 nm)[19],所以排除了OPN4神经元负责繁殖光周期反应的可能性。VA-opsin神经元和OPN5神经元作为控制季节性繁殖的光感受器有很强的相关性证据[20]。Nakane等[16]通过系列试验推测OPN5在禽类季节性繁殖中发挥着作用;首先,研究团队发现OPN5的光谱最大敏感度约在420 nm,确定了OPN5为一种短波敏光色素;接着他们利用短波光处理,发现鹌鹑(戴着眼罩且已进行松果体切除术)睾丸依旧呈现发育状态,进而验证了OPN5是调节鹌鹑季节性繁殖周期的大脑深层光感受器。VA-opsin光谱最大敏感度约为490 nm[21];而且研究者们发现VA-opsin与促性腺激素释放激素(gonadotropin releasing hormone,GnRH)神经元共定位,光信号可直接调节GnRH在禽类中的表达,因此推测VA-opsin在该细胞群体中的共存可以控制禽类季节性繁殖[22]。由上述内容可以看出,禽类具有全波段的光感视蛋白;而且禽类视网膜上近乎均匀的镶嵌着5种视锥细胞[23],所以禽类拥有着惊人的色彩感知力(图3);继而禽类可以利用多种光波段来测量光周期。针对禽类这一特性进行研究发现光色对禽类的影响不具有普适性,蓝、绿光对肉鸡的影响效果较佳,可以促进其生长[24];而对于更重视繁殖能力的蛋鸡则红光效果更好[25]。
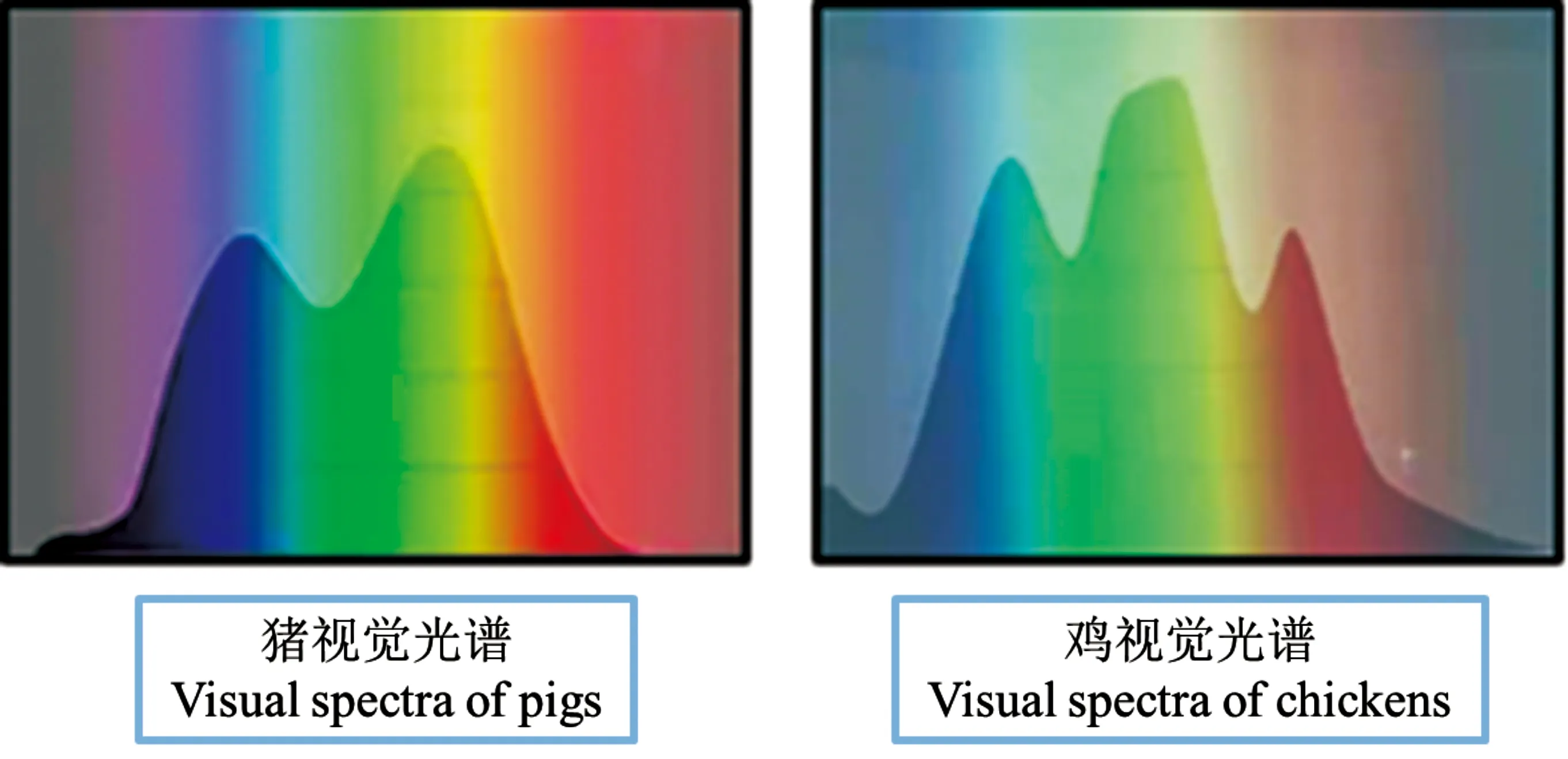
图3 猪、鸡视觉光谱对比[26-27]
3 动物的季节性繁殖机制
动物的季节性调控过程受生物钟系统调控,可归纳为感知、传递、调控的过程。光感受器将感知到的光信号传递到生物钟中枢振荡器引发内分泌系统激素分泌,进而调控外周振荡器活动[5]。
3.1 哺乳动物的季节性繁殖机制
哺乳动物的中枢振荡器为下丘脑视交叉上核(suprachiasmatic nucleus,SCN)[28];ipRGCs将感知到的光信号传递到SCN上,通过多突触连接将光信号传递到PG,引发褪黑素(melatonin,MLT)分泌活动的变化[29]。研究表明,MLT是最具有昼夜节律分泌特性的激素[30],在哺乳动物的季节性繁殖调控中发挥核心作用[31];其通过介导HPGA调节相关激素分泌,影响生殖腺与繁殖能力[32]。光周期可以通过MLT调节繁殖相关神经递质——甲状腺激素(thyroid hormone,TH)、亲吻素(Kisspeptin)、RF酰胺相关肽-3(RF amide-related Peptide,RFRP-3)的节律性表达,影响GnRH神经元对GnRH的分泌,继而调控动物繁殖活动(图4)。
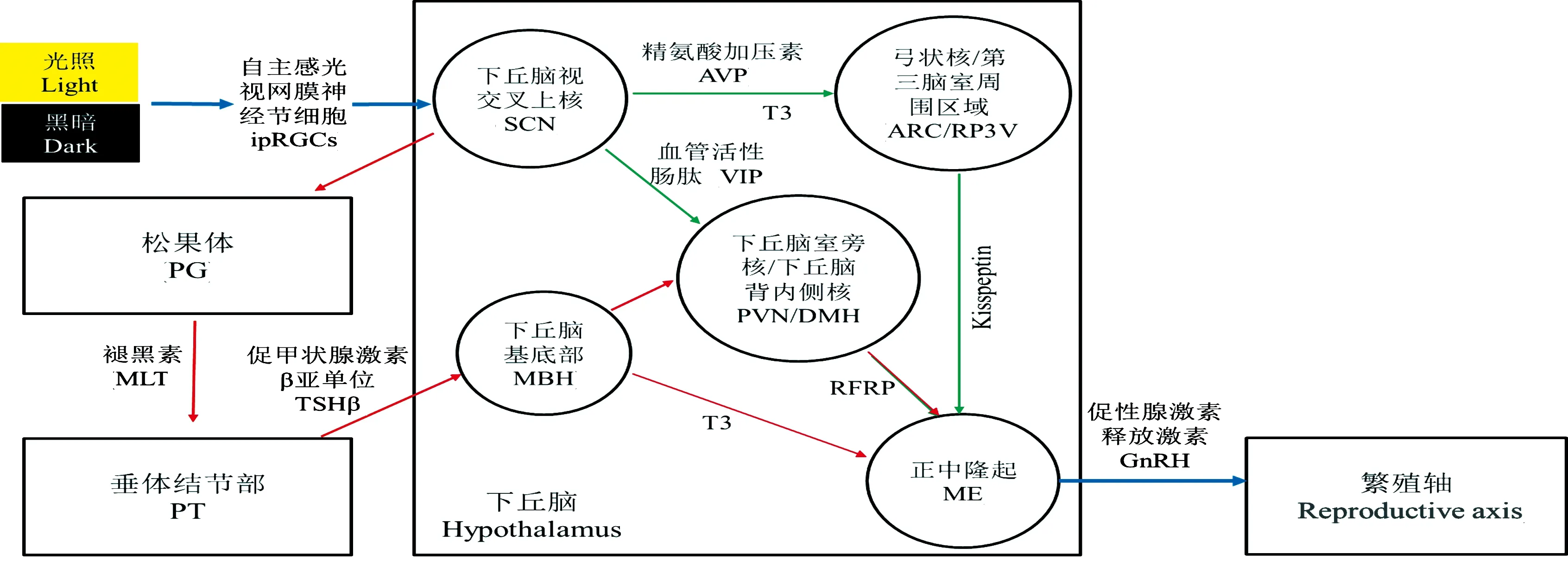
图4 哺乳动物季节性繁殖机制
3.1.1 促甲状腺激素参与调控哺乳动物的季节性繁殖 垂体结节部(pars tuberalis,PT)是MLT协调季节功能的中心靶点[33]。MLT通过涉及转录调节因子EYA3的机制响应光周期,该机制在长光照条件下会促使PT的促甲状腺激素β亚单位(thyroid stimulating hormone Beta,TSHβ)输出增加[34],TSHβ与促甲状腺激素受体(TSHR)结合,调节下丘脑内侧基底部(mediobasal hypothalamus,MBH)伸展细胞中2型甲状腺素脱碘酶基因(Type 2 Iodothyronine Deiodinase,DIO2)和3型甲状腺脱碘酶基因(Type 3 Iodothyronine Deiodinase,DIO3)的表达和转换,继而改变MBH的TH分泌量[35]。长光照诱导DIO2编码甲状腺激素激活酶,将四碘甲腺原氨酸(T4)转化为高生物活性的三碘甲腺原氨酸(T3),而短光照诱导的DIO3则钝化T3、T4;即长光照能够加速T3的积累[36]。T3与受体结合引起正中隆起部GnRH神经元末梢与神经胶质末梢间形态的变化,进而影响GnRH的释放,介导HPGA调节动物的繁殖活动;上述过程经历了从垂体到下丘脑逆行信号的传递,因此被称为逆向调节通路[37]。
3.1.2 Kisspeptin参与调控哺乳动物的季节性繁殖 Kisspeptin为KISS1基因编码的一种神经肽,由位于第三脑室周围区域(rostral periventricular region of the third ventricle,RP3V)和弓状核(hypothalamic arcuate nucleus,ARC)的两个主要神经元群产生[38]。Revel等[39]在研究过程中发现,短光照处理的金色仓鼠中Kisspeptin表达比长光照处理的个体低,Mason等[40]的研究结果与之一致,继而证明Kisspeptin的表达受光周期调节;但切除PG后,短光照处理并没有引发Kisspeptin表达的下降[39],因此确定Kisspeptin的表达是受MLT调节的;而在ARC区并没有发现MLT受体[41],故此调节方式为间接调节。有研究指出,Kispeptin神经元还可通过SCN神经元投射精氨酸加压素进行直接调节[42]。同时,Kisspeptin的表达还受下游性激素的反馈调节,具体表现为促进RP3V中的Kispeptin神经元,抑制ARC中的Kispeptin神经元,上、下游通路共同调控Kisspeptin的表达[43]。被激活的Kisspeptin与分布在GnRH神经元上的受体(GPR54)结合,作用于GnRH神经元,刺激GnRH分泌,介导HPGA调节动物的繁殖活动[44]。近期,研究者在Kisspeptin神经元上发现TH受体的存在[45],因此人们推测TH为MLT调控Kisspeptin的中间介质。
3.1.3 RFRP-3参与调控哺乳动物的季节性繁殖 RFRP-3是当前哺乳动物体内唯一被发现的HPGA抑制因子[46],与鹌鹑体内发现的促性腺激素抑制激素(gonadotropin inhibitory hormone,GnIH)同源,能够抑制GnRH的释放[47]。研究证实,RFRP神经元受SCN神经元与光照周期调节:SCN通过投射血管活性肠肽直接抑制RFRP神经元活动[48];MLT介导光周期间接调节RFRP神经元活动(中间介质为TH)[49],同时光周期可能会影响性激素调节RFRP神经元活动的敏感性[50]。RFRP-3与受体(GPR147、GPR74)结合,阻断GnRH的信号转导通路抑制繁殖活动[51]。在GnRH细胞和Kisspeptin细胞上有GPR147和GPR74表达,由此,提出一种假设:Kisspeptin可能位于RFRP信号环路的下游,这需要进一步研究验证。最新研究指出动物体重波动与季节性繁殖相同步[52],Kisspeptin、RFRP在其中扮演着重要角色[46,53]。
MLT是光周期调控哺乳动物繁殖最重要的介导因子。因此在哺乳动物繁殖调控中,除了利用光照间接调控MLT含量以改变动物繁殖状态外,还常通过直接给予外源性MLT(埋置、注射、饲喂)的方式调节机体内MLT含量,影响动物繁殖活动[54]。
3.2 禽类的季节性繁殖机制
禽类具有三个中枢振荡器,包括SCN、视网膜与PG。值得注意的是,不同品种的禽类体内起主导地位的中枢振荡器有所不同[55]。光信号通过光感受器传达到主中枢振荡器引发相关激素分泌,影响禽类繁殖活动(图5)。与哺乳动物相同,TH在禽类的季节性繁殖调控中发挥着重要作用[56];但这一过程不确定是否有MLT参与调控。关于MLT作为核心因子介导光照调控禽类繁殖活动的观点始终存有争议性。起初,人们认为MLT仅表达在视网膜与PG中[57],因此在发现PG切除术没有对盲禽的繁殖活动造成影响后,断定MLT不是光照调控禽类繁殖活动的介导因子。随着检测手段的精进,研究者发现切除鹌鹑PG,会导致GnIH前导肽mRNA和成熟肽水平下降,而给予外源MLT可复原此现象[58],由此确定MLT是光照调控禽类繁殖活动的介导因子。禽类GnIH神经元中存在MLT受体,MLT直接诱导下丘脑中GnIH的表达与成熟GnIH神经肽的分泌,进而影响HPGA,实现对禽类繁殖活动的调控[59]。但目前仅能确定GnIH是介导MLT调控禽类繁殖的重要激素,MLT是否影响TH通路需进一步研究确定。
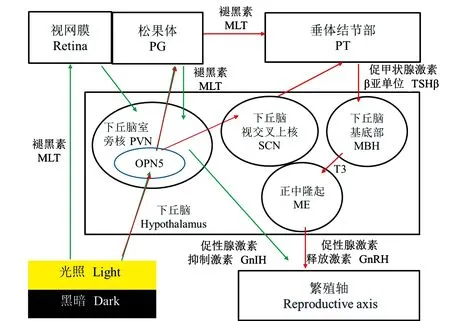
图5 禽类季节性繁殖机制
4 人工光照在畜禽生产中的应用
最初畜禽生产中灯光的应用主要是为了方便养殖人员管理。而随着实际生产中人们发现光照条件是影响畜禽生长、繁殖的重要因素,畜禽生产中人工补光技术才受到重视。
4.1 人工光照在畜禽生产中的应用历程
早期畜禽生产中选择的人工光源是白炽灯,其利用灯丝电加热到白炽状态,以热电辐射发出光。因其光色接近太阳光且价格实惠,被养殖业高度认可并广泛应用;但其使用寿命短、发光效率低、耗能高,提高了养殖成本,逐渐被市场淘汰。荧光灯利用低气压下的汞蒸气通电后释放紫外线激发荧光粉而发出可见光;其优点在于使用寿命长、发光效率高、耗能低,光色可随荧光材料的不同而变化,但几乎所有荧光灯无法实现全优光谱;并不适用于禽类养殖照明(禽类可响应多种光波段)[60]。LED灯是目前最新的人工光源,通过半导体器件将电能直接转化为可见光。LED灯价格较高,但发光效率高、更加节能、使用寿命长,从长远性分析会大大降低养殖成本[61],在养殖业中使用率逐渐上升[62]。而且LED灯涵盖全光谱范围,能够满足禽类养殖光照条件的要求,在禽类养殖中使用率最高(图6)。目前,大型禽类养殖场采用了更为科学的光控系统,将LED灯与调光器结合使用,平稳调节光的输出强度,避免强光与弱光突然转换造成禽类应激反应[60]。然而有研究指出灯具的频闪问题会影响机体健康;研究者不断的开发、探索,设计出频闪范围在人体适应区间(人眼最大感知值为25 Hz)的灯具[63],并广泛的应用在各个领域(包括养殖业),但禽类对频闪感知的范围更大(可感知205 Hz),人类无法感知的频闪也会对禽类造成影响,所以这种灯具并不适合于禽类养殖(图7)。由上述内容可知,LED灯是目前最适用于畜禽生产的人工光源,在实际生产中应进一步推广,并且为进一步促进禽类健康养殖,应针对禽类特性制作专业的LED养殖灯。
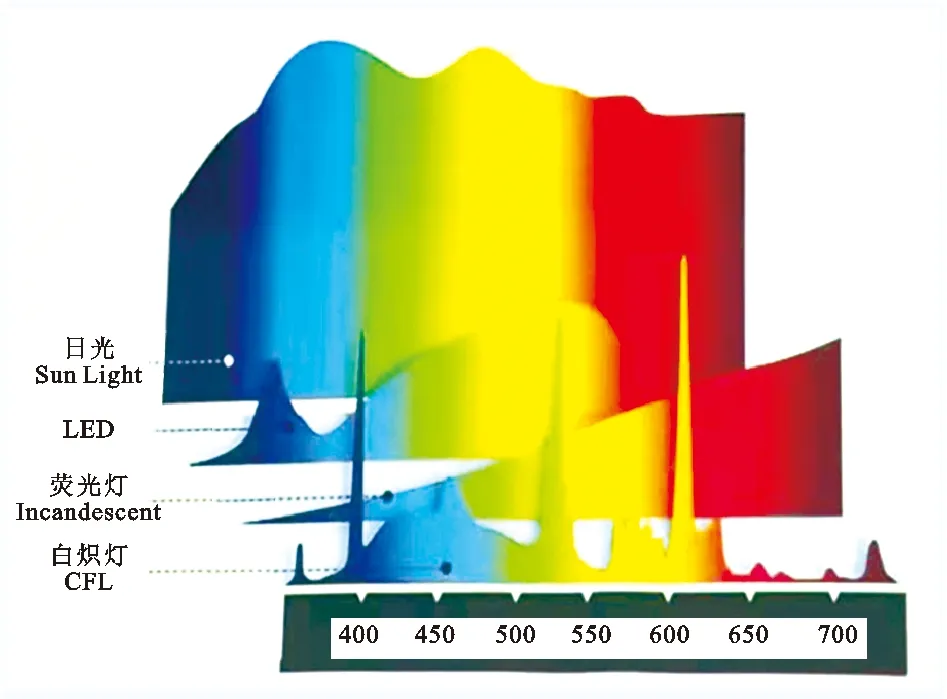
图6 不同灯光光谱对比
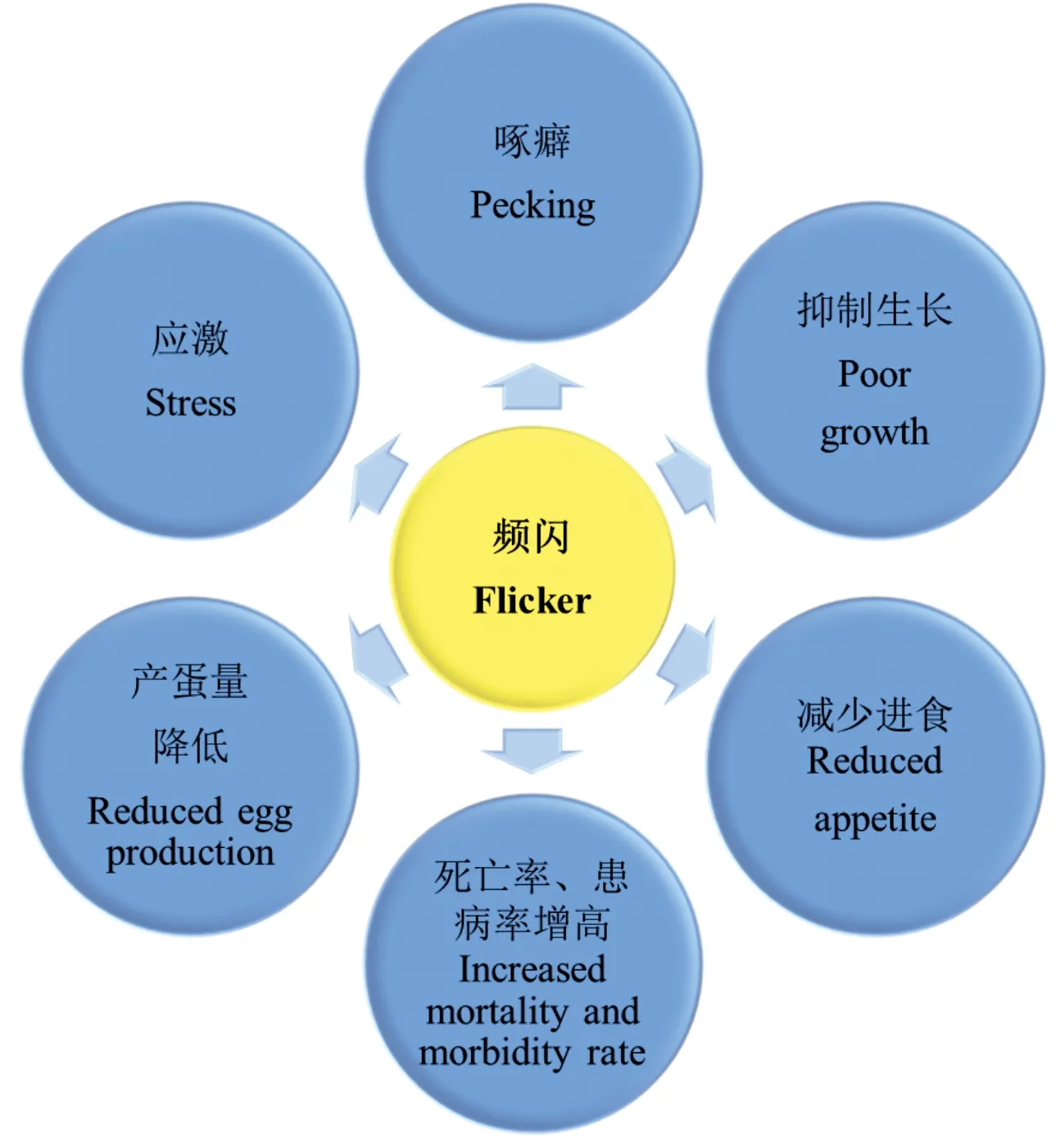
图7 频闪对禽类的影响
4.2 人工光照调控畜禽繁殖的效果
目前畜禽生产中补光主要从光周期、光强度与光色三个参数介入。有研究表明,对奶牛采取长光照处理可以对其繁殖性能起到促进作用,并且在冬季进行长光照会促使母畜发情和提高受孕率[64]。He等[65]通过试验证实外源性褪黑素和光周期变换都会对母鸡性成熟产生影响。朱勇等[66]发现20 lx光照强度有利于提高母羊发情率、受胎率和胎均产羔数;而20 lx的光照强度也可明显提高蛋鸡的产蛋性能[67]。艾尧天等[68]指出哺乳母兔在60 lx光照强度和波长较长的红黄色光下,受胎率、产活仔数、初生窝重、泌乳力、仔兔平均日增重均呈现较好状态;潘孝青等[69]的试验也证实LED彩色光比白炽灯光更易促进母兔同期发情率。对于扬州鹅来说,白光和红光处理可促使产蛋率呈增高趋势[70]。相关研究指出,不仅单一的光照参数会影响动物繁殖,复合光照参数也发挥着作用。胡平等[71]发现补光时间为4 h、强度为20.5 lx时,白羽王鸽产蛋性能较好。罗刚等[72]的试验结果指出在强度为100 lx的绿光LED光环境下,饲养的母兔繁殖性能最佳。
4.3 养殖光照标准
研究的深入以及实际生产取得的应用效果,使人们愈加认可“光照在养殖中的重要性”。国家标准(GB/T32148-2015)、地方标准(DB21/T2740-2017等)、企业标准(T/SZFAA05-2020等)以及动物福利要求(TCAS242-2017等)均提出:在畜禽养殖中需制定科学的光照计划并实施,然而内容里并没有准确的说明光照系统全面的参数指标。
5 小结与展望
科学化养殖技术的应用源于坚实的理论基础,目前光照影响动物季节性繁殖调控机制已基本明晰。PT来源的TSH是调节动物季节性繁殖的关键激素,MLT是调控哺乳动物季节性繁殖活动的核心激素,但通路中各调控因子间是否存在上下游介导关系还未确定,多种科研方法(转录组学、蛋白质组学、代谢组学等)的迅速发展为下一步研究提供了有力支持。
光照是调控动物季节性繁殖的重要环境因素,研究证明LED灯作为人工光源对畜禽繁殖影响效果较好。不同畜禽适用的最佳光照参数不同,需进一步研究确定畜禽感光特性,并制定相应的养殖光照参数标准,为专业养殖灯的制作提供理论依据。
