种群行为对疾病空间传播动态的影响
2023-02-22苏敏郑童孙艳辉
苏敏, 郑童, 孙艳辉
种群行为对疾病空间传播动态的影响
苏敏*, 郑童, 孙艳辉
合肥工业大学数学学院, 合肥 230601
依据基于个体的空间模拟模型, 文章构建了食饵感染疾病的一类捕食-食饵系统, 并从特征调节的食饵偏好、寄生导致的宿主繁殖率下降以及捕食者对食饵资源的转换等方面研究种群行为的改变对疾病空间传播动态与生物控制的影响。其中, 文章采用了无标度网络、小世界网络、随机网络以及规则格子等四种空间网络结构来明确网络异质性对疾病空间动态的影响。模拟结果显示, 特征调节的捕食种群对食饵偏好的改变以及对食饵资源的转换行为显著影响了疾病的流行与捕食者的数量。不同网络结构下, 疾病的流行与捕食者的数量之间均呈现显著的负相关性, 这也说明捕食者对疾病的生物控制有不可忽视的作用; 而寄生调节的宿主生长率对疾病的传播和捕食者数量产生较为微弱的影响。另外, 空间网络拓扑结构的异质性对疾病的流行率也产生显著影响, 网络结构异质性的增加将不利于局部感染作用的发生, 从而抑制疾病的空间传播。最后, 斑块发生率的模拟结果揭示, 虽然网络节点的度越高越有利于局部相互作用的发生, 但是已感染食饵为了权衡感染与捕食风险的正负作用, 其斑块发生率呈现先增加后减弱的趋势。总之, 种群的行为与网络空间结构的异质性均可作为控制疾病传播的有效策略, 具有一定的研究意义。
网络结构; 特征调节; 捕食转换; 食饵偏好; 基于个体的模型
0 前言
种群行为的改变是影响生物群落动态及稳定性的一个重要因素[1–4]。研究表明, 由寄生调节引起的宿主种群的行为特征改变对宿主群落结构与功能起到重要作用[3–4]。一方面, 寄生可以直接影响宿主种群的特征, 例如寄生的影响导致感染疾病宿主种群的繁殖率降低, 从而影响宿主种群的丰富度; 另一方面, 寄生可以通过改变宿主种群的生活史特征, 间接影响宿主种群动态。寄生的间接影响作用对生物入侵以及食物网结构均产生重要作用[2–4]。大量研究研究表明, 寄生调节的间接效应大致可分为两类: (1)密度调节的间接效应(density-mediated indirect effect), 是指寄生引起的宿主种群额外的死亡[3–4]; (2)特征调节的间接效应(trait-mediated indirect effect), 是指寄生调节引起的宿主行为、特征等的改变[4]。寄生调节的特征改变在自然界中普遍存在, 它不仅能够影响宿主种群本身, 同时对生物群落的物种入侵动态有着不可忽视的作用。Dunn等人[4]从不同的食物网结构上阐述了寄生调节的间接相互作用对生物入侵以及生态系统稳定性的重要影响。竞争生态系统中, 寄生可减弱宿主种群的竞争能力; 而在捕食系统中, 寄生能够引起宿主/食饵对捕食脆弱性的增加[5–6]。例如, 疾病导致鱼类活动的位置更接近于水面, 从而导致被鸟类所捕获; 另外, 寄生可能导致受感染动物的行动变得更为缓慢, 因此容易被捕食者捕获[5–6]。因此, 寄生产生的间接效应能够通过调节入侵种与本地种之间的竞争或者资源消耗作用对生物的入侵动态产生重要影响[4]。
大量有关寄生–宿主/食饵–捕食系统生态传染病系统的研究表明, 捕食者对已感染食饵的成功捕获的概率增加将导致已感染食饵的数量大幅度减少, 从而驱使捕食者种群的捕食偏好从已感染食饵转移到易感染的健康食饵[1–2]。另一方面, 捕食者种群对已感染食饵的捕食偏好, 也提高了捕食者种群自身的死亡概率, 长期进化的优化捕食策略将驱使捕食者对食饵资源的选择转变, 从而使得捕食者个体优先选择健康的食饵, 而逃避已感染的食饵种群[6–7]。捕食行为的转变对维持捕食者种群的数量以及疾病的控制起着至关重要的作用。因此, 寄生调节的宿主行为改变将引起物种间相互作用的改变, 从而影响着整个生物群落的构成与稳定性。同时, 物种间相互作用的改变又将反馈到寄生系统, 对寄生的传播动态产生影响。本文将基于宿主/食饵–捕食系统, 研究特征调节的间接效应对寄生的空间传播动态的影响。
另外, 网络结构作为种群个体之间相互作用的主要形式, 目前已经成为研究接触性感染空间传播动态的重要方法[8–14]。在疾病传播的过程中, 每个种群个体接触的其他个体数量是高度异质性的, 网络结构能够有效地抓住这一特征, 强调局部相互作用对疾病传播动态的影响[8–11]。自Gross等人[8]提出疾病在适应性网络上的传播动态以来, 有关适应性网络上疾病传播动态的研究越来越受到重视, 并且得到了广泛的研究[9–10]。Zhang等人[10]通过易感染个体逃避已感染个体的网络重连构建了适应性网络, 并在此适应性网络结构上研究疾病的空间传播动态。本文将通过适应性网络结构来刻画捕食者对食饵的捕食转变, 探讨在不同网络结构下寄生调节的种群行为特征对疾病空间传播的影响。
1 模型
1.1 网络结构
空间网络结构的异质性主要通过节点度的分布模式进行刻画, 研究表明网络的异质性是影响物种续存与疾病传播动态的重要因素[11]。本文构造了四种网络结构, 通过对比不同网络上的疾病传播动态进一步揭示网络的拓扑结构对疾病传播的影响(网络示意图见图1)。其中, 节点代表个体所占的生境斑块, 连接(或边)代表个体间具有相互作用, 节点度的大小代表了该斑块与周围其他斑块的连接程度[12]。
首先, 我们构建了规则网格(图1A), 规则网格是研究元胞自动机模型以及耦合格子模型经典的方法[12–14]。模型假设, 每个斑块有四个最近邻的相邻斑块, 模拟中采用冯诺依曼邻体结构, 且考虑周期边界条件[13–14]。因此, 采用规则网格的空间网络结构是同质性网格, 并且只考虑种群个体的短距离扩散。其次, 考虑小世界网络结构(图1B), 小世界网络类似于规则网络, 每个斑块均与邻近的四个斑块相连, 但是在整个网络中也存在少数长距离连接[15]。再次, 考虑随机网络, 即斑块随机的选择与其相连的其他斑块(图1C)。虽然每个节点的平均度和规则网络相同, 但是在随机网络中允许长距离的相互作用, 那么节点/斑块的度之间存在差异性[12]。最后, 考虑无标度网络结构(图1D),无标度网络是具有较高异质性的复杂网络, 生成无标度的过程中新加入的节点更倾向于和连边较多的节点进行连接[16]。因此, 无标度网络中大部分节点只和度很低的节点相连, 而存在极少数的节点具有很高的度, 网络节点的度分布服从幂律分布模式[16]。
为了更好的比较网络拓扑结构对疾病传播的影响, 本文在四种网络的构建过程中保持节点数以及边数相同, 即每种网络结构含有的节点数均为1024个, 连接的边数为2048条。
1.2 模型的建立
基于上述四种网络结构, 本文采用基于个体的模拟模型来描述捕食食饵寄生系统中寄生传播的空间动态。对于四种网络结构, 其每个节点均代表一个斑块, 依据种群的寄生系统, 每个斑块又有四种状态, 即被种群个体所占据(易感染个体、已感染个体和捕食者个体)以及空斑块。其中, 一个斑块最多只能被一个种群个体所占据。初始时刻, 种群个体以及空斑块随机的分布在空间网络中。假设每个时间步长内, 易感染个体均以概率占据周围的邻近空斑块, 则空斑块被周围易感染食饵个体所占据的概率[12, 14]为1-(1-), 其中,表示食饵繁殖后代的概率,N代表邻体斑块中被易感染个体所占据的数量, (1-)代表邻体斑块中易感染食饵个体未能成功侵占空斑块的概率; 同时, 假设寄生的传播能够导致已感染个体的繁殖率降低, 从而空斑块被周围已感染食饵个体占据的概率为1-(1-),表示寄生感染引起的已感染宿主的繁殖率降低比例(∈[0,1]),N代表邻体中被已感染个体占据的斑块数量, (1-)代表邻体斑块中已感染食饵个体未能成功侵占空斑块的概率。本文考虑寄生感染是接触性传播的, 因此采用经典的SIR模型来描述。那么, 易感染个体被周围已感染食饵传染疾病的概率为1-(1-), 其中表示疾病感染的概率, (1-)代表邻体斑块中已感染食饵个体未能成功感染易感染食饵的概率。假设寄生病毒也存在一定的恢复率, 记已感染食饵恢复健康的概率为。另外, 假设捕食者个体通过捕食食饵个体进行繁殖, 其捕获易感染食饵的概率为, 则易感染食饵的斑块将以概率1-(1-)被捕食者个体所占据。其中,N代表邻体中被捕食者个体占据的斑块数量。我们引入参数(∈[0,2])来表示寄生特征调节的间接效应[17], 即寄生的特征调节提高(∈[1,2])或者减弱(∈[0,1])已感染食饵被捕获的概率。因此, 已感染食饵被周围邻体中捕食者个体所占据的概率为1-(1-), 其中,1。同时, 假设捕食者在空间网络中对食饵选择的转换概率为, 其含义为即使目前空间网络中捕食者个体与已感染的食饵个体之间存在连接, 但是捕食者个体将以概率选择逃避已感染个体, 将捕食转向易感染个体[10]。最后, 假设食饵个体的死亡率为d, 寄生感染的额外致死率为, 捕食个体的死亡概率为d。
2 模拟结果及分析
首先, 我们给出了四种空间网络结构下, 特征调节的间接效应(偏好参数)与寄生调节的宿主种群繁殖率参数()对疾病流行率与捕食者数量的影响。模型中偏好参数以及繁殖率下降参数作为寄生调节强度的刻画指标, 具有重要的生态学意义, 偏好由小到大以及繁殖率调控因子由大到小的变化趋势反映了寄生对宿主的调节能力由弱变强的关系。模拟结果显示, 疾病的流行率(), 即已感染食饵的种群数量在食饵种群中所占据的比例, 随着参数的增加呈现递减趋势, 而捕食者所占据的斑块比例()随着捕食偏好的增加呈现明显的递增趋势(图2), 并且这一结果不依赖于网络结构。同时, 四种空间网络结构下, 寄生调节的宿主繁殖率调控因子()的增加有利于捕食者数量的提高, 对于疾病的流行起到抑制作用, 但是影响较为微弱。通过对比不同网络结构的模拟结果, 我们发现随着网络异质性的增加, 即从规则网格(图2A)到小世界网络(图2B)再到随机网络(图2C)最后到无标度网络(图2D)的过程中, 捕食者的灭绝区域呈现减弱的趋势, 而疾病的流行率呈现数值上的下降趋势。尤其对于无标度网络来讲, 结果显示捕食者种群能够在整个参数空间上达到续存。该结果揭示了不同网络结构下捕食者的数量均与疾病的流行率呈现负相关性。

图1 四种不同网络结构的示意图 (每个网络结构均含有100个节点)
Figure 1 Four different spatial networks used in this study (each network has 100 nodes)
其次, 捕食者捕食资源的转换概率是适应性网络的重要指标, 其由小到大的变化趋势反映了捕食者种群逃避已感染食饵的行为变化。本文给出不同网络结构下, 转换概率对疾病流行的影响(图3)。模拟结果显示, 捕食者个体逃避已感染食饵个体, 继而转换到易感染食饵个体的行为转变促使已感染食饵的占据频率增加, 即捕食者转换概率的增加在一定范围内将增强疾病的流行。同时更加清晰地可以看出, 网络的异质性将导致疾病在不同网络结构上的流行之间存在显著的差异, 同质性网络有利于疾病的传播, 而异质性网络对疾病的传播有阻滞作用, 其中无标度网络结构尤为显著(图3)。图3中虚线表示捕食的转换概率达到一定数值时, 捕食者将出现灭绝, 而对于异质性较高的网络, 捕食者种群续存的参数空间较大, 这一结果与图2一致。
最后, 基于异质性最高的无标度网络结构, 我们针对不同物种研究了斑块发生率这一局部特征, 即考虑整个模拟时间步长内, 局部的生境斑块被某种种群个体所占据的时间比例。图4给出不同程度的捕食转换以及食饵偏好行为下, 易感宿主、已感染宿主以及捕食者的斑块发生率随着该斑块节点度的变化动态。首先, 对于易感染食饵, 随着斑块节点度的增加, 易感染宿主的发生率急剧下降, 最后保持稳定(图4A)。其次, 已感染宿主的斑块发生率随着网络节点度的增加而呈现先增加后下降的趋势, 并且更多的数据点集中在度较小的生境斑块上(图4B)。最后, 图4C显示捕食者种群的斑块发生率随着网络节点度的增加呈明显上升趋势, 直至最后趋于稳定的饱和状态。同时, 模拟结果也给出转换概率()的增加, 将显著引起已感染宿主的斑块发生率增加, 而捕食者的斑块发生率减弱(图4B, C)。但是, 随着捕食者对已感染宿主偏好()的增加, 已感染食饵和捕食者的斑块发生率的变化趋势与转换概率增加带来的影响截然相反(图4)。
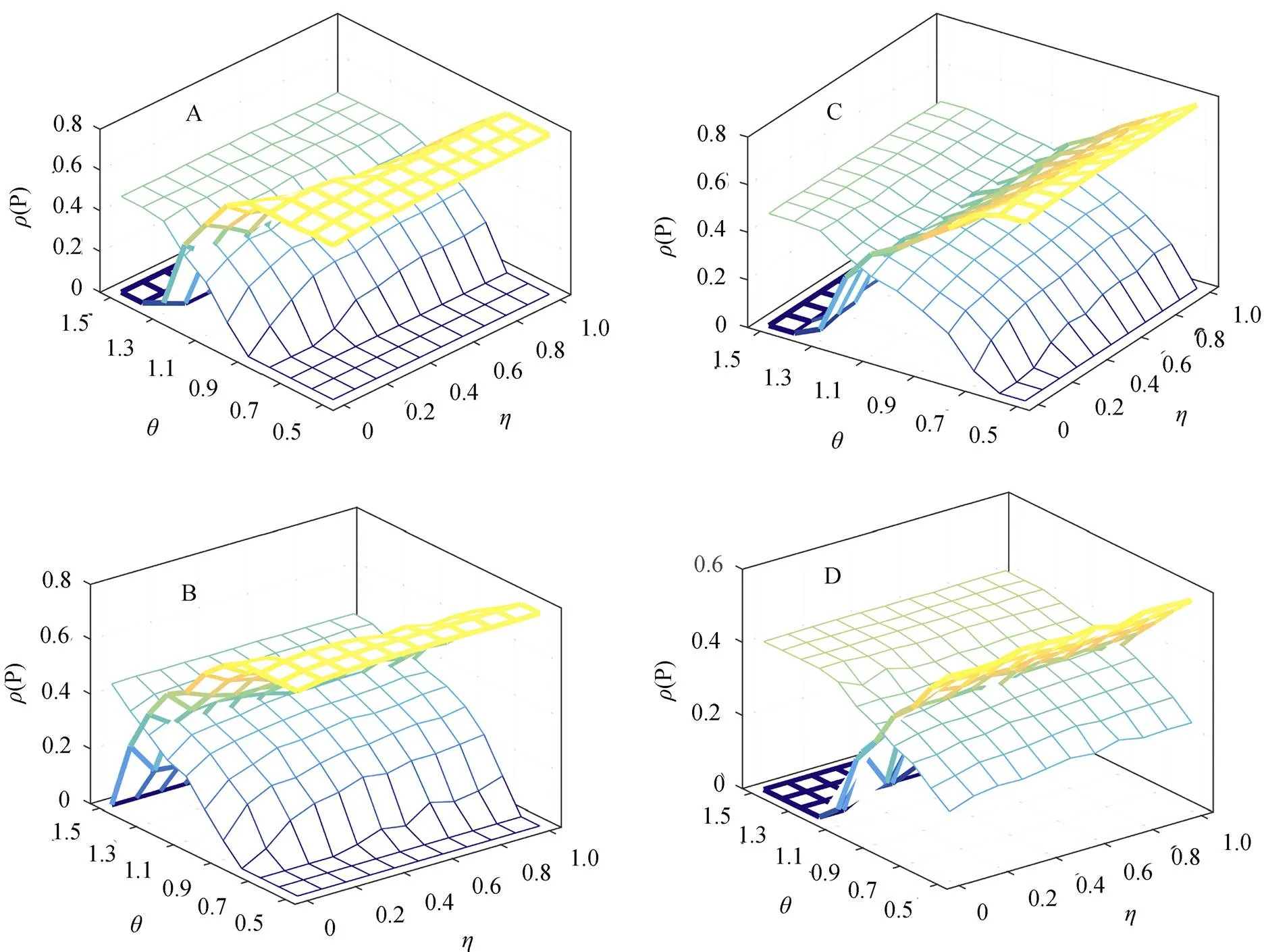
图2 捕食者对已感染食饵的偏好以及寄生调节的宿主繁殖率对疾病流行(ρ)与捕食者数量(P)的影响 (A.规则网格, B.小世界网络, C.随机网络, D.无标度网络; 粗线条曲面代表疾病流行, 细线条曲面代表捕食者的数量变化, 参数如下: r=0.8, β=0.4,λ=0.15, ω=0.175, ds=0.05, dp=0.15, γ=0.1, α=0.05)
Figure 2 Effects of predator preference and parasite-mediated reproduction rate on disease prevalence and predator abundance (A. regular network, B. small world network, C. random network, D. scale-free network)

图3 不同网络结构下, 疾病流行率(ρ)随着捕食者的转变概率(ω)的变化 (参数如下: θ=1.2, η=1, 其余参数同图2)
Figure 3 Effects of switch probability () on disease prevalence () at equilibrium under four different network structures
3 讨论与结论
本文通过探讨四种不同网络结构下, 寄生特征调节的食饵偏好、食饵繁殖率下降以及捕食者对食饵资源的捕食转换等行为特征的变化来研究种群行为对疾病空间传播动态的影响。本文得到的重要结论之一, 即针对不同的异质性网络结构, 在寄生调节的种群行为影响下疾病的流行率与捕食者的数量具有很强的负相关性(图2)。这一结果与有关捕食者可作为生物群落中疾病控制的重要生物因素是一致的[13, 18–19]。Packer等[18]通过广食性和专食性捕食者对生物群落中寄生感染的影响阐述了捕食者丰富度的下降将减少食饵种群中易感染者的丰富度, 降低整个食饵种群的大小, 从而提高寄生感染的流行率。另外, 空间网络的拓扑结构的差异性虽然在趋势上没有干扰种群行为对寄生传播动态的影响, 但仍然从不同程度上对这一结果产生了影响。其中, 模拟结果揭示网络结构异质性的增加将显著降低疾病的流行概率, 抑制了疾病的传播(图3)。网络异质性的增加, 节点度的不均匀性越明显, 越不利于感染的局部相互作用发生, 从而导致疾病的空间传播受到阻碍, 此结果与先前关于经典的SI模型研究的结果一致[8]。
空间网络中, 物种的斑块发生率能够很好地刻画出空间生境中局部相互作用发生的频率[12]。网络节点的度越高, 越有利于局部的捕食与感染相互作用的发生。对于易感染食饵, 节点度的增加既增强了捕食概率也提高了感染风险, 因此其斑块发生率随着节点度的增加迅速下降(图4A)。但是, 节点度的增加对已感染食饵带来了正负两种作用。节点度的增加一方面有利于已感染食饵具有更大的概率接触周围易感染食饵个体, 但是同时随之而来的高捕食风险, 因此, 两者之间的权衡(trade-off)导致了已感染食饵的斑块发生率随着度的增加呈现先增加后减弱的抛物线型趋势(图4B)。对于捕食者种群, 节点度的增加有利于捕食概率的提升, 那么其斑块发生率随着节点度的增加呈现递增趋势(图4C)。各物种的斑块发生率也揭示出疾病在空间网络上的传播受到种群行为以及网络拓扑结构的共同影响。
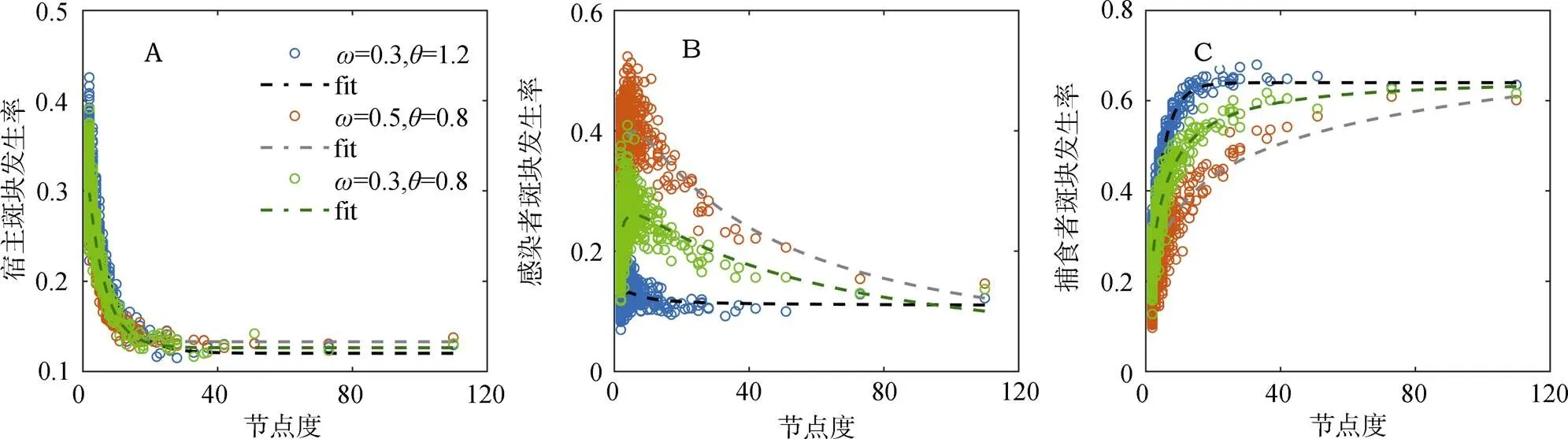
图4 无标度网络结构下易感染宿主(A), 已感染宿主(B)以及捕食者(C)的斑块发生率随着网络节点度的变化 (斑块发生率代表模拟的时间步长内, 斑块被易感染食饵、已感染食饵或者捕食者个体占据的时间步长比例; 参数同图2)
Figure 4 Relationship between node degree and patch incidence of susceptible prey (A), infected prey (B) and predator (C) under scale-free networks (Incidence is calculated as the proportion of time steps that a patch is occupied by susceptible prey, infected prey or predator along the dynamics)
不仅空间网络结构上捕食行为的转换或者食饵偏好的改变引起重视, 适应性网络上的物种个体重连或者种间相互作用的重连也备受关注[8, 10, 20–21]。Gross等人[8]研究了易感染个体通过个体的重连行为来逃避感染, 降低感染风险。物种个体的重连将导致网络的拓扑结构发生改变, 从而影响疾病的空间传播动态及动力学行为。例如, Zhang等人[10]构造了适应性网络结构上, 易感染宿主通过断开与已感染个体的连接而重新随机的选择一个易感染个体进行重连的行为来抑制疾病的传播, 同时重连的行为也产生了双稳、瞬时动态等动力学行为上的改变。而本文的工作是保持网络拓扑结构不变的情形下, 通过捕食种群对食饵资源的转换概率来调控疾病的空间动态。同时, 有关生态网络上的适应性重连(Adaptive rewiring)的相关研究不断地涌现, 即考虑生物群落中因资源物种灭绝等原因导致消费者种群改变其捕食行为的转变[20–21]。捕食者种群偏好的资源灭绝以后, 捕食者为了生存将改变其食饵偏好, 那么势必会改变对续存的其他资源物种的偏好程度, 从而影响网络结构的相互作用关系[20]。宿主种群在自然界中不是单独生存的, 而是处在复杂的食物网中, 物种的适应性重连在不同程度上将影响生物群落的相互作用关系, 那么从而将影响疾病的传播动态。因此, 生物群落网络构成的适应性改变这一问题值得我们后续进行深入的研究。
[1] MOORE J. Parasites and the Behaviour of Animals[M]. Oxford University Press, 2009.
[2] TANSKY M. Switching effects in prey-predator system[J]. Journal of Theoretical Biology, 1978, 70: 263–271.
[3] LAFFERTY K D. Foraging on prey that are modified by parasites[J]. The American Naturalist, 1992, 140: 854–867.
[4] DUNN AM, TORCHIN ME, HATCHER MJ, et al. Indirect effects of parasites in invasions[J]. Functional Ecology, 2012, 26: 1262–1274.
[5] CHATTOPADHYAY J, BAIRAGI N. Pelicans at risk in Salton Sea-an eco-epidemiological model[J]. Ecological Modelling, 2001, 136: 103–112.
[6] MUKHOPADHYAY B, BHATTACHARYYA R, Role of predator switching in an eco-epidemiological model with disease in the prey[J]. Ecological Modelling, 2009, 220: 931–939.
[7] HOLLING C S. Principles of insect predation[J]. Annual Review of Entomology, 1961, 6: 163–182.
[8] GROSS T, D’LIMA C J D, BLASIUS B. Epidemic dynamics on an adaptive network[J]. Physical Review Letters, 2006, 96: 208701.
[9] SHAW L B, SCHWARTZ I B. Fluctuating epidemics on adaptive networks[J]. Physical Review E, 2008, 77: 066101.
[10] ZHANG X G, SHAN C H, JIN Z, et al. Complex dynamics of epidemic models on adaptive Networks[J]. Journal of Differential Equations, 2019, 266: 803–832.
[11] MAY R M, LLOYD A L. Infection dynamics on scale-free networks[J]. Physical Review E, 2001, 64: 066112.
[12] GILARRANZ L J, BASCOMPTE J. Spatial network structure and metapopulation persistence[J]. Journal of theoretical Biology, 2012, 297: 11–16.
[13] SU M, HUI C. The effect of predation on the prevalence and aggregation of pathogens in prey[J]. BioSystems, 2011, 105: 300–306.
[14] SU M, HUI C, ZHANG Y Y et al. How does the spatial structure of habitat loss affect the eco-epidemic dynamics?[J]. Ecological Modelling, 2009, 220: 51–59.
[15] BOOTS M, SASAKI A. The evolutionary dynamics of local infection and global reproduction in host–parasite interactions[J]. Ecology Letters, 2000, 3: 181–185.
[16] BARABASI A L, ALBERT R. Emergence of scaling in random networks[J]. Science, 1999, 286: 509–512.
[17] HATCHER M J, DICK J T A, DUNN A M. Parasites that change predator or prey behaviour can have keystone effects on community composition[J]. Biology Letters, 2014, 10: 20130879.
[18] PACKER C, HOLT R D, HUDSON P J, et al. Keeping the herds healthy and alert: implications of predator control for infectious disease[J]. Ecology Letters, 2003, 6: 797–802.
[19] Flick A J, Acevedo M A, Elderd B D. The negative effects of pathogen-infected prey on predators: a meta-analysis[J]. Oikos, 2016, 125: 1554–1560.
[20] GILLJAM D, CURTSDOTTER A, EBENMAN B. Adaptive rewiring aggravates the effects of species loss in ecosystems[J]. Nature Communications, 2015, 6: 8412.
[21] BARTLEY T, MCCANN K S, BIEG C, et al. Food web rewiring in a changing world[J]. Nature Ecology & Evolution, 2019, 3: 345–354.
Effects of species behavior on the spatial dynamics of epidemic transmission
SU Min*, ZHENG Tong, SUN Yanhui
School of Mathematics, Hefei University of Technology, Hefei 230601, China
Network structure and population behavior are two important factors affecting host dynamics and thus entail profound effects on spatial transmission of disease. Through the individual-based model, we here present a spatial model of a predator-prey/host-parasite system on four complex networks. Population behaviors are indicated by trait-mediated indirect effect on predator’s prey preference, parasite-induced reduction in reproduction rate and predator switching. Predator individuals can avoid infected ones and choose other susceptible host by switching effects. The significant difference of the four networks is their topological structures and heterogeneity. Results have shown that the spatial transmission of parasite on complex networks depends obviously on both the predator’s preypreference and predator switching. And parasite prevalence is always negatively correlated with predator abundance under the four various network structures. The result is consistent with previous studies and indicates that the enhanced predation pressure can impede the disease transmission. But parasite-induced reduction in reproduction rate has weak effects on the parasite prevalence and predator abundance. Meanwhile, the heterogeneity in network topological structures also influences the disease prevalence significantly. Parasite prevalence declines generally with the heterogeneity of the network, with scale-free networks having the lowest prevalence. Finally, we explore the mechanisms underlying such results by relating a node’s incidence with its degree. Because there are trade-offs between local infection and the predation interaction, the patch incidence of infected host increases firstly and then declines with its node’s degree. Thiswork reveals that parasite transmission depends on both population behavior and the topology of networks. Therefore, the two factors can provide as the ecological strategy for controlling disease transmission.
network structure; trait-mediated effect; predator switching; prey preference; individual-based model
苏敏, 郑童, 孙艳辉. 种群行为对疾病空间传播动态的影响[J]. 生态科学, 2023, 42(1): 181–186.
SU Min, ZHENG Tong, SUN Yanhui. Effects of species behavior on the spatial dynamics of epidemic transmission[J]. Ecological Science, 2023, 42(1): 181–186.
10.14108/j.cnki.1008-8873.2023.01.021
Q141
A
1008-8873(2023)01-181-06
2020-11-19;
2020-12-22
国家自然科学基金项目(31770470)
苏敏(1982—), 女, 安徽淮北人, 博士, 教授, 主要从事数学生态学研究, E-mail: sum04@163.com
苏敏
