骨外尤文肉瘤/原始神经外胚层肿瘤的18F-FDG PET/CT表现
2023-02-21彭静许莎莎杜彪张丽霞韩星敏
彭静,许莎莎,杜彪,张丽霞*,韩星敏*
1.浙江中医药大学附属第一医院(浙江省中医院)核医学科,浙江 杭州 310006;2.郑州大学第一附属医院核医学科,河南省分子影像医学重点实验室,河南 郑州 450052;*通信作者 张丽霞 353826107@qq.com;韩星敏 xmhan@zzu.edu.cn
外周原始神经外胚层肿瘤与尤文肉瘤同属尤文肉瘤家族,2016年WHO中枢神经系统肿瘤分类将两者归类为间质性肿瘤中外周软组织的尤文肉瘤/外周原始神经外胚层肿瘤(Ewing's sarcoma/peripheral primitive neuroectodermal tumor,ES/pPNET)[1]。本病罕见且高度恶性,好发于青少年,多见于四肢长骨和全身软组织,较少发生于肾脏、肺等器官。ES/pPNET临床表现不典型,但进展非常迅速,患者察觉不适时多已发生转移。而在常规影像学检查中,本病并无显著特征,难与其他软组织肿瘤鉴别,极易被误诊和延误治疗。18F-FDG PET/CT显像通过一次检查可探测全身病灶情况,并可对肿瘤生长及代谢情况进行定性及半定量分析,为指导活检,实现早诊断、早分期、早治疗提供可靠的依据[2-3],但目前对于18F-FDG PET/CT的ES/pPNET相关研究仍较少。本研究拟分析ES/pPNET的临床及18F-FDG PET/CT表现,为临床提供参考,以期更好地认识本病。
1 资料与方法
1.1 研究对象 回顾性收集2011年1月—2021年3月于郑州大学第一附属医院经病理确诊的ES/pPNET。纳入标准:①于本院进行病理诊断,并在治疗前进行18FFDG PET/CT检查;②临床及影像资料完整。排除病理诊断结果存疑者。共13例患者纳入研究,对所有患者进行随访,记录治疗及预后情况。所有患者均于检查前签署检查及相关资料用于科研的知情同意书。
1.218F-FDG PET/CT检查 患者空腹6 h以上,检查前测量血糖(空腹血糖<11.1 mmol/L),根据成人体重静脉注射18F-FDG 3.70~5.55 MBq/kg,于安静环境中坐位或卧位休息60 min后进行图像采集,采集范围从颅顶至股骨中上段,并根据病灶部位调整。由2名核医学科主治医师和副主任医师进行阅片,先对图像进行视觉定性分析,再用计算机软件勾画病灶感兴趣区进行半定量分析,获得最大标准化摄取值(SUVmax)。
1.3 病理诊断 由2名主治及副主任病理科医师做出诊断,主要观察CD99、CD56、CD34、S-100、突触素(Syn)、Ki-67、神经元特异性烯醇化酶(NSE)、波形蛋白等。其中7例用荧光原位杂交技术行EWSR1基因断裂重组检测。
1.4 统计学分析 使用SPSS 25.0软件,计量资料以±s表示,计数资料以例数或百分比表示;使用Mann-WhitneyU检验分析转移灶与原发灶SUVmax差异是否有统计学意义;使用Pearson相关分析研究SUVmax与Ki-67的相关性;使用Cox回归分析影响预后的相关因素。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 13例患者中,女5例,男8例,年龄4~59岁,平均(22.5±19.9)岁。患者初诊时,1例原发于肺部、2例原发于盆腔患者无肉眼可见肿块,10例肉眼可见原发部位肿块。出现疼痛症状8例,无症状1例,该患者为体检中发现肺部病灶。确诊时发生淋巴结转移6例,肺转移1例。13例患者中4例失访,2例仅手术治疗者死亡,最短生存期为10个月,7例至随访时间仍存活,见表1。
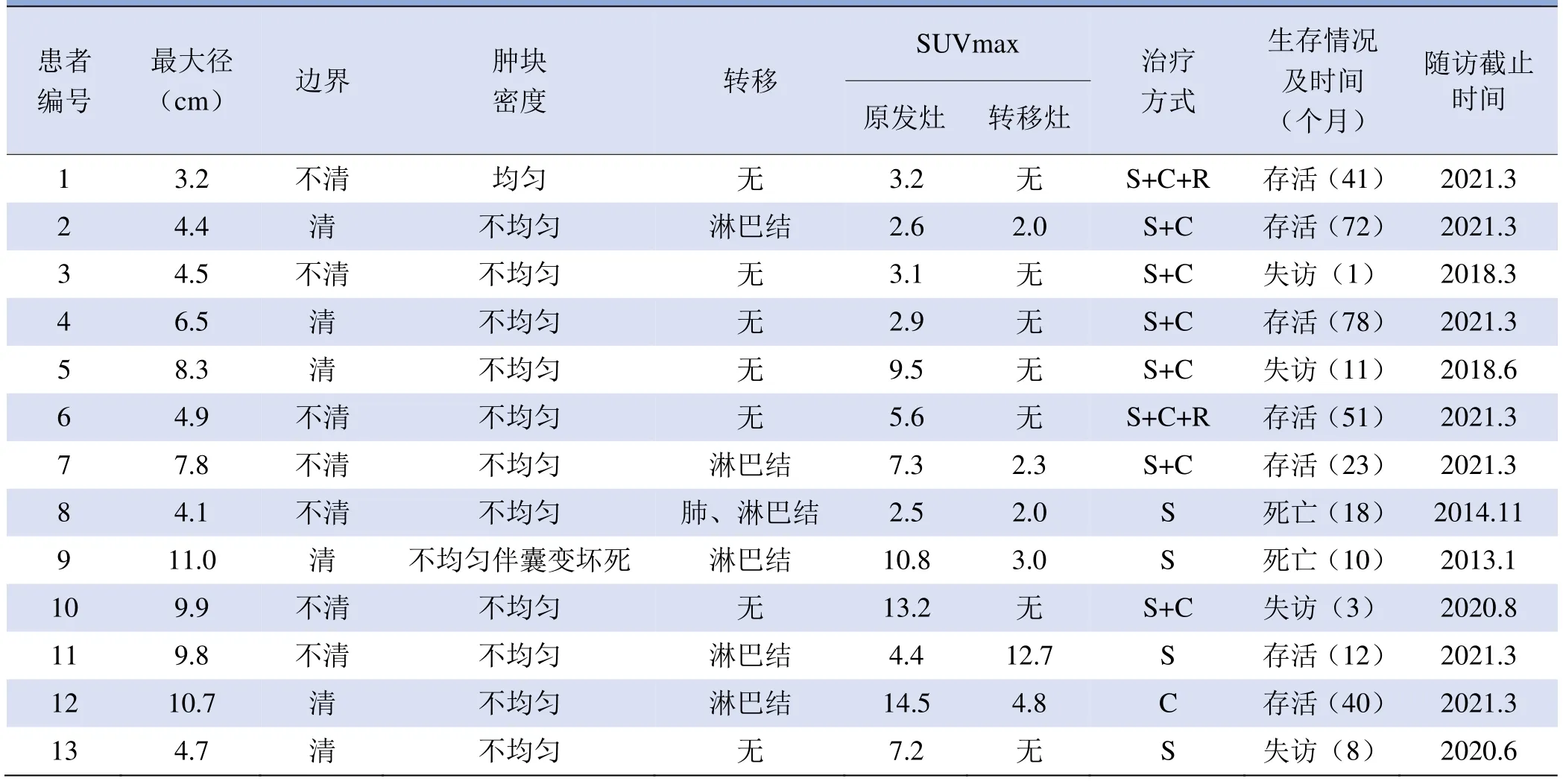
表1 13例尤文肉瘤/外周原始神经外胚层肿瘤患者18F-FDG PET/CT影像特点及预后情况
2.218F-FDG PET/CT显像结果 13例原发灶为边界清楚或不清的软组织肿块(边界清6例,边界不清7例,图1A、B),内部呈等或稍低密度,多为不均匀(12例内部密度不均匀,1例密度均匀),2例腹腔较大肿块内部见囊变及坏死,未见钙化(图1A)。肿块大小不等,最大径为3.2~11.0 cm,平均(6.9±2.8)cm。原发及转移灶均不同程度摄取显像剂增多,SUVmax为2.0~14.5。6例转移均有区域淋巴结转移,其中1例发生肺转移,见图1C、D。转移病例中5例原发灶SUVmax大于转移灶,1例右上肢原发者转移灶SUVmax(12.7)明显高于原发灶(4.4)。13例中,原发与转移灶SUVmax差异无统计学意义(Z=−1.283,P=0.199)。患者治疗、生存情况、SUVmax见表1。SUVmax与Ki-67无显著相关性(r=0.376,P=0.205)。13例中肿瘤最大径、边界是否清晰、有无转移、原发灶SUVmax、治疗方式以及Ki-67是否单一均非预后的影响因素(P=0.750、0.727、0.966、0.408、0.489、0.416)。

图1 ES/pPNET患者18F-FDG PET/CT显像图。A.女,15岁,左肾上腺区ES/pPNET,肿块最大径约9.9 cm(箭),边界欠清,内部密度不均匀并囊性低密度区,显像剂摄取不均匀,SUVmax约13.2,未见转移;B.女,58岁,右下肢ES/pPNET,肿块最大径约4.7 cm(箭),边界清,密度均匀,较均匀摄取显像剂,SUVmax约7.2,未见转移;C.女,4岁,右侧骶前ES/pPNET,PET/CT见边界不清、密度均匀的软组织肿物(箭),伴邻近骨质破坏,最大径约4.1 cm,SUVmax约2.5,肺部转移灶SUVmax约2.0(箭头);D.男,12岁,左髂部ES/pPNET,PET/CT见边界不清、密度欠均匀的软组织肿物(箭),伴邻近骨质破坏,最大径约7.8 cm,SUVmax约7.3,髂血管旁淋巴结转移灶SUVmax约2.3(箭头)
2.3 病理及免疫组化 13例病理镜下均见小圆形肿瘤细胞呈弥漫性密集排列,多由纤维间隔分成条片状,胞质嗜酸量少,核大深染、核分裂象易见,见图2。CD99均弥漫(+)(图3A),Ki-67不同程度(+)(图3B)。4例NSE(+),7例syn(+),7例EWSR1基因检测(+)。
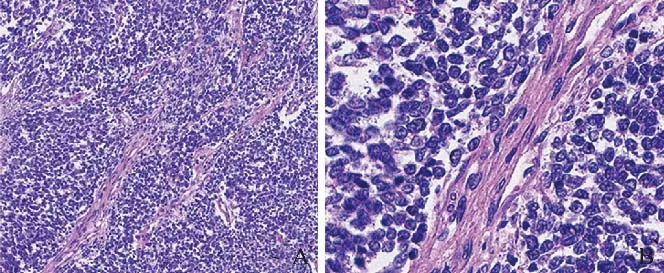
图2 女,15岁,左肾上腺ES/pPNET。A.病理镜下见大小形态一致的肿瘤细胞,呈条片状排列(HE,×10);B.病理镜下见小圆形肿瘤细胞,胞质少,核大而圆,核仁不明显,染色质均匀(HE,×40)

图3 男,16岁,左下ES/pPNET。En Vision两步法染色(×20)分别见CD99弥漫(+,A);B.Ki-67(40%+)(B)
3 讨论
3.1 ES/pPNET的临床特点 1973年,Hart等[4]报道首例发生于儿童脑部的原始神经外胚层肿瘤(primitive neuroectodermal tumor,PNET),本病较罕见,目前多为个案报道。分子遗传学研究证明尤文肉瘤与pPNET均起源于神经嵴胚胎细胞,因存在t(11;22)(q24;q12)染色体异位而形成EWS/FLI1嵌合基因,因此WHO神经系统肿瘤分类中将两者归为间质性肿瘤中的ES/pPNET。2016年中枢神经系统肿瘤分型删除了中枢型PNET的概念,但临床仍在沿用[1]。中枢和外周PNET主要以起源作区分,pPNET源于胚胎时期的神经嵴,中枢PNET源自脊髓及小脑幕上脑组织的原始神经上皮。
有研究报道ES/pPNET多发于腹盆部,其次是胸肺区域[5],好发人群为青年,但各年龄段均可发生,不同研究总结的中位年龄差别不大,冯瑶杰等[6]报道12例骨外ES/pPNET患者中位年龄为33.5岁。本研究患者中位年龄为22.5岁,发病部位中腹盆最多(4例),其次为四肢软组织(3例),与既往研究结果基本一致。
ES/pPNET的临床表现无特异性,不同发病部位表现各异,如腮腺ES/pPNET表现为疼痛、局部肿块[7],肾脏则以腰背部疼痛、血尿为主[8],胸壁ES/pPNET又称Askin瘤,较少见,多发于单侧胸壁,并易累及肋骨和胸膜,主要表现为胸壁肿块伴疼痛[9]。本组病例均表现为软组织肿块,其中4例有局部疼痛,1例Askin瘤侵犯肋骨及胸膜致类似带状疱疹样疼痛。总之,ES/pPNET临床表现不典型,难以为诊断提供依据,需要影像、病理辅助诊断。
既往研究表明,本病预后较差。一项针对20例PNET患者的研究发现2年生存率仅为35%[10]。李珂[5]对56例PNET分析发现3年生存率仅为14.29%,肿瘤部位、大小和手术切除程度是影响总生存期的独立因素。本研究中初诊时7例发生转移,随访中4例失访,2例死亡,生存期分仅别为10个月、18个月。因此,需要较有效的检查手段提供诊断、分期指导,以提高早期检出率,并改善预后。
3.218F-FDG PET/CT显像 Sharma等[11]报道18FFDG PET/CT显像用于1例卵巢PNET的分期及治疗反应评估并起到重要指导作用。Shen等[12]报道1例以盆腔肿块为首发症状的患者,经18F-FDG检查发现原发病灶位于精囊,还检测出淋巴结转移灶,证实18F-FDG对ES/pPNET分期及治疗方式选择有重要意义。另一项前瞻性研究纳入66例ES/pPNET,18F-FDG PET/CT、MRI、全身骨显像检测骨转移的敏感度、特异度、阳性及阴性预测值均无显著差异,其中18F-FDG PET/CT的敏感度为88%,特异度为100%[13]。除分期及治疗方面的指导意义外,有研究认为18F-FDG PET/CT显像对PNET的预后也有一定预测价值,一项针对48例治疗后患者的研究指出,18F-FDG PET/CT显像中表现为病灶摄取程度较高或复发的预后显著较差[3]。有研究认为18F-FDG PET/CT显像中病灶摄取FDG程度与病理指标Ki-67均反映肿瘤的生长增殖情况,两者可能具有相关性[14],但目前此方面研究较少。
Ki-67为揭示肿瘤增殖指数的病理指标,SUVmax亦在一定程度上提示肿瘤代谢及生长活跃程度。本研究中原发及转移病灶均不同程度摄取18F-FDG,SUVmax为2.0~14.5,但原发灶与转移灶SUVmax无显著差异,SUVmax与Ki-67无显著相关性,SUVmax、Ki-67并非预后的影响因素。笔者认为,一方面因本研究病例数量较少,另外本研究为回顾性分析,时间跨度较大、治疗水平差异等因素对结果的影响亦无法避免。但PET/CT能够敏感地检测出原发及转移灶,并可反映病灶生长代谢情况,对分期及指导治疗具有重要意义。
关于ES/pPNET的结构影像,罗显丽等[15]报道20例pPNET,多为单发、内部不均匀、等或稍低密度肿块,部分肿块较大者内部可见坏死、囊变,钙化少见。刘显旺等[16]报道4例腹部PNET表现类似。本研究13例ES/pPNET中12例单发,仅1例为腹腔多发,2例腹腔较大肿块内部发生坏死、囊变。12例内部密度不均匀。可能因腹腔内较少受到限制,肿块多生长较大,内部因血供不足易坏死、囊变。
3.3 病理 骨外ES/pPNET多为类圆形肿块,切面呈灰白灰褐色,不规则分叶或结节状。镜下可见弥漫或片状分布的小圆瘤细胞,形态较一致,胞质少,核大深染,可排列成荷马-赖特花环,又称假菊团状结构[17]。免疫组化部分神经内分泌抗体(+),如NSE、cgA、Syn、波形蛋白等。CD99系MIc2基因产物,是较特异的抗体[18-19],并非所有ES/pPNET均表达CD99,但检测CD99可提高诊断率[20]。因90%的ES/pPNET会发生t(11;22)(q24;q12)染色体易位而形成EWS/FLI1融合基因,故将该基因检测作为诊断的生物标志物[18]。本研究中ES/pPNET切面为灰白或灰黄多结节状,镜下均见典型的小圆瘤细胞,被纤维间隔分隔为片状或条索状,均多项神经内分泌抗体(+),12例CD99(+),7例EWSR1基因阳性。病理诊断一方面依据镜下小圆细胞特点,另一方面免疫组化联合CD99及神经内分泌阳性抗体,EWS/FLI1基因检测是更为准确的诊断依据,但因价格昂贵使其早期应用受限,而近年来检测逐渐增多。
3.4 研究的局限性 首先,本研究为小队列研究,病例数量较少。其次,本研究为回顾性研究,时间跨度较长,患者预后可能受医疗水平及患者依从性等影响。后续需开展更大样本前瞻性研究获得更为细致、严谨的结论。
总之,ES/pPNET多发于腹盆腔及四肢,临床及影像表现不典型,且预后差,需要较为敏感的影像手段为临床医师诊断及治疗提供依据。18F-PDG PET/CT显像可全面检测出原发及全身转移病灶,对活检定位、分期及治疗均有重要价值。
