CKLF1-C19多肽影响口腔黏膜下纤维性变中MFB活化及对SFRP表达的影响*
2023-02-20李艳莉徐仰龙邓金勇何升腾董方
李艳莉 徐仰龙 邓金勇 何升腾 董方
(1.三亚中心医院口腔科,海南 三亚 572000;2.遵义医科大学附属口腔医院牙体牙髓科,贵州 遵义 563003;3.三亚市人民医院口腔科,海南 三亚 572000)
口腔黏膜下纤维性变(Oral submucous fibrosis,OSF)是亚洲国家常见的口腔癌前病变,由口腔黏膜结缔组织中异常的胶原蛋白沉积所引起,往往伴随组织纤维化,患者会出现口干、溃疡、烧灼刺痛感、口腔活动受损以及进行性张口受限等症状[1-3]。研究表明,7%~30%的OSF患者可能会转化为口腔癌,且随着OSF患者数量的增多,恶变风险也在逐渐升高[4]。OSF的病变组织内存在纤维化颊粘膜肌成纤维细胞(Myofibroblast,MFB),能够表达平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),具有较好的收缩性及胶原分泌能力,活化的MFB是导致纤维化过程中细胞外基质积累的关键致病细胞[5]。因此在OSF中以MFB为作用靶点抑制增殖、迁移及侵袭等生物学行为,逆转成纤维细胞向其分化,是OSF潜在的治疗策略。
人趋化素样因子(Chemokine-like factor 1,CKLF1)是趋化因子样因子蛋白家族的一员,作为CCR4 的功能配体,其在炎症和自身免疫性疾病中具有广谱的生物学功能。CKLF1 包含至少两个位于其C末端的分泌亚型,其中一种为CKLF1-C19多肽,简称C19,从果蝇S2细胞中稳定表达时所分泌,可作为CKLF1的拮抗剂在多种疾病中发挥抑制作用[6-7]。目前已有研究表明,C19对TGF-β诱导的肺成纤维细胞向肌成纤维细胞转化具有抑制作用,并能够抑制气道重塑和纤维化的发生[8]。本研究通过使用C19处理OSF患者MFB观察细胞活化的变化,并探讨C19影响OSF的分子机制。
1 资料与方法
1.1 一般资料 选取2020年1月~2021年1月在三亚中心医院口腔科门诊就诊并确诊为OSF的患者8例,其中男6例,女2例,年龄38~51岁,平均(40.95±3.98)岁,均有咀嚼槟榔习惯。选择同期体检的健康志愿者8例,其中男5例,女3例,年龄37~48岁,平均(39.75±3.66)岁,均无咀嚼槟榔、饮酒及吸烟等行为,且无口腔黏膜病变和其他急性或慢性炎症性疾病。本研究获得患者知情同意以及三亚中心医院伦理委员会审核批准。
1.2 主要试剂 CKLF1-C19多肽(中国疾病基因研究中心);胎牛血清(浙江天杭生物科技公司);DMEM培养基和胰蛋白酶(美国Hyclone公司);免疫荧光染色试剂盒和CCK-8试剂盒(上海翊圣生物科技公司);羟脯氨酸检测试剂盒(英国Abcam公司);Trizol(日本Takara公司);ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物公司);DAPI染液、Phallacidin染液和I型鼠尾胶原(北京索莱宝生物公司);Transwell小室、BCA蛋白测定试剂盒和结晶紫染液(上海碧云天生物研究所);Pierce ECL化学发光试剂液(上海索宝生物科技公司);鼠抗人α-SMA、sFRP1、sFRP2、sFRP5单克隆抗体以及兔抗人GAPDH单克隆抗体(英国Abcam公司);辣根过氧化物酶标记山羊抗鼠(北京中杉金桥公司)。
1.3 方法
1.3.1 FB和MFB分离、培养与鉴定 取两组颊部对应位置黏膜组织,采用组织块法分离培养原代细胞。用含抗菌素的PBS清洗黏膜组织3次,每次3 min,分离上皮下组织并剪成约1 mm3的小块,将小块放入培养瓶内,加入含10%胎牛血清的DMEM培养基,置于37℃、5%CO2的恒温箱中贴壁培养,当组织块周围有细胞生长,且融合达到80%左右时,0.25%胰蛋白酶消化传代,倒置显微镜观察细胞形态,选择第三代至第六代细胞用于实验。
1.3.2 免疫荧光染色 原代培养的细胞传至第5代时,进行细胞爬片,进行α-SMA和F-actin的免疫细胞荧光染色。细胞爬片后,4℃下以4%多聚甲醛固定30 min,蒸馏水冲洗干净,pH7.4的PBS处理5 min,0.1% Triton X-100继续作用5 min,再以5%BSA封闭20 min,PBS清洗干净后,在玻片上滴加鼠抗人α-SMA单克隆抗体和Phallacidin试剂液,室温避光染色20 min,PBS清洗干净,采用DAPI复染10 min,清洗后封片,通过扫描共焦显微镜观察染色情况。
1.3.3 细胞分组与处理 选择生长状态良好的第5代MFB,以1×104个细胞接种入96孔板,置于37℃、5%CO2的恒温箱过夜培养。实验分组设置为对照组、0.001 mg/L C19组、0.01mg/L C19组、0.1 mg/L C19组,对照组细胞正常培养,各浓度C19处理组分别加浓度为0.001、0.01、0.1 mg/L的CKLF1-C19多肽培养,48 h后收集细胞进行后续研究。
1.3.4 CCK-8法 将MFB按照1.3.3处理,结束后置于37℃、5%CO2的恒温箱内孵育,分别于24、48、72 h 时,加入10 μL CCK-8试剂液至待测细胞孔中,轻轻混匀,继续孵育4 h,通过全自动酶标仪测定450 nm 处各孔细胞的光密度(OD)值。
1.3.5 羟脯氨酸含量 测定收集处理后的各组MFB,4℃下以4000 rpm/min离心10 min,获取各组样本的上清,测定羟脯氨酸的含量,具体步骤严格根据试剂盒说明书进行。
1.3.6 胶原凝胶收缩实验 将Ⅰ型鼠尾胶原溶液配制成2 mg/mL的新鲜胶原混合液,收集处理后的各组MFB,胰蛋白酶消化后,使用无血清DMEM培养液重悬,并以2×105个/mL接种于胶原液中,混合后,取500 μL接种于24孔板中,置于37℃下孵育2 h,使细胞贴附于凝胶表面,进一步置于恒温箱内孵育48 h,观察胶原凝胶收缩情况,数码相机摄像,使用ImageJ软件分析胶原凝胶面积,测定培养后凝胶面积与凝胶初始面积的百分比。
1.3.7 细胞迁移与侵袭检测 使用带8 μm孔径的聚碳酸酯滤膜的24孔Transwell小室测定各组MFB的迁移和侵袭能力。在细胞侵袭测定中,滤膜涂基质胶以覆盖膜孔。在上室中加入100 μL含1×103个细胞的悬液,下室加入600 μL含10%胎牛血清的新鲜培养液。置于37℃、5%CO2恒温箱中孵育24 h,将其下表面在4%多聚甲醛中固定后,结晶紫染色,PBS清洗后封片,光学显微镜观察膜下细胞数目,计数5个不同视野取平均值。
1.3.8 实时荧光定量聚合酶链反应 各组MFB中加入适量Trizol,提取总RNA,分光光度计检测纯度与浓度。根据第一链cDNA合成试剂盒,将总RNA逆转录合成cDNA。再以cDNA为模板,通过荧光定量PCR系统进行扩增,检测各基因mRNA的表达水平,按照ChamQ Universal SYBR qPCR Master Mix试剂盒说明书进行。扩增条件如下:95℃ 30 s;95℃ 5 s、60℃ 10 s,40个循环;溶解曲线:95℃ 15 s;60℃ 60 s;95℃ 15 s。以GAPDH作为内参基因,使用2-ΔΔCt法来计算目的基因表达量,引物序列,见表1。

表1 基因引物序列Table 1 Gene primer sequence
1.3.9 Western blot检测 在各组MFB中加入RIPA溶液,置于冰上裂解30 min,4℃下以12000 r/min离心30 min,收集上清,BCA法测定蛋白质量。取等量蛋白样品,在制备的10%SDS-PAGE凝胶孔内上样,电泳分离,将分离的蛋白电转至PVDF膜,将膜放在5%脱脂奶粉中,室温封闭1 h,TBST洗膜,加入一抗工作液(1∶1000),4℃孵育过夜。次日,弃去原液,TBST充分洗膜后,加入对应二抗工作液(1∶5000),室温孵育1 h,利用Pierce ECL化学发光底物显影,凝胶系统成像,ImageJ软件分析蛋白条带的灰度值,以GAPDH作为内参蛋白。
2 结果
2.1 FB与MFB的鉴定结果 在倒置显微镜下可见培养的FB与MFB大多呈长梭形,胞体较大,胞核为卵圆形,MFB较FB更加饱满,体积增大,且形态较不规则,细胞增殖加快(见图1)。α-SMA和F-actin免疫荧光染色结果显示,从健康志愿者的颊黏膜组织中分离的FB,α-SMA染色为阴性,F-actin染色呈红色荧光,主要分布在细胞膜;从OSF患者的颊黏膜组织中分离的MFB,α-SMA染色呈绿色荧光,F-actin染色呈红色荧光,两者均在形成束状纤维结构分布于细胞质内。见图2。

图1 FB与MFB的形态观察(比例尺=20 μm)Figure 1 Observation of the morphology of FB and MFB
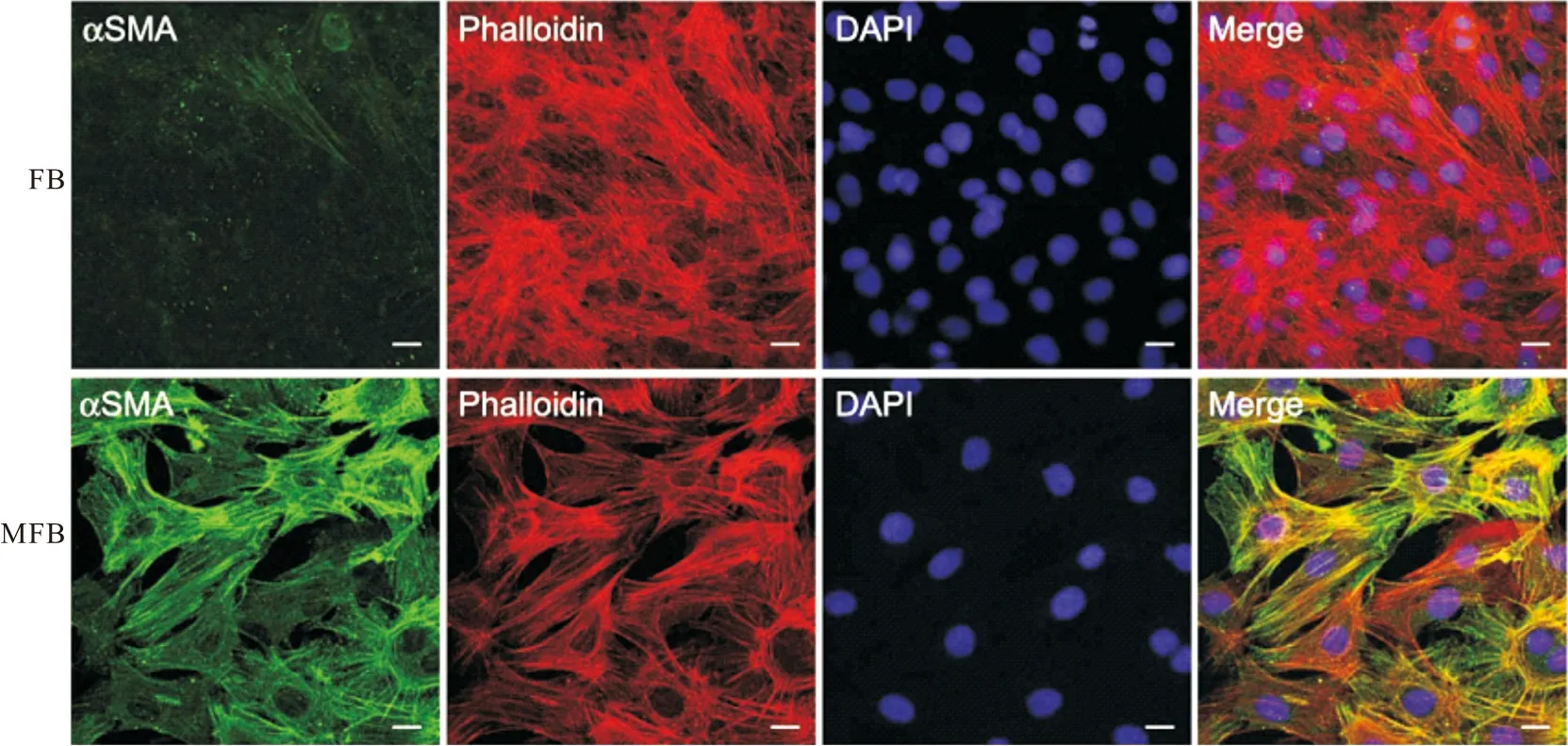
图2 FB与MFB内α-SMA和F-actin表达检测(免疫荧光染色,比例尺=20 μm)Figure 2 Detection of α-SMA and F-actin expression in FB and MFB
2.2 CKLF1-C19多肽对MFB增殖活性的影响 CCK-8检测结果显示,与对照组比较,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB,在培养48 h和72 h后,细胞增殖活性均显著降低(P<0.05),各剂量对细胞增殖活性的抑制作用呈剂量依赖性(P<0.05),见图3。
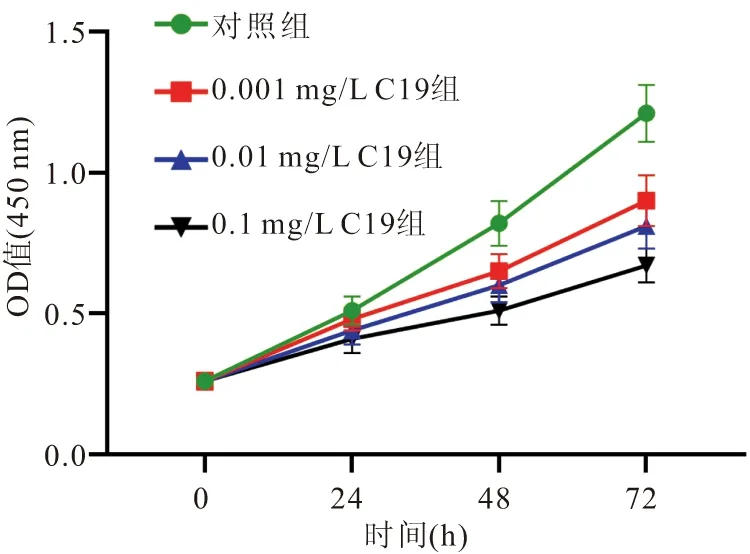
图3 各组MFB增殖活性比较Figure 3 Comparison of MFB proliferation activity in each group
2.3 CKLF1-C19多肽对MFB上清中羟脯氨酸含量的影响 各组MFB培养液上清中羟脯氨酸含量测定结果显示,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB上清中羟脯氨酸的含量均显著低于对照组MFB上清中羟脯氨酸的含量(P<0.05);与0.001 mg/L C19组比较,0.01 mg/L C19组与0.1 mg/L C19组细胞上清中羟脯氨酸的含量显著降低(P<0.05);与0.01 mg/L C19组比较,0.1 mg/L C19组细胞上清中羟脯氨酸的含量也显著降低(P<0.05),见图4。
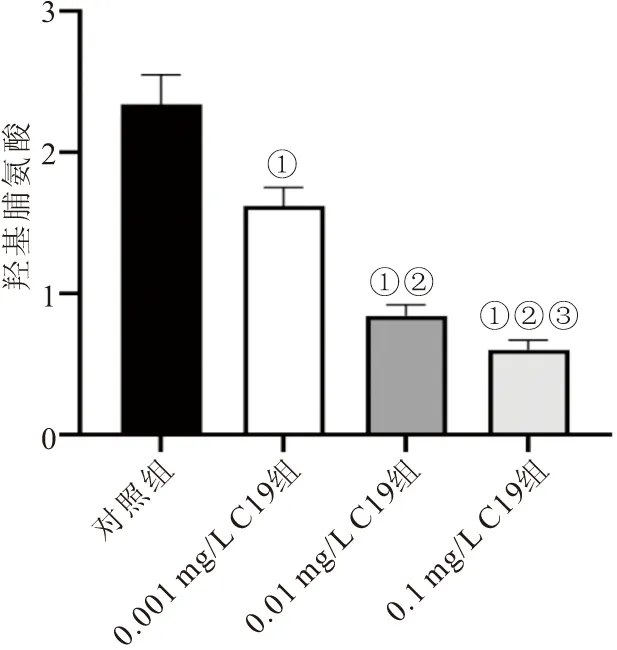
图4 各组MFB上清中羟脯氨酸含量比较Figure 4 Comparison of hydroxyproline content in MFB supernatant of each group注:与对照组比较,①P<0.05;与0.001 mg/L C19组比较,②P<0.05;与0.01 mg/L C19组比较,③P<0.05
2.4 CKLF1-C19多肽对MFB收缩活性的影响 胶原凝胶收缩实验结果显示,与对照组比较,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB与胶原混合培养后,胶原凝胶收缩面积比率均显著增加(P<0.05);与0.001 mg/L C19组比较,0.01 mg/L C19组与0.1 mg/L C19组胶原凝胶收缩面积比率显著增加(P<0.05);与0.01 mg/L C19组比较,0.1 mg/L C19组胶原凝胶收缩面积比率也显著增加(P<0.05)。见图5。

图5 各组MFB收缩活性比较 Figure 5 Comparison of MFB contractile activity in each group注:A.胶原凝胶收缩实验检测各组MFB胶原情况;B.各组MFB胶原凝胶收缩面积比率。与对照组比较,①P<0.05;与0.001 mg/L C19组比较,②P<0.05;与0.01 mg/L C19组比较,③P<0.05
2.5 CKLF1-C19多肽对MFB内分泌型卷曲相关蛋白表达的影响 qRT-PCR实验测定结果显示,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB内sFRP1和sFRP2的mRNA表达水平均较对照组显著上调(P<0.05);0.01 mg/L C19组与0.1 mg/L C19组中sFRP1和sFRP2的mRNA表达水平较0.001 mg/L C19组显著上调(P<0.05);与0.01 mg/L C19组比较,0.1 mg/L C19组sFRP1和sFRP2的mRNA表达水平进一步显著上调(P<0.05)。而不同浓度C19多肽处理下的sFRP5 mRNA表达水平与对照组sFRP5 mRNA表达水平之间差异均无统计学意义(P>0.05)(见图6)。Western blot检测结果也显示,与对照组比较,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB内sFRP1和sFRP2的蛋白表达水平均显著上调(P<0.05);与0.001 mg/L C19组比较,0.01 mg/L C19组与0.1 mg/L C19组中sFRP1和sFRP2的蛋白表达水平显著上调(P<0.05);与0.01 mg/L C19组比较,0.1 mg/L C19组sFRP1和sFRP2的蛋白表达水平进一步显著上调(P<0.05),而各组之间的sFRP5 蛋白表达水平的变化差异均无统计学意义(P>0.05)。见图7。

图6 各组MFB内sFRP1、sFRP2及sFRP5的mRNA表达水平比较Figure 6 Comparison of mRNA expression levels of sFRP1,sFRP2 and sFRP5 in each group of MFB注:与对照组比较,①P<0.05;与0.001 mg/L C19组比较,②P<0.05;与0.01 mg/L C19组比较,③P<0.05
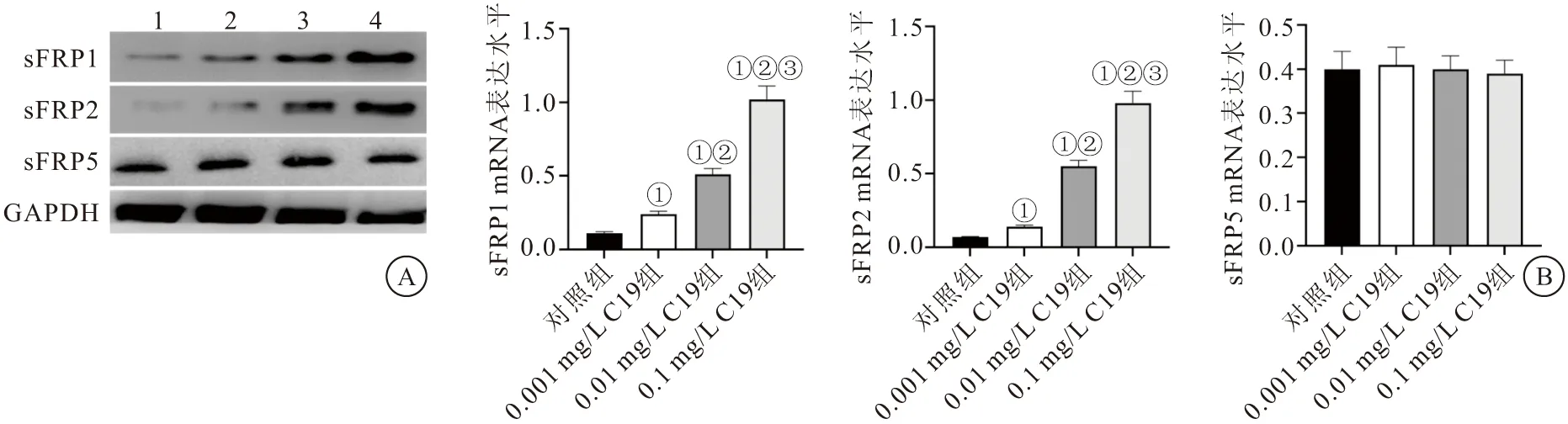
图7 各组MFB内sFRP1、sFRP2及sFRP5的蛋白表达水平比较Figure 7 Comparison of the protein expression levels of sFRP1,sFRP2 and sFRP5 in the MFB of each group注:A.Western blot检测各组MFB内sFRP1、sFRP1、sFRP5蛋白条带;B.各组MFB内sFRP1、sFRP2、sFRP5蛋白的表达水平。与对照组比较,①P<0.05;与0.001 mg/L C19组比较,②P<0.05;与0.01 mg/L C19组比较,③P<0.05
2.6 CKLF1-C19多肽对MFB迁移与侵袭的影响 Transwell实验测定结果显示,与对照组比较,经过0.001、0.01、0.1 mg/L的C19多肽处理的MFB,迁移细胞数目与侵袭细胞数目均显著减少(P<0.05);相较于0.001 mg/L C19组比较,0.01 mg/L C19组与0.1 mg/L C19组迁移细胞数目与侵袭细胞数目均显著减少(P<0.05);0.1 mg/L C19组迁移细胞数目与侵袭细胞数目均显著少于0.01 mg/L C19组(P<0.05)。见图8。
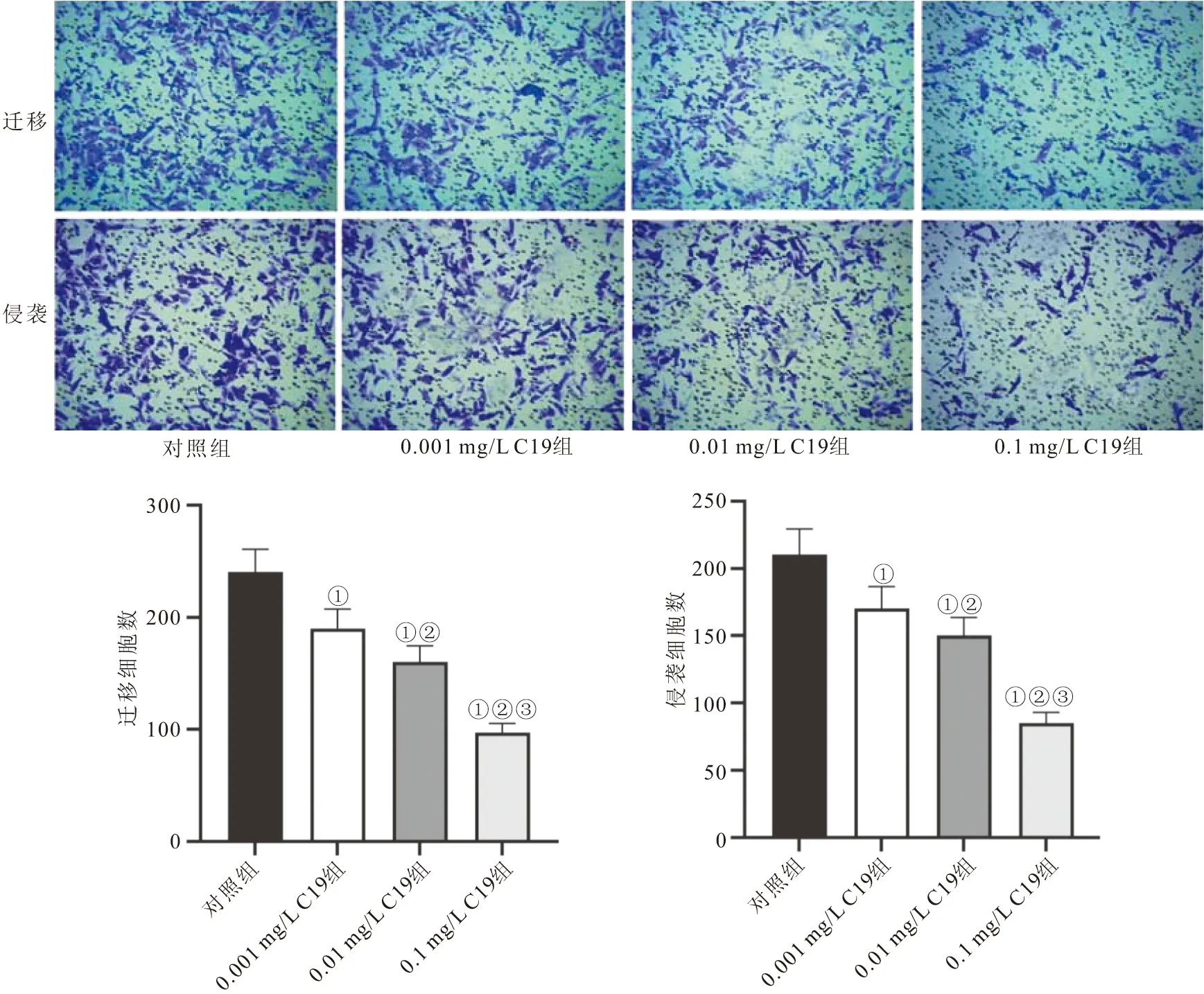
图8 各组MFB迁移与侵袭的数目比较 Figure 8 Comparison of the number of MFB migration and invasion in each group注:与对照组比较,①P<0.05;与0.001 mg/L C19组比较,②P<0.05;与0.01 mg/L C19组比较,③P<0.05
3 讨论
OSF是一种慢性口腔疾病,会导致疤痕产生以及组织纤维化,并具有恶性转化潜力,最终可能引发口腔癌。由于其恶性转化率逐渐增高,该疾病对死亡率也有显著影响,据统计,OSF的发生因种族和地区而异,并与饮食、习惯和文化密切相关,南亚和东南亚的OSF患病率最高[9-10]。根据流行病学与相关研究表明,咀嚼槟榔是OSF重要的危险因素之一。为了减少OSF的发生,早期发现癌前病变、了解病理机制和探究治疗方案均意义重大。本研究通过从OSF患者颊部病变黏膜组织分离MFB,观察到在不同浓度CKLF1-C19多肽作用下对细胞增殖活性、收缩、迁移以及侵袭等能力活化相关指标产生了积极影响。
根据口腔黏膜的功能和组织学特征,可分为咀嚼型黏膜、特殊型黏膜和衬里型黏膜。OSF在这三种类型的黏膜上均发生,并最常发生在颊黏膜、磨牙后区域和软腭部位。在OSF 病例中,最初口腔粘膜从柔软的粉红色逐渐变为没有弹性并略微发白,随后黏膜明显无弹性、不透明,触诊时呈纸质白色且坚韧,在后期阶段唇部和上颚也会发生一个甚至多个部位病变[11]。OSF患者在摄入辛辣食物后,口腔会出现严重烧灼感,此外,患者还会出现张口能力受限和口腔伤口愈合不佳等现象。MFB广泛存在于瘢痕和纤维化的组织中,除了具备成纤维细胞的分泌功能外,还能够发挥部分肌细胞的收缩功能,然而,在组织修复过程中持续激活MFB可导致修复机制异常,分泌富含胶原的纤维性基质,从而促使瘢痕挛缩及纤维化发生。MFB产生的α-SMA能够结合到细胞内应力纤维中,在收缩时产生强大的力,MFB通过这些纤维控制细胞的形状和运动、ECM重塑以及组织收缩[12-14]。本研究通过免疫荧光染色也发现了从OSF患者中分离培养的MFB中α-SMA高表达。此外,还有研究表明MFB表现出高水平的细胞因子、趋化因子、生长因子和细胞表面受体的诱导性,这使得细胞具有炎症细胞的某些特性,能够对各种炎症、免疫和机械信号做出反应,并且纤维化组织中的MFB还显示出对凋亡的高度抵抗性。结合以上观点,MFB在OSF进展中可能发挥着重要作用。
以往研究[15]结果显示C19在多项疾病中发挥积极作用,例如,C19通过抑制TNF-α、IL-1β和IL-8等介质的产生来减少中性粒细胞对缺血区域的浸润,防止大鼠局灶性脑缺血;C19在体内和体外抑制血管平滑肌细胞迁移和内膜增生,表明其在动脉粥样硬化和血管成形术后再狭窄中的保护作用[16];C19通过抑制炎症细胞的浸润和微血管细胞的增殖来预防银屑病[17]。本研究结果显示,经过C19处理后MFB的增殖活性下降,细胞迁移与侵袭数目均减少,胶原凝胶收缩面积比率增加,同时,上清中羟脯氨酸的含量减少,由此说明C19能够有效抑制MFB的活化。此外,羟脯氨酸是胶原组织代谢的指标,其含量变化反映了细胞上清中可溶性胶原含量的变化,间接说明纤维化的程度。
Wnt分泌蛋白是糖基化脂质修饰蛋白家族成员,在组织发育、组织稳态、细胞分化和细胞增殖中发挥重要作用,Wnt信号通路的异常激活与多种疾病的发病机制有关,而sFRP家族是Wnt信号通路的细胞外调节因子,具有与卷曲受体同源的富含半胱氨酸结构域,可以通过该结构域隔离Wnt或与卷曲受体形成无活性的复合物来抑制Wnt信号传导[18-20]。sFRP含有sFRP 1~5五个成员,且均已在哺乳动物中得到鉴定。目前,已证实sFRP1、sFRP2与sFRP5能够影响肌成纤维细胞的增殖、胶原合成以及成纤维细胞向肌成纤维细胞的转化过程,与不同组织的纤维化发生相关[21-23]。鉴于此,本研究在C19处理后的MFB中检测了这三种sFRP的表达变化,结果显示出C19能够下调sFRP1和sFRP2的表达,对sFRP5的表达未产生显著影响。由此推测,C19调控sFRP1和sFRP2表达可能是影响OSF发生发展的一个分子机制。
4 结论
肌成纤维细胞在口腔黏膜下纤维性变的发病机制中发挥作用,CKLF1-C19多肽能够抑制口腔黏膜下纤维性变颊粘膜组织中肌成纤维细胞的增殖活性、迁移及侵袭,降低胶原分泌能力,阻止了肌成纤维细胞的活化,这一作用可能与调控sFRP1和sFRP2的表达相关,可能为CKLF1-C19多肽治疗OSF提供了实验依据。
