森林脑炎病毒滴度检测蚀斑法的建立及验证
2023-02-20陈娜娜陈诗阳王颖杜翔宇苗会拱小棠刘双军李景良
陈娜娜,陈诗阳,王颖,杜翔宇,苗会,拱小棠,刘双军,李景良
1.长春生物制品研究所有限责任公司疫苗三室,吉林 长春 130062;2.长春理工大学生命科学技术学院,吉林 长春 130062
森林脑炎又称蜱传脑炎,是由携带森林脑炎病毒(tick-borne encephalitis virus,TBEV)的蜱虫叮咬所致的以中枢神经系统病变为主的一种自然疫源性急性传染病[1-2]。TBEV 是一种人兽共患病毒,人感染后会出现高烧、意识模糊、颈肩或四肢肌肉迟缓性麻痹以及脑膜刺激、吞咽困难、呼吸衰竭等症状[3-5]。严重可导致永久性神经损伤及死亡[6]。在过去几十年里,森林脑炎已成为西欧、西伯利亚、中国东北部日益严重的公共卫生问题[7-9]。目前尚无特异性治疗森林脑炎的药物,接种疫苗是预防森林脑炎最有效的措施[10-12]。
森林脑炎灭活疫苗的毒种以及生产过程中的病毒滴度检测方法均采用小鼠脑内攻毒滴定法,该方法存在诸多不可控因素,如检测周期长、检测过程繁琐等,且消耗大量实验动物。不符合世界卫生组织(WHO)有关动物伦理3R 原则,即减量原则(Reduction)、优化原则(Replacement)、替代原则(Refinement)的要求[13-16]。有文献提倡将 3R 原则纳入 WHO生物制品批放行检测指南[17]。因此,促进动物实验的替代方法能够保证更快、更有效地实施3R 原则理念[18-19]。
本研究将鼠脑毒种在原代地鼠肾(primary hamster kidney,PHK)细胞中进行适应性传代,获得PHK细胞适应的TBEV 株(以下简称PHKT 株)。BHK-21细胞是目前疫苗病毒滴度检测(蚀斑法)中采用的接种细胞之一[20],将 PHKT 株感染 BHK-21 细胞,建立了检测PHKT 株感染性滴度的蚀斑法,与小鼠脑内攻毒滴定法进行相关性分析,并进行方法验证,为后续森林脑炎疫苗的研发奠定基础。
1 材料与方法
1.1 细胞及病毒 BHK-21细胞和“森张”株TBEV 由长春生物制品研究所有限责任公司疫苗三室保存。
1.2 实验动物 SPF 级金黄地鼠(12 ~ 14 日龄,雄性,体质量13 ~16 g,120只)和SPF级昆明小鼠(雌性,体质量7 ~9 g,72只)均由长春生物制品研究所有限责任公司动物室提供,动物合格证号:SYXK(吉)2017-0005。本研究对实验动物的所有处理均以科研为目的进行养殖和使用,且按照《实验动物饲养标准操作规程》(SA-24-001)相关规定进行。
1.3 主要试剂及仪器 MEM培养基购自日本日水制药株式会社;新生牛血清购自山西润生大业生物材料有限公司;T25 细胞培养瓶、6 孔细胞培养板购自美国Corning Incorporated公司。
1.4 PHKT 的制备 将金黄地鼠无菌取肾,剪碎,经0.125%胰酶消化,培养液分散细胞,制备细胞悬液,分装培养瓶,(37±1)℃培养至细胞长成致密单层。病毒感染及传代:将TBEV 10 倍系列稀释至10-4,接种至培养3 d 长成单层的PHK 细胞中,1 mL/瓶,加入含2%新生牛血清的MEM 培养基,9 mL/瓶,使病毒终浓度为 10-5,置 33 ℃,5% CO2培养箱培养,96 h后收获,即为第1 代病毒,再次感染PHK 细胞,96 h后收获,即为第2代病毒,连续收获至12代病毒。
1.5 小鼠脑内攻毒滴定法检测TBEV滴度 将PHKT 10倍系列稀释,每个稀释度接种小鼠脑腔,0.03 mL/只,共6只,3 d内死亡小鼠不计(动物死亡数量应不超过试验动物总数的20%),逐日观察14 d。采用Reed-Muench法计算小鼠半数致死量(LD50)[21]。
1.6 检测TBEV 滴度的蚀斑法的建立 将长成单层的 BHK-21 细胞按 1 × 105个/mL 接种 6 孔细胞板,3 mL/孔,37 ℃培养至细胞长成单层备用。将PHKT 10 倍系列稀释(10-4~ 10-8),每个稀释度感染 2 孔,1 mL/孔,并设2 个细胞对照孔,37 ℃吸附1.5 h;加入第一层覆盖液,冷凝后凝固成覆盖层,37 ℃恒温培养箱培养;每天观察细胞状态,第3 天加入含3%中性红的第二层覆盖物,冷凝后凝固成覆盖层,37 ℃继续培养24 ~48 h;观察蚀斑,并对结果计数。
1.7 方法验证
1.7.1 专属性 在每代病毒感染时,设细胞对照组,在每代病毒收获时,同时收获细胞对照组上清液。接受标准:细胞对照组阴性,无空斑形成。
1.7.2 重复性 取6 份第5 代PHKT 毒种,由相同试验人员检测TBEV 滴度。可接受范围:同代次样品TBEV滴度检测结果变异系数(CV)<5%。
1.7.3 中间精密度 取第5 代PHKT 毒种,由不同试验人员,在不同时间(第5 代毒种制备后0、7、14、21、28、35 d)进行检测。可接受范围:同代次样品TBEV滴度检测结果CV<5%。
1.8 统计学分析 利用Excel 对实验数据进行统计学分析,对两种病毒滴定检测方法的检测结果进行线性回归分析,|r| < 0.3 时为弱相关,0.3 ≤ |r| < 0.5时为低度相关,0.5 ≤ |r| < 0.8 时为显著相关,0.8 ≤|r| <1 时为高度相关。采用F检验分析两种检测方法间的差异是否显著,F>Fɑ表明两种检测方法具有显著的线性关系,以P<0.05为差异有统计学意义。
2 结果
2.1 PHKT 的蚀斑特性 观察结果显示,在病毒接种孔中形成蚀斑,蚀斑形态清晰,大小均一,边缘整齐,细胞对照孔无病毒蚀斑出现。不同代次(第4 和12代)蚀斑大小形态均一且相似。随病毒稀释倍数增加,蚀斑数减少,呈剂量依赖性。见图1。

图1 第 4 和 12 代 PHKT 毒种在 BHK-21 细胞上蚀斑形成观察(中性红染色)Fig.1 Observation on plaque formation of PHKT virus of 4th and 12th passages on BHK-21 cells(neutral red staining)
2.2 PHKT 滴度稳定性 蚀斑法检测结果显示,第1 和2 代PHKT 病毒蚀斑滴度较低,处于适应细胞培养阶段,第3~12 代PHKT 病毒蚀斑滴度为8.0 ~8.9 lgPFU/mL,不同代次间感染性滴度趋于稳定。
2.3 蚀斑法与小鼠脑内攻毒滴定法检测TBEV 滴度的对比分析 TBEV 适应PHK 细胞后,分别用蚀斑法与小鼠脑内攻毒滴定法检测TBEV滴度,两种方法检测趋势相同,鼠脑毒种在PHK 细胞上适应前3 代时病毒滴度呈上升趋势,适应3 代后病毒滴度趋于平稳。小鼠脑内攻毒滴定法检测的灵敏度相对较低,蚀斑法较高。见表1 和图2。利用统计学方法分析二者相关性,经回归分析,r=0.92,高度相关。以蚀斑法检测结果为横坐标,小鼠脑内攻毒滴定法检测结果为纵坐标,得出回归方程y=0.532x+3.425,R² =0.848 2,二者呈正相关,见图3。通过F检验(P< 0.05)结果来判定回归效果,两者间具有显著的线性关系,且检测结果高度相关。见表2。

表1 两种方法TBEV滴度检测结果的对比Tab.1 Comparison of detection results of TBEV titer by two methods

表2 方差分析表Tab.2 Table of variance analysis

图2 两种检测方法病毒滴度对比趋势图Fig.2 Trend chart of comparison of virus titers detected by two detection methods
2.4 方法验证
2.4.1 专属性 在其他成分(如新生小牛血清、细胞代谢物等)存在下,蚀斑法可检出第1 ~6 代PHKT毒种的毒力(分别为 5.00、6.84、8.70、7.85、8.9、8.85 lgPFU/mL),其他成分对检测结果无影响,而细胞对照组未检出毒力。
2.4.2 重复性 第5 代PHKT 毒种同一试验人员6次检测结果(分别为8.90、8.85、8.78、8.85、8.85、8.90 lgPFU/mL)的CV为0.5%,<5%,重复性良好。
2.4.3 中间精密度 不同试验人员不同时间检测第5代PHKT 毒种滴度接近,CV均<5%,中间精密度良好,见表3。
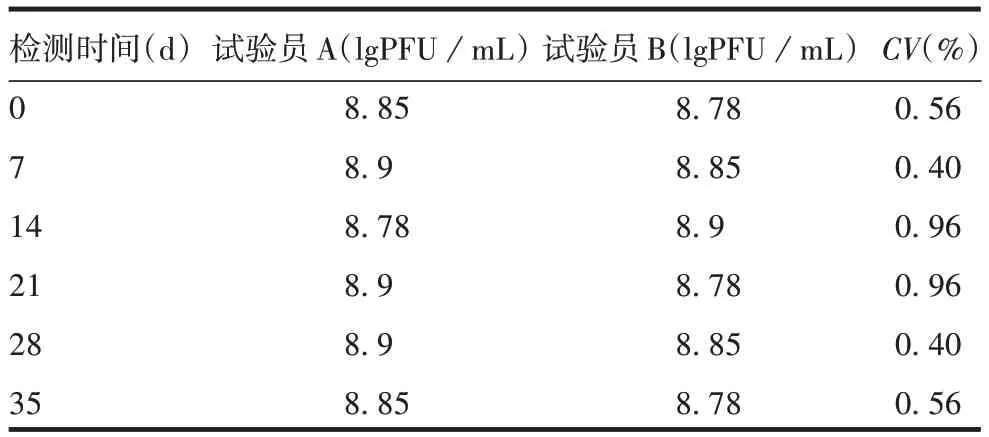
表3 蚀斑法检测TBEV滴度中间精密度验证结果Tab.3 Verification results of intermediate precision of TBEV titer detected by plaque method
3 讨论
目前蚀斑法已广泛应用于多种病毒滴度检测中,检测结果可靠、敏感、重复性好、客观性更强,具有检测效率高、操作简单、周期短等特点[22-24]。有文献报道,采用蚀斑法(BHK-21 细胞)检测TBEV 疫苗免疫血清中和抗体效价,证明了TBEV 对BHK-21 细胞的易感性[25],蚀斑法较经典小鼠脑内攻毒滴定法敏感性好,可作为小鼠法的替代方法。
两种方法检测病毒滴度的对比分析结果表明,蚀斑法检测灵敏度高于小鼠脑内攻毒滴定法。每个具有感染性的病毒在BHK-21 细胞上均能呈现出蚀斑,但在动物体内极少的TBEV就可能导致试验小鼠发病,但剂量较小,不至于导致小鼠死亡,相对降低了病毒滴度检测结果。
适应 PHK 细胞传代后的 PHKT 毒种第 3 ~ 12 代滴度稳定,可达108PFU/mL,不同代次间差异不显著。但第1、2代PHKT 毒种蚀斑滴度较低,可能是鼠脑传代的TBEV未经细胞传代,不能较好地适应PHK细胞,因此毒力较弱。第3 代PHKT 毒种在BHK-21细胞上呈现出较高的感染性滴度(8.7 lgPFU/mL),持续传至第12代仍保持较高毒力(8.0 lgPFU/mL),表明不同代次PHKT 毒种在BHK-21 细胞上滴度稳定,无显著性差异,证明了TBEV 在PHK 细胞中的传代稳定性。另一方面,因鼠脑毒种(TBEV)在BHK-21细胞上不能产生蚀斑,而PHK细胞毒种(PHKT)从第3 代开始能够在BHK-21 细胞出现稳定、大小均一的蚀斑,因此,适应PHK 细胞后的TBEV 的基因突变情况需进一步深入研究。
蚀斑法检测TBEV 滴度的方法验证结果表明,PHKT 毒种在其他成分(如新生小牛血清、细胞代谢物等)存在下,能灵敏地测定出毒力,专属性良好。在相同条件下,由相同试验人员测定相同代次样品TBEV感染性滴度检测结果相近,CV为0.5%,重复性良好。相同代次样品不同试验人员不同时间TBEV 感染性滴度检测结果相近,CV 为0.40% ~0.96%,中间精密度良好。进一步证明,蚀斑法检测TBEV毒力可靠且可行。为将来TBEV 疫苗毒种变更奠定了良好的基础,也为疫苗生产中间品的质量控制提供了精确的检测手段。
