基于超高效液相色谱-串联高分辨质谱的血清代谢组学用于探索区分结直肠腺瘤和结直肠癌的生物标志物
2023-02-20杨珊伊陈鸿炜周海琳朱一帆张嘉豪王旋成黄宗声张淇淞
杨珊伊,陈鸿炜,周海琳,朱一帆,张嘉豪,王旋成,黄宗声,张淇淞,2*
(1.广西大学 医学院,广西 南宁 530004;2.湖北民族大学 风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000;3.广西壮族自治区人民医院消化内科,广西 南宁 530021)
据世界卫生组织统计,结直肠癌(Colorectal cancer,CRC)是世界3种最常见的恶性肿瘤之一[1]。虽然肿瘤的治疗技术在不断发展,但CRC致死数仍占癌症死亡总数的9.40%,是肿瘤致死的第二大原因。研究报道,CRC主要通过腺瘤-癌途径发展而来,结直肠腺瘤(Colorectal adenoma,CA)是CRC的重要癌前病变,通常CA形成CRC完成整个癌变过程约需要10 ~ 15年时间[2-3],该阶段无特异性临床症状,隐匿性较强,一旦发展为CRC,患者的治愈率和生存率将大大降低。患者若能在CA阶段获得及时诊断和治疗可明显改善其生存率和治愈率,因此,CRC的早期筛查对于其预防与诊疗至关重要[4]。
由于CA发展的隐匿性,其通常难以被发现从而导致诊断延迟或漏诊等问题,最终导致CRC的治疗和预后效果不理想[5]。目前,传统的结直肠镜检查是诊断CRC的金标准。然而,结直肠镜检查属于侵入性检查,易导致患者的耐受性差,以及穿孔和出血等并发症的发生[6]。其他非侵入性方法,如无创定量粪便免疫化学检测可用于CRC早期无创筛查[7],但敏感性和特异性不佳。因此,急需寻找一种安全、微创且高效的生物标志物用于CRC的早期诊断和筛查。
相较传统的结直肠镜检查,基于微创或非侵入性生物标志物的诊断检测具有明显优势[8-9]。其中高通量组学技术(代谢组学与脂质组学技术等)被视为疾病诊断和预后生物标志物发现的重要前沿技术[10]。代谢组学技术可以检测到生物代谢途径的细微差别,有助于进一步揭示机体生理或病理变化的潜在机制。尽管代谢组学技术已被广泛应用于多个研究领域,包括癌症等多种疾病的诊疗研究[11],但其在CA和CRC患者判别生物标志物的相关研究尚无报道。研究表明,系统性生物流体中代谢谱的变化主要反映宿主对炎症或肿瘤等病理变化的反应[12],其中血清代谢物水平的变化可直接反映机体内源性代谢变化和病理改变,同时激活的免疫反应会影响血液中代谢物的种类或丰度,从而有助于及早发现机体的代谢失调和病变。目前,通过代谢组学技术发现的诊断标志物包括甘油三酯、磷脂酰甘油、5-羟色胺等,对于CRC的临床诊疗评估有重要作用[13]。但是目前尚缺乏可用于CRC早期诊断的微创生物标志物,因此,临床上迫切需要发现新的生物标志物来辅助CRC的早期诊断和预防,以降低CRC的发病率与死亡率。
本研究利用高灵敏度和高分辨率的超高效液相色谱-串联高分辨质谱(UHPLC-HRMS)技术对CA及CRC患者进行血清非靶向代谢组学研究,通过对比发现CA与CRC患者的血清代谢轮廓差异,结合多元统计分析进行差异代谢物的筛选和评价,进而获得对CA和CRC患者具有良好判别效能的生物标志物,以辅助CRC的早期诊断,从而针对性地延缓或阻止CA的癌变过程。同时,基于富集和通路分析的主要紊乱代谢通路的发现也为揭示CA恶性转化的潜在代谢机制提供了支持。
1 实验部分
1.1 仪器与试剂
UHPLC-HRMS仪(美国赛默飞世尔科技公司);高速冷冻离心机(德国艾本德公司);密理博超纯水系统(美国密理博公司);涡旋器(上海精科仪器有限公司);超声仪(上海生析超声仪器有限公司);制冰机(意大利Scotsman公司);甲醇、二氯甲烷、异丙醇、乙腈、甲酸铵、甲酸均为色谱纯(美国默克公司)。
1.2 样本来源与制备
本研究方案通过广西壮族自治区人民医院伦理委员会批准(编号:KY-DZX-202008),收集的所有血清样本和受试者信息均征求受试者的书面同意,并签署知情同意书,共纳入64例CA患者和84例CRC患者。所有受试者术前禁食8 h,之后将血清样品收集于凝血管中,以5 000 r/min在4 ℃下离心10 min,将上清液转移到新的EP管中并于−80 ℃下储存备用。将预冷的乙腈(200 mL)添加至50 mL血清中,涡旋3 min后在4 ℃下以13 000 r/min离心10 min,吸取全部上清液并进行真空干燥。最后用100µL 75%乙腈水溶液(含0.5 µmol/L D4-脱氧胆酸和他莫昔芬)复溶,涡旋3 min后于4 ℃下以13 000 r/min离心20 min,收集全部上清液用于代谢组学分析。每个样品取5 µL混合作为质量控制(QC)样品。在样品分析前,通过平衡分析系统与至少6份空白样品和6份QC样品验证分析系统和方法的重复性与稳定性[14]。
1.3 液相色谱与质谱条件
液相色谱条件:Waters Acquity UPLC HSS T3色谱柱(100 mm × 2.1 mm,1.8 µm);流动相:正离子模式为0.1%甲酸乙腈(A)−0.1%甲酸水(B),负离子模式为0.01%甲酸乙腈(A)−0.01%甲酸水(B)。洗脱程序均为:0.0 ~ 2.0 min,2% A;2.0 ~ 13 min,2% ~ 100% A;13 ~ 18 min,100% A;18 ~ 20 min,100% ~ 2% A。柱温为40 ℃,流速为0.4 mL/min;进样量为5 µL。
质谱条件:电喷雾离子源(ESI),辅助气流速为10 µL/min,鞘气流速为40 µL/min,离子传输管温度为320 ℃,雾化温度为400 ℃,喷雾电压为3.50 kV(正离子)或2.80 kV(负离子);数据采集模式为Full Scan + ddMS2,一级扫描范围为m/z100 ~ 1 200,一级和二级质谱的质量分辨率分别为70 000和17 500。
1.4 代谢组学数据处理与分析
将代谢组学原始数据导入数据处理软件Compound Discovery 3.2中,对数据进行峰对齐和归一化处理,然后提取获得含质荷比、保留时间和峰强度的三维数据文件。通过SIMCA-P14.0软件对代谢组学的三维数据进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),并采用200次置换检验进一步考察分析模型的可靠性和适用性,避免过拟合。由于机体内源性的代谢水平易受到外界因素影响,因此,为减少组间差异代谢物的假阳性率,并根据文献报道和课题组的前期研究,以变量重要性投影(VIP)> 1.00,倍数变化> 1.50或< 0.67且P< 0.05作为标准筛选组间差异代谢物[14-15]。随后,根据精确分子量以及离子碎裂信息,利用仪器自带数据库(mzCloud及mzValut)和HMDB数据库对组间差异代谢物进行初步鉴定。最后,利用MetaboAnalyst软件对差异代谢物进行富集分析和通路分析,通过受试者工作特征曲线(ROC)分析对差异代谢物进行判别效能评价。
2 结果与讨论
2.1 主成分分析
将CA组、CRC组和QC组样本在正、负离子模式下建立PCA模型进行分析,考察仪器系统和检测方法的稳定性及样本的分布趋势。由图1A和1B可知,QC组样本在2种ESI模式下的聚集情况良好,说明仪器的稳定性和重现性良好,可满足代谢组学的分析要求。其中,CA组和CRC组的区分较为明显,说明两组的血清代谢谱存在差异。与ESI−模式相比,在ESI+模式下,CA和CRC组的样本簇之间分离趋势更明显。两组中大部分的样本点均在95%的置信区间内,只有少数CRC组的样本点分布在区间外,可能是由于存在较大的个体差异。此外,两组的部分样本点存在重叠,说明CA与CRC组间有一定的相似性,两者的鉴别存在一定难度。
2.2 正交偏最小二乘判别分析
为进一步探究CA组与CRC组之间的代谢轮廓差异,基于PCA分析所涉及的代谢特征进行OPLSDA分析,以筛选组间差异代谢物。与PCA分析的三维得分图(图1A、1B)相比,OPLS-DA分析的三维得分图(图1C、1D)中CA与CRC组的组间区分更显著,能更直观地表明两者血清代谢谱的差异。在OPLS-DA模型中,正离子模式下的R2X、R2Y、Q2值分别为0.358、0.935、0.760,负离子模式下分别为0.192、0.973、0.767,说明该模型表现出良好的数据解释和预测能力。随后,采用200次置换检验进一步考察该模型的可靠性与合理性。如图1E和1F所示,正离子模式下的置换检验主要评价参数R2Y、Q2、P值分别为0.944、−0.261和0.000,负离子模式下分别为0.685、−0.358和0.000,且两者的直线初始点均高于样品点,提示该模型不存在过拟合,数据分析合理。
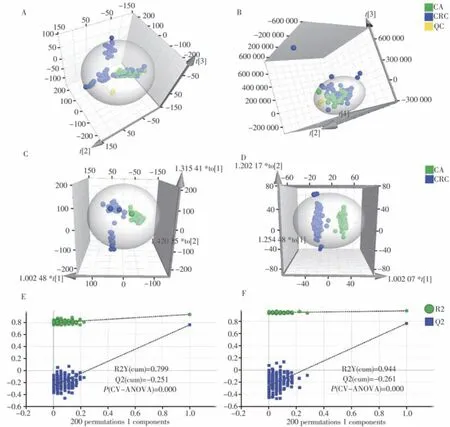
图1 CA与CRC组血清代谢组学的多元统计分析Fig.1 Multivariate statistical analysis for the serum metabolomics of CA and CRC patients PCA score plots in ESI+(A) and ESI−(B) modes,respectively;OPLS-DA score plots in ESI+(C) and ESI−(D) modes,respectively;OPLS-DA corresponding permutation tests in ESI+(E) and ESI−(F) modes,respectively
2.3 差异代谢物的筛选及其判别效能评价
根据两组间的倍数变化和差异分析统计值,以倍数变化> 1.50或< 0.67,且P< 0.05为标准并结合VIP > 1.00筛选组间的差异代谢物,共确定66种差异代谢物。其中,甘油磷脂、脂肪酸、鞘磷脂、类固醇、氨基酸、胆碱、核苷的数量构成比例分别为40.91%、28.79%、10.61%、7.58%、7.57%、1.51%、3.03%(图2)。甘油磷脂和脂肪酸的占比最大,总构成比高达69.70%,表明两者所涉及的代谢紊乱可能与CA恶性转变为CRC有关。
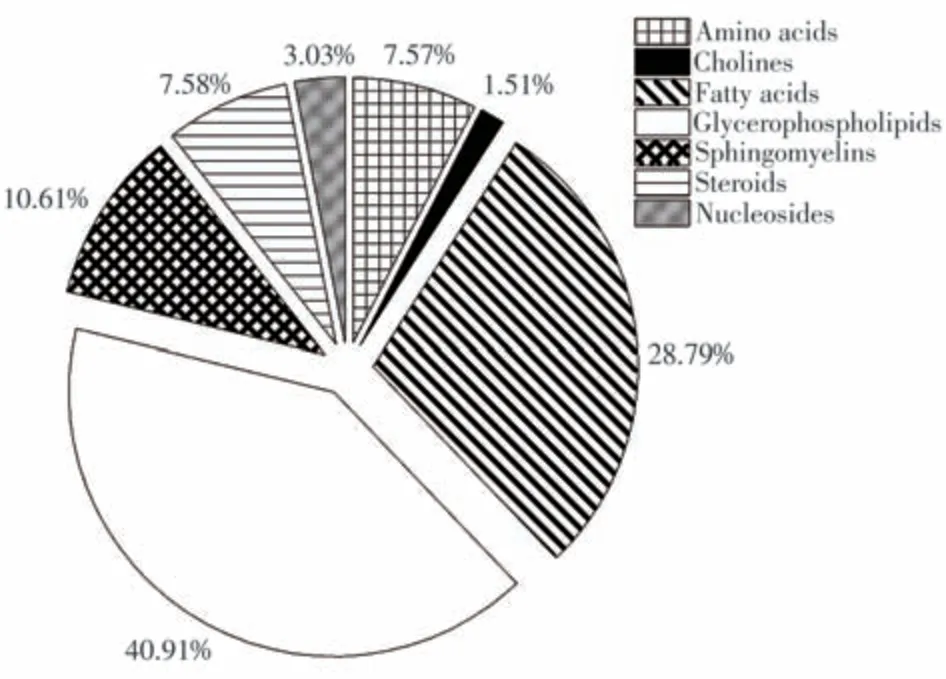
图2 不同类别组间差异代谢物的构成分布Fig.2 Component distribution of differential metabolites between CA and CRC groups
同时,采用ROC分析评估上述66种差异代谢物对CA和CRC的辨别能力,计算AUC值后选择最合适的截止点,优化每种差异代谢物的灵敏度和特异性。在ROC分析前,对代谢组数据进行QC归一化处理,以有效降低个体差异和系统误差的影响。通过差异代谢物的AUC值评估其作为生物标志物对CA与CRC的判别效能,共确定11种对CA与CRC具有良好鉴别能力的差异代谢物作为潜在的生物标志物(AUC > 0.800)。其中,ESI+模式下有7种代谢物,ESI−模式下有4种代谢物。腺嘌呤的AUC值高达0.952,而乙酰肉碱20∶1(ACar 20∶1)的AUC值为0.801。基于ROC分析,进一步探讨这些潜在生物标志物在组间的水平变化趋势。如表1所示,与CA组相比,其中10种差异代谢物在CRC组血清中均呈显著上调趋势,大部分为甘油磷脂与脂肪酸类代谢物,说明甘油磷脂和脂肪酸的代谢水平上调可能参与CA的癌变过程。最后根据精确分子量和碎裂离子信息,利用仪器自带数据库和HMDB数据库对上述11种差异代谢物的结构进行初步鉴定,结果显示匹配效果良好(图3)。
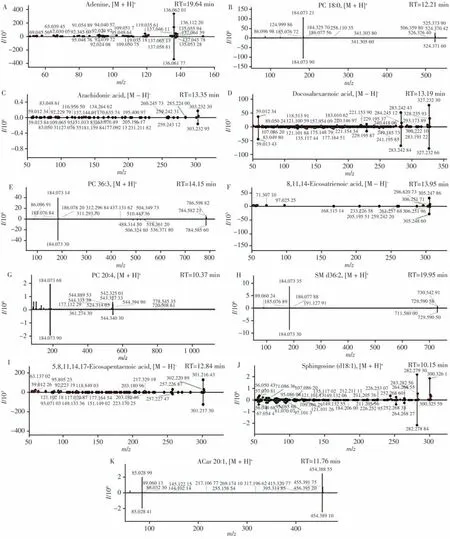
图3 高判别效能差异代谢物的鉴定效果Fig.3 Identification effect of differential metabolites with high discriminant ability for the CA and CRC patients
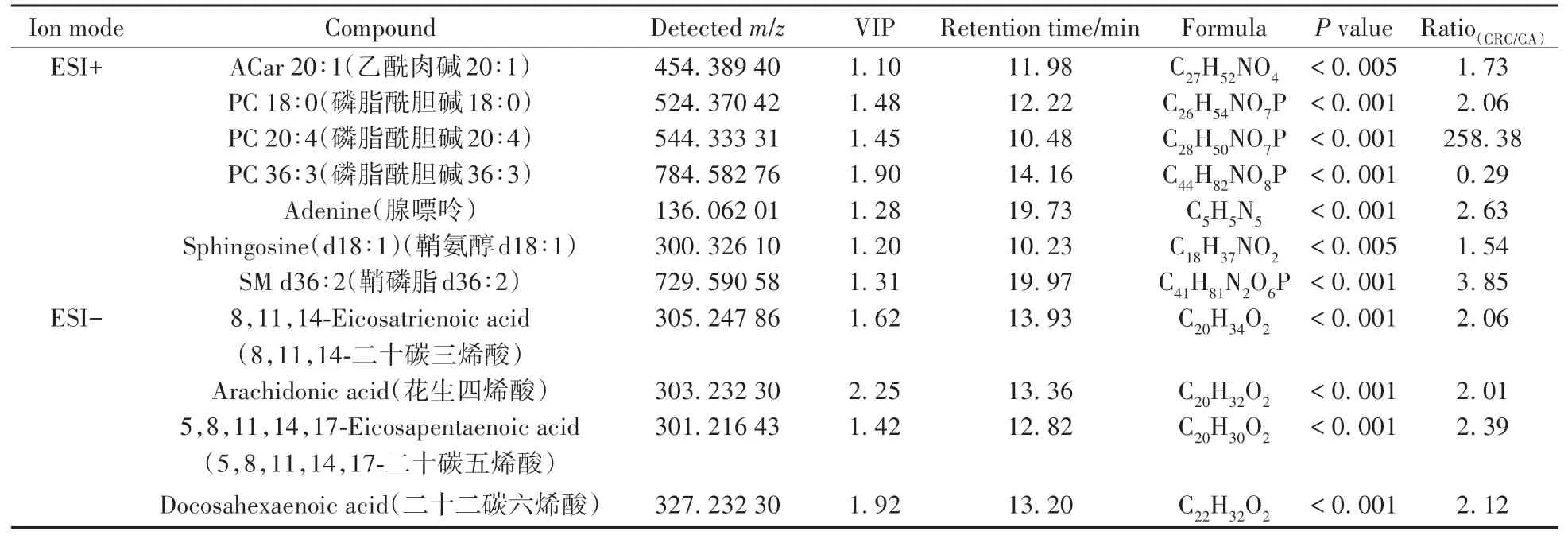
表1 CA与CRC患者的血清生物标志物Table 1 Serum biomarkers for the discrimination between CA and CRC patients
2.4 差异代谢物的多元ROC分析及代谢通路分析
根据MetaboAnalyst 5.0软件,采用基于支持向量机(SVM)算法的多元ROC分析自动选择最佳代谢物组合。如图4所示,11种组间差异代谢物是主要的选择与考察变量,利用多元ROC分析的AUC值评价其在区分CA和CRC方面的判别效能。图4B为由图4A中的前2、3、5、7、10和11种差异代谢物构建的分类模型的ROC曲线及其AUC值。结果显示,最佳的潜在生物标志物是由前5种差异代谢物组成的标志物组合(AUC = 0.941,95% CI = 0.901 ~ 0.987),其AUC值大于大部分单个差异代谢物的AUC值(图4B)。因此,前5种差异代谢物的组合可作为CA癌变成CRC的潜在判别标志物。
使用MetaboAnalyst 5.0对上述鉴定的66种差异代谢物进行代谢物富集分析及通路分析,以初步探索与CA癌变相关的代谢通路机制。富集分析结果如图4C所示,根据P< 0.05筛选出不饱和脂肪酸的生物合成、亚油酸代谢、嘌呤代谢途径是影响CA恶变为CRC的关键代谢途径。通路分析结果如图4D所示,以影响因子(IF) > 0.1或P< 0.05为标准确定与CA恶性转化关联紧密的代谢通路,可以明显看出不饱和脂肪酸的生物合成、嘌呤代谢和亚油酸代谢是影响CA癌变转化的关键代谢通路。综合代谢物富集与通路分析结果可得,上述3条代谢通路的紊乱可能与CA恶性转化密切相关。
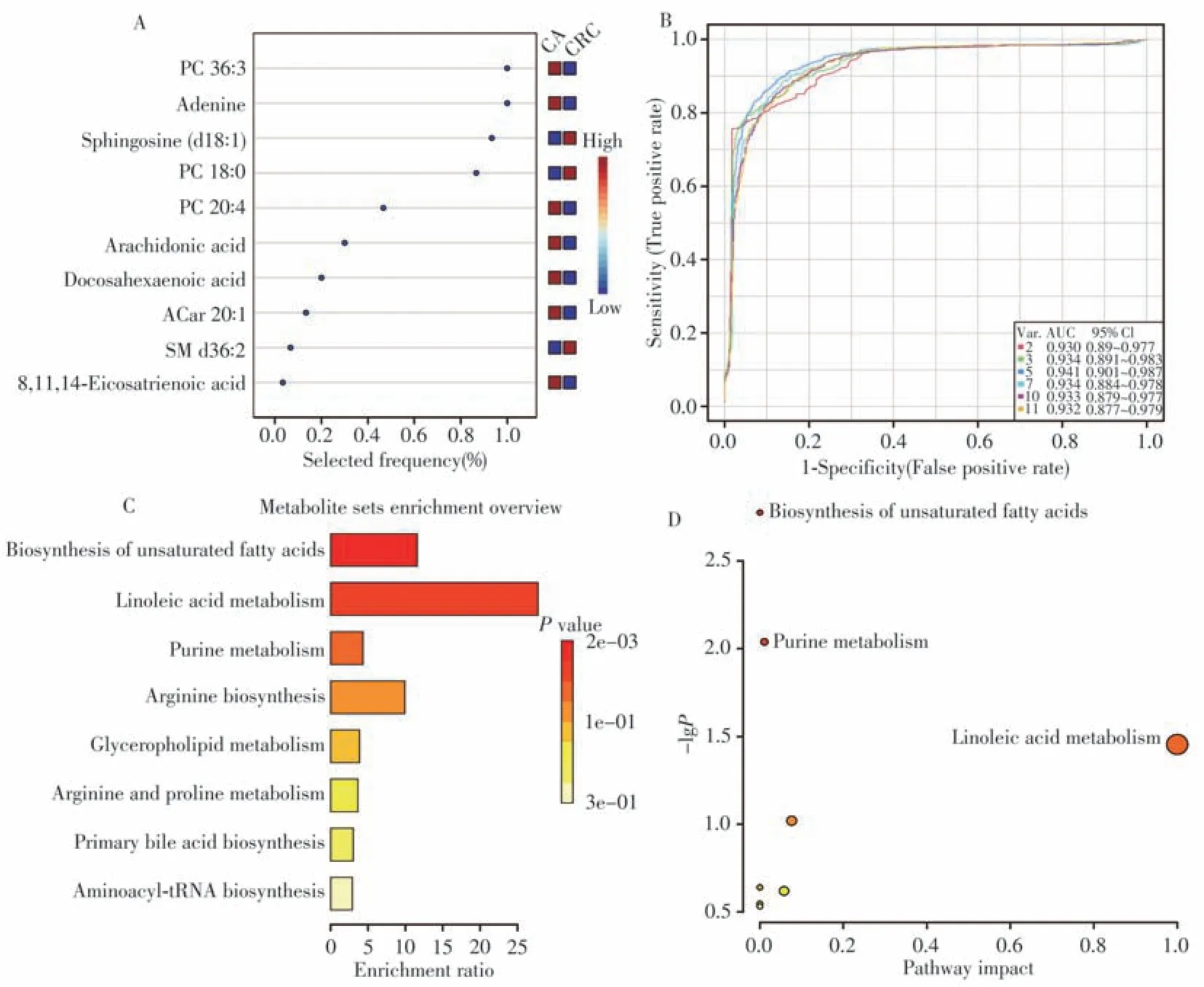
图4 差异代谢物的多元ROC 分析与代谢通路分析Fig.4 Multivariate ROC analysis and metabolic pathway analysis by differential metabolites between CA and CRC groups
2.5 讨 论
近年来,大部分研究致力于探索CRC的潜在诊断生物标志物,但目前尚无通过血清代谢组学研究用于判别CA与CRC患者以辅助CRC早期诊断的可靠生物标志物[15]。Gumpenberger等[16]通过血浆代谢
组学研究发现,在CA和CRC之间有48种差异代谢物,主要包括溶血磷脂酰胆碱和磷脂酰胆碱。在本研究中,磷脂酰胆碱同样被鉴定为主要的差异代谢物,其在两组差异代谢物中数量占比最大,同时在多元ROC分析中的判别性能最高的代谢物组合中包括3种磷脂酰胆碱(PC36∶3、PC18∶0、PC20∶4)。除了磷脂酰胆碱外,本研究还发现脂肪酸也是区分CRC与CA的重要潜在生物标志物。通常来说,癌细胞中高表达脂肪酸,以满足其快速增殖对上调合成、信号转导和细胞膜形成所需的能量需求。Zhou等[17]的血清脂质组学研究中,4种脂肪酸(棕榈酸、二十二碳六烯酸、4-十二烷基苯磺酸、15Z-9,12,13-三羟基-15-十八碳烯酸)也被确定为对CA具有良好诊断性能(AUC > 0.80)的潜在脂质标志物。
一般情况下,CA转化为CRC的过程通常受到多条代谢通路的影响。Mokhtari等[18]对不饱和脂肪酸的生物合成与CRC进展相关的机制进行了研究,与正常组相比,CRC组中基于GEO和TCGA数据库分析的不饱和脂肪酸生物合成途径的基因数量显著增加,包括ELOVL5、TECR、HSD17B112和FADS2基因等,表明了不饱和脂肪酸代谢与CRC发生发展的相关性。同样,本研究也发现相较于CA组,CRC中的脂肪酸含量明显增加,且通过代谢物通路及富集分析发现不饱和脂肪酸代谢通路的失调与CA的癌变密切相关。此外,有研究分析了CRC大鼠模型的粪便和血浆样本,发现相较于正常组,CRC组样本中的亚油酸含量显著升高,表明亚油酸代谢的紊乱是CRC大鼠模型的重要代谢特征[19]。相似地,本文的研究结果也显示亚油酸水平在CRC阶段显著增加,表明亚油酸代谢的上调对腺瘤-癌途径的发展进程有促进作用。肿瘤细胞不受控制的无限增殖是癌症形成的主要标志,而肿瘤细胞中嘌呤代谢物呈现显著上调,嘌呤通过各种受体亚型在细胞免疫反应和细胞因子释放中充当有效的调节剂,在很大程度上参与肿瘤的产生[20]。本研究也发现嘌呤代谢紊乱与CA的恶化密切相关,且腺嘌呤对CA和CRC具有最高的判别效能而作为潜在生物标志物。然而,上述论证聚焦于通过对CRC组与正常组的比较来探讨影响癌症产生的代谢机制,在本研究中,基于CA与CRC患者血清差异代谢物的富集和通路分析发现,不饱和脂肪酸、嘌呤代谢以及亚油酸代谢通路的紊乱不仅如文献报道所述与CRC的发生有关,同时也与CA癌变的潜在机制有关。
综上所述,本研究系统揭示了CA与CRC的血清代谢谱差异,发现11种差异代谢物对两组患者表现出良好的鉴别效能,可作为潜在生物标志物。特别是其中5种差异代谢物(PC36∶3、腺嘌呤、鞘氨醇、PC18∶0、PC20∶4)组成的代谢物组合可以作为鉴别CA与CRC的潜在生物标志物。此外,还发现不饱和脂肪酸的生物合成、嘌呤代谢和亚油酸代谢的紊乱可能与CA恶性转化密切相关。本研究结果为进一步揭示结直肠腺瘤-癌途径在CRC发生发展过程中的潜在作用机制提供了参考。
3 结 论
CRC的早期筛查与治疗是降低其发病率和死亡率的有效途径,代谢组学技术在肿瘤早期筛查中表现出巨大的应用潜力。本文利用高通量和高灵敏度的UHPLC-HRMS技术对CA与CRC患者的血清样本进行代谢组学分析,系统揭示了两者的代谢轮廓存在明显差异,其中,甘油磷脂和脂肪酸是主要差异代谢物,表明其代谢紊乱可能参与CA的癌变过程。此外,5种差异代谢物的组合(包括PC36∶3、腺嘌呤、鞘氨醇、PC18∶0、PC20∶4)在区分CA和CRC方面表现了出色的判别效能,可作为潜在的判别标志物。总体上,本研究为深入研究CA与CRC的血清代谢特征差异以及CA的癌变代谢机制提供了基础数据,同时也对两者的临床鉴别和CRC的早期诊断具有较高的参考意义。由于临床样本和动物模型的限制,本研究的相关发现仍需进一步实验验证。
