人工智能ASPECTS评分对急性缺血性卒中静脉溶栓中的应用价值
2023-02-19陈新悦陆丽芳唐小平通信作者
陈新悦,陆丽芳,唐小平(通信作者)
(南昌大学第二附属医院放射科 江西 南昌 330006)
时间窗内开展静脉溶栓是临床指南急性脑梗死高效救治方案,急性卒中(acute cerebral infarction,ACI)患者轻者预后良好,严重者可能导致残疾,甚至危及患者的生命,因此,对治疗效果的早期评估非常重要[1]。当前常借助神经影像学检查进行卒中的诊疗及预后评估工作,既往文献报道证实,卒中后溶栓患者的预后同梗死病灶体积关联密切,而早期CT评分是基于对大脑中动脉供血区缺血性改变的半定量评分系统,可高效、准确获取病灶体积相关信息[2]。美国心脏协会/美国卒中协会的指南提示若ASPECTS≤7分,则患者多可能存在预后不良风险,特别是出血变化、恶性脑梗死可能性高。不可避免的是,CT影像评分存在阅片医师个体经验差异性问题,部分情况下可能造成同一影像的差异性评价,是影像诊断准确性的主观因素。
伴随人工智能技术的临床深入应用,有众多学者提出了关于于人工智能下ASPECTS评分法的相关讨论,亦涉及缺血性卒中的治疗筛选问题,但尚缺少对于该评分法在临床诊疗中的实际应用论证[3-4]。本研究探讨自动ASPECTS评分在急性缺血性卒中静脉溶栓评估中的实际临床应用价值,并分析预后不良的危险因素,为人工智能在临床上推广应用、辅助临床诊断提供理论依据。
1 资料与方法
1.1 一般资料
选取2021年1月—2022年6月于南昌大学第二附属医院被诊断为大脑中动脉供血区缺血性卒中的患者165 例,受试者要求在6 h内接受阿替普酶静脉溶栓治疗。根据溶栓3 个月后改良的Rankin量表(mRS)评分情况分为两组,分别为预后良好组(0~2分)、预后不良组(3~6分)。
纳入标准:①病灶位于ASPECTS区域;②发病后72 h内开展MRI检查者;③6 h内行静脉溶栓治疗者;④患者年龄在18岁以上。排除标准:①颅内出血和(或)肿瘤患者;②图像质量差者;③具备其他重要器官功能不全者。
1.2 方法
①根据病例收集两组患者的性别、年龄、既往史(冠心病、高血压、糖尿病、吸烟史)、发病至溶栓时间等临床资料;②在影像归档和通信系统(PACS)传至人工智能软件后台并经由自动评估并生成基于非增强CT图像的ASPECTS评估图,梗死灶以弥散加权成像(DWI)高信号为标准,再由2位高年资神经放射诊断医师进行回顾性分析评分,得到基于DWI的ASPECTS评分,两人均不知道ASPECTS评分结果,当分析结果不一致时经协商后达成一致意见。③采用美国国立卫生研究院卒中量表(NIHSS)评估神经功能缺损情况,分值范围0~42分,≤4分界定为轻型卒中,≥21分界定为严重卒中。
1.3 ASPECTS评分法
作为一种在早期开展缺血性改变评价的半定量方法,临床常借助ASPECTS评分进行溶栓适应的甄别。在CT影像上选取大脑中动脉供血区2个层面的10个区域:① 核团层面(即丘脑和纹状体平面)分为M1、M2、M3、岛叶、豆状核、尾状核和内囊后肢7个区域;②核团以上层面(在核团水平上2 cm),包括M4、M5和M6。这10个区域的权重相同,均为1分。评分方法为10-梗死区域数目,分值越低提示梗死情况越严重。
1.4 统计学方法
采用SPSS 24.0统计软件进行数据分析。符合正态分布且方差齐的计量资料采用(x-± s)表示,组间比较采用独立样本t检验;计数资料用频数(n)、百分率(%)表示,采用χ2检验,一致性比较采用组内相关系数(ICC)。一致性检验采用Kappa检验,Kappa值≥0.75表示一致性良好;Kappa值在0.4~<0.75时表示一致性较好;Kappa值<0.4则表示一致性较差。并计算自动ASPECTS评分法的敏感度、特异度。危险因素分析选用多因素Logistic回归性分析,应用ROC曲线分析自动ASPECTS评分对ACI患者预后的预测价值,P<0.05则差异有统计学意义。
2 结果
2.1 纳入患者情况
165例患者中急性梗死病灶位于大脑中动脉供血区113例,非MCA供血区病灶52例。在大脑中动脉供血区的113例中,11例对于梗死位置的判断不准确,5例失访。最终入组分析的病例97例,年龄为28~94岁,预后良好组的病例为58例,预后不良组的病例为39例,见图1。
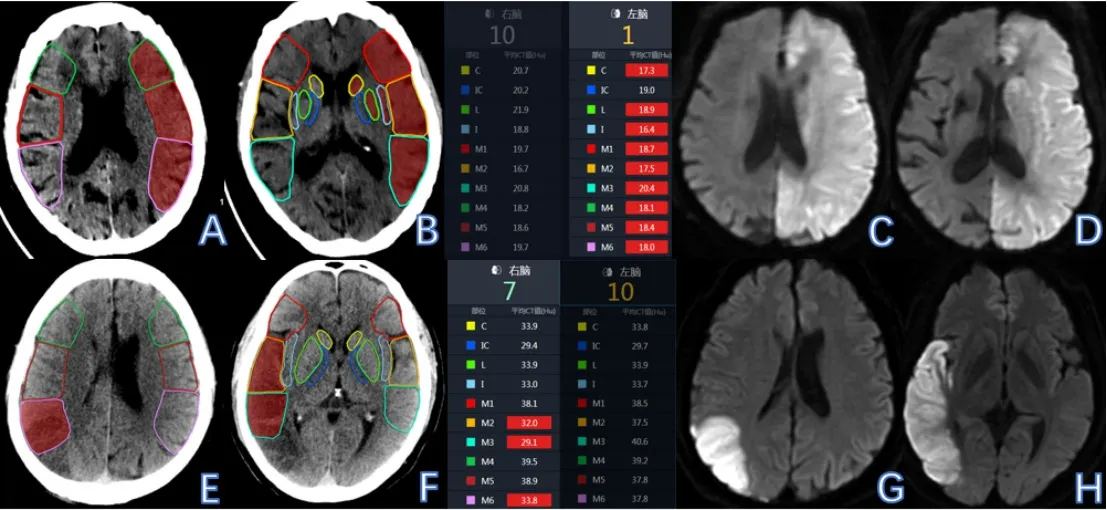
图1 预后良好组与预后不良组患者的自动ASPECTS评分和DWI ASPECTS评分
2.2 人工智能ASPECTS评分与DWI ASPECTS一致性检验
基于人工智能的ASPECTS与由医师经验判断的DWI ASPECTS之间的ICC=0.923(95%CI:0.887~0.948,P<0.001)。将人工智能ASPECTS评分与DWI ASPECTS进行一致性检验,一致性较好,Kappa=0.630。
2.3 两组患者一般资料比较
预后良好组的年龄、基线NHISS评分及人工智能ASPECTS评分与预后不良组比较差异有统计学意义(P<0.05)。见表1。

表1 两组临床资料比较
2.4 Logistic回归分析影响ACI患者预后不良的危险因素
以上述检验中存在显著差异的变量为自变量,是否预后不良为因变量,进行Logistic回归分析,P<0.05认为差异有统计学意义。见表2。
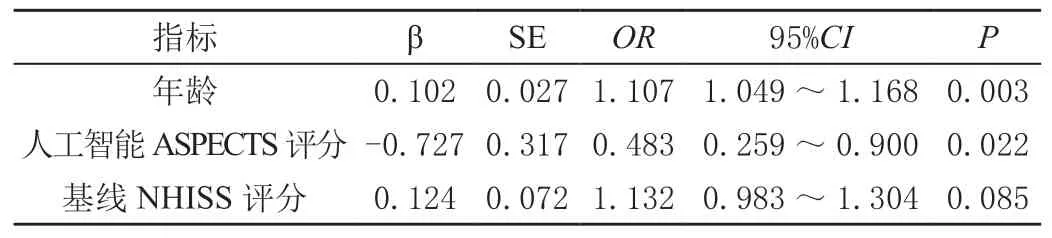
表2 Logistic回归分析影响ACI患者预后不良的危险因素
2.5 年龄和人工智能ASPECTS评分对ACI预后不良的ROC曲线
人工智能ASPECTS评分预测预后不良的曲线下面积为0.775(95%CI:0.678~0.873)(P<0.001),人工智能ASPECTS评分预测预后不良的最佳临界点是7.5,预测的灵敏度71.9%,特异度75.0%(95%CI:0.669~0.865),见图2。

图2 年龄和人工智能ASPECTS评分对ACI预后不良的ROC曲线测量值
3 讨论
急性缺血性卒中是由血栓或栓子阻塞大脑动脉引起的,占中国卒中总人数的69.6%~70.8%[5]。静脉溶栓是治疗急性缺血性卒中最有效的治疗方法之一,可降低卒中患者的致残率和病死率,然而,由于治疗时间窗窄、禁忌证较多以及出血性转化风险等因素,导致预后不良,不同的指南对于是否接受静脉溶栓的条件未做明确肯定,只有部分ACI患者接受静脉溶栓治疗[6]。因此,探讨再灌注治疗与神经功能之间的关系,一直是一个关注重点。
本次经由ASPECTS分析发现,人工智能下自动ASPECTS与高年资医师参与的以DWI为梗死金标准的DWI ASPECTS之间的ICC=0.923,说明两者一致性较好(Kappa=0.630),该结果同Maegerlein等[4]的研究相似,近年也有许多研究均指出自动ASPECTS在评估急性缺血性卒中患者的脑CT方面表现与资深医生相似[7]。这对于急诊医生,特别针对低年资医生进行溶栓前筛选甄别具有帮助作用,尤其是在缺乏多模式CT检查或者无法及时进行MRI检查时。
既往很多研究重心落在如何识别ACI患者静脉溶栓后预后不良的危险因素,以调整临床策略,本研究中,年龄、基线NHISS及自动ASPECTS评分与ACI患者阿替普酶静脉溶栓后的早期改善有关。其中年龄是一个风险因素(OR:1.107,95%CI:1.049~1.168,P<0.001),年龄每增加1岁,患者预后不良的风险增加了10.7%。年龄的增加对ACI的发病率、病死率和长期结局有重要影响,由于随着年龄的增长,可导致卒中患者神经血管单元功能障碍和神经退行性改变[8]。
此前Broccos[9]等人提出对于低ASPECTS的患者,应慎重考虑静脉溶栓带来的不良后果,本研究中ROC曲线分析显示,人工智能ASPECTS评分预测预后不良的曲线下面积(AUC)为0.767,明显大于年龄因素(AUC为0.174)。人工智能ASPECTS评分预测预后不良的最佳临界点是7.5,预测的敏感度为71.9% ,特异性75.0%,提示机器学习的ASPECTS评分对ACI预后具有较高的预测价值。然而在基于人类和机器学习的评估中,ASPECTS评分的准确性和可靠性都与时间有关,Naylor等[10]的研究结果表明早期阶段ASPECTS的预后准确性有降低的趋势,在早期时间窗口内使用人工智能ASPECTS来选择患者进行溶栓再通的可靠性较低。
综上所述,人工智能ASPECTS与DWI ASPECTS有较高的一致性,且ASPECTS评分对静脉溶栓的预后具有较好的评估价值,值得推广应用。但本次研究同样存在一定局限:①样本量相对较少,没有开展较大比例的病例研究;②本研究对人工智能ASPECTS用于每个分区ACI预后预测方面的价值有待深入论证。
