基于胸部CT平扫图像的胸椎纹理分析及机器学习对骨质疏松患者骨折前风险的精准预测方法研究
2023-02-19彭旭红通信作者雷苑麟蒋方旭赖碧玉
魏 璐,彭旭红(通信作者),雷苑麟,蒋方旭,赖碧玉
(广州医科大学附属第六医院<清远市人民医院>影像科 广东 清远 511518)
中老年骨质疏松患者易发生椎体压缩性骨折,而影像组学可用开源软件来提取肉眼无法识别的影像特征,用于评价小梁骨的微结构变化。多项研究已证实,用CT图像的组学特征对骨结构进行分析是可行的。我们拟用胸部CT平扫病人的胸椎作为研究对象,这样做的好处是,一方面,每年例行体检大多会做胸部CT,病人无需增加额外经济负担和辐射剂量;另一方面,成本低廉,无需购买专用设备,只要代入训练好的模型即可诊断。本研究目的有:判断传统影像组学模型能否诊断骨质疏松;以及观察传统影像组学模型能否预测骨质疏松患者的脆性骨折。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月—2021年12月期间清远市人民医院PACS系统确认了5 123例45岁以上的患者,均行胸部CT平扫检查及双能X线吸收测定法(DXA)。病例组纳入标准:①年龄>45岁;②在胸部CT检查前后一个月内完成DXA检查者;③胸部CT包含薄层CT扫描(≤3 mm);④在一年内至少接受两次胸部CT扫描,第二次扫描后至少6个月接受第三次扫描。第三次扫描是为了在更长的时间内验证椎体的稳定性。非骨质疏松对照组纳入标准同病例组。排除标准:①患有影响骨代谢的各类疾病者;②长期服用糖皮质激素或其他影响骨代谢的药物者;③脊柱感染性或肿瘤性患者;④图像质量欠佳影响评估者。最终,病例组共纳入48例患者,共50个稳定型胸椎椎体,50个不稳定型椎体,并随机筛选50例非骨质疏松患者胸椎椎体作为对照组。作为对照组,选择DXA骨密度(BMD)T值>-2.5 SD,与年龄、性别和椎体位置相匹配。胸椎椎体筛选过程见流程图1。
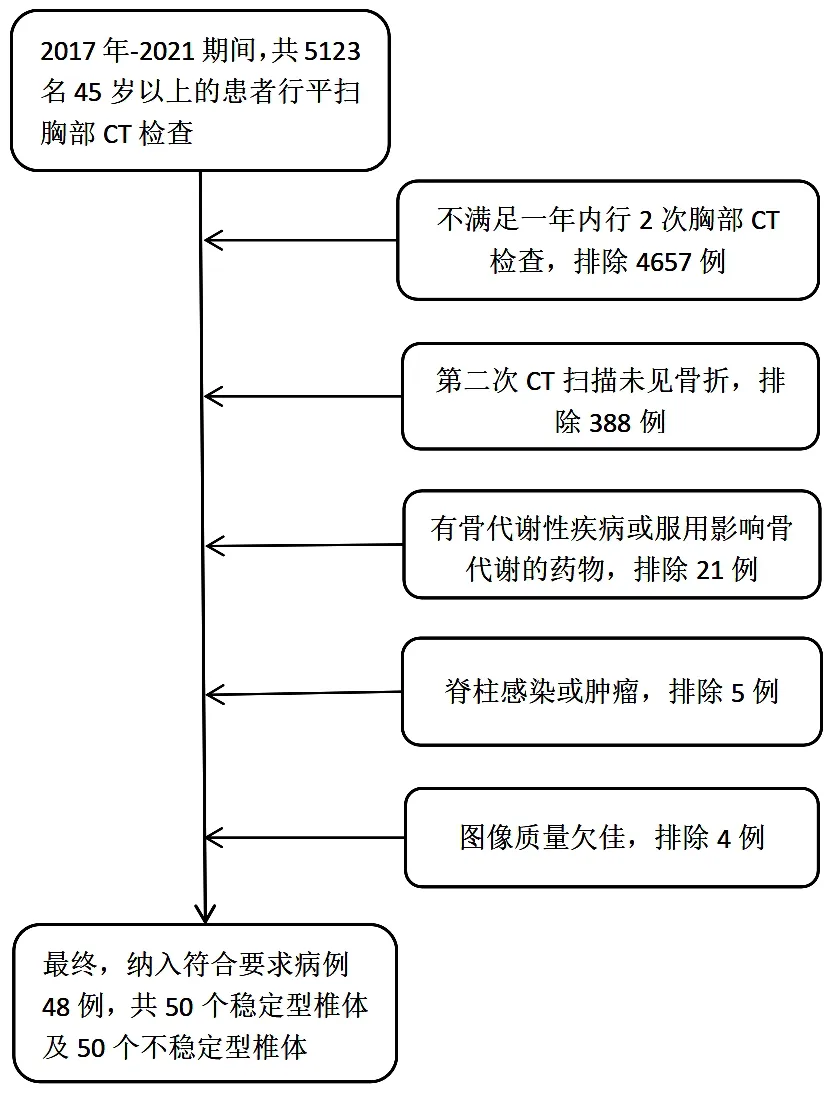
图1 病例选择流程图
稳定型、不稳定型椎体定义:患者进行了两次以上连续扫描,在第一次扫描椎骨形态正常,若第二次扫描发生骨折,则为不稳定型椎体,若第二次扫描未发生骨折,同时第三次扫描也未发生骨折,则为稳定型椎体。
1.2 方法
本研究拟进行两项配对对照研究。方法A:把将会发生骨折的不稳定型椎体与对照组进行对照研究。方法B:将同一患者骨折前的稳定椎体和不稳定椎体的组学特征进行对照研究,判定组学特征模型能否预测椎骨骨折。这两种方法均使用传统组学方法对椎骨进行分析。图2描述了A和B两种不同的研究方法。

图2 两种不同的研究方法流程图
1.3 CT数据收集及其后处理
图像来源于不同的CT机型:西门子双源SOMATOM Force64、东 软NeuViz128、GE LightSpeed16、东 芝Aquilion ONE 320。轴位图像的厚度为1~3 mm,千伏峰值(kVp)在90~140之间。不包括低剂量方案。将轴位原始图像从DICOM(.dcm)格式转换为NIFTI(.nii)格式保存,导入ITK-SNAP 3.6软件中,对胸椎CT平扫图像中的三维感兴趣区(ROI)逐层勾画。所有胸椎ROI均由医师A(从事放射肌骨工作23年)完成。间隔一个月后,随机选择20个胸椎由医师A和医师B(从事放射肌骨工作9年)分别勾画,分别用于观测者内与观测者间的一致性检验。
1.4 影像组学特征选择与影像组学模型构建
应用Python3.6传统组学PyRadiomics模块进行影像组学特征提取,共提取1 648个特征。
计算组内相关系数(ICC)以评估观察者内和观察者间的一致性,ICC值>0.90的特征将被保留。对符合一致性要求的特征数据进行预处理,包括使用中位数替换异常值及缺失值,然后进行数据标准化,以消除量纲的影响。在完成数据预处理后,使用Spearman等级相关系数(corr>0.90)对特征进行降维,消除冗余和不相关的特征,本研究最后保留了34个特征。然后,对试验组A、B分别采用机器学习算法构建模型。
1.5 统计学方法
采用R语言(版本4.1.3)统计软件进行数据分析。符合正态分布的计量资料以均数±标准差(x-± s)表示,采用t检验;非正态分布计量资料采用中位数、四分位间距表示。计数资料以频数(n)、百分率(%)表示,行χ2检验。P<0.05则差异具有统计学意义。
在所有机器学习算法分类器中,均采用分层抽样的十折交叉验证,其中70%的数据作为训练集,30%的数据作为测试集。用于机器学习算法包括:支持向量机(SVM)、K-近邻(KNN)、决策树(DT)、随机森林(RF)、极度随机树(ET)、极端梯度提升(XGBoost)、LightGBM。采用受试者工作特征(ROC)曲线、曲线下面积(AUC)、准确率、灵敏度、特异度评估影像组学模型预测性能。模型的准确率用柱状图和折线图表示。
2 结果
2.1 研究人群
方法A中,病例组平均年龄(64.5±11.2)岁和对照组的(66.3±12.4)岁差异不显著(t=0.753,P=0.089),性别比例相同(男:女=22:28),对照组选择与病例组相对应的椎体。
方法B中,纳入48例患者的50个稳定椎体和50个不稳定椎体。第一次和第二次扫描之间的平均时间差为(252±89.5)天,第二次和第三次间隔时间(213±154)天。
2.2 诊断模型的建立和验证
在去除了重复性差的特征和冗余特征后,A和B两种方法最终都保留20~40个特征进行分类。在方法A中,病例组和对照组之间存在显著差异,方法B中稳定椎体和不稳定椎体的组学特征之间没有显著差异,见表1。

表1 方法A和方法B验证组结果
在方法A中,使用SVM、KNN、随机森林(Random Forest)、极度随机树(Extra Trees)进行分类的ROC曲线分析得出的AUC值均>0.95,其中Extra Trees最佳,为1.00[95%置信区间(CI),0.99~1.00]。四者之间的AUC之间没有显著差异(P=0.17)。Extra Trees的AUC显著高于决策树(Decision Tree)和极端梯度提升(XGBoost)、LightGBM分类器(P<0.001)。各个机器学习模型的预测正确率如图3所示。图4展示了各个分类器算法的ROC曲线。

图3 方法A中训练组和验证组的诊断正确率

图4 方法A中显示验证组各个诊断模型AUC图
选取诊断正确率>90%的分类器,分别为SVM、KNN、随机森林(Random Forest)、极度随机树(Extra Trees)、LightGBM,去除KNN(由于算法原因无法提取前10的特征),从其他四个机器学习分类器中,各选取前10个特征共40个特征,6/40(15.0%)属于直方图(IH),7/40(17.5%)属于灰度游程矩阵(GLRLM),11/40(27.5%)属于灰度共生矩阵(GLCM),7/40(17.5%)属于自回归模型(AR),9/40(22.5%)属于小波变换衍生特征。
在方法B中,各个分类器算法的ROC曲线分析得出的AUC值均不理想。所有机器学习模型的准确度均较低(范围为0.47~0.76),其中KNN的AUC值最高,为0.71(CI,0.48~0.94)。各个机器学习模型的预测正确率如图5所示。图6展示了各个分类器算法的ROC曲线。

图5 方法B中训练组和验证组的诊断正确率

图6 方法B中显示验证组各个诊断模型AUC图
3 讨论
过往研究表明[1],X线、CT图像上,人眼无法区分骨质疏松时胸椎的骨小梁变化,导致诊断准确率极低。目前,国外广泛使用骨折风险评估工具FRAX[2]。该工具涵盖了12项参数,包括年龄、性别、体质量、身高、既往的骨折史、父母的骨折史、类风湿性关节炎史、糖皮质激素使用史、继发性骨质疏松史、吸烟和饮酒史、骨密度等,可预测10年内骨折发生概率。但有研究表明,其他更简单的模型可能表现更好[3-5]。特别是过去十年,人工智能已为放射学的各个领域带来新的希望,基于HR pQCT数据构建影像组学模型用来区分有无骨质疏松已被证实是有效的。
本研究中,我们选取胸部CT平扫图像中的胸椎为研究对象,试图在不增加辐射剂量和患者经济负担的情况下,构建传统影像组学模型,用来区分椎体有无骨质疏松以及骨质疏松的椎体有无骨折风险。结果,ExtraTrees分类器在识别胸椎有无骨质疏松时,其AUC高达1.00。然而,无论是哪一个分类器都不能仅靠区分椎体有无骨折风险。
本研究中,特征提取和机器学习的结合揭示了在区分椎体骨质疏松时的几个重要组学特征。结晶的平均信号强度是我们分析中最重要的因素之一。这也与文献报道一致,即骨矿化是骨强度的一个重要因素[6]。然而,如前所述[7-9],这类特征具有很好的可重复性,能有效提高所构建模型的诊断效能,可作为骨小梁微结构的代表性特征。
本研究中所提取的一些分类特征,可能与骨质疏松性患者椎体的病理形态学变化相关。熵被认为是骨骼完整性受损[12]。一些小波特征(例如WavEnHLs 2)在我们的分类诊断中也起到重要的作用。小波变换衍生的组学特征可以有效提高X线照片上骨小梁分类的稳定性和准确性[10],它们也有助于CT图像中骨小梁病变的检出。此外,一些GLRLM特征(例如dgr45ShrtREmp)表示在特定方向上具有相同值的连续像素的信息,可以理解为常规图像上等密度线状或条片状影,他与椎体骨小梁的体积呈负相关,而在骨质疏松患者中,椎体骨小梁体积会增大[9,11]。其他的组学特征,如直方图的偏度或峰度,在我们的研究中并没有显示出太多的重要性。
本研究表明,在未来6~24个月内,稳定椎体和不稳定椎体组学特征差异无统计学意义,可能有以下原因:其一,本研究的样本量较小;其二,同一个病人的不同椎体之间,胸椎骨纹理的差异可能会比较小;此外,本文中使用的是传统组学特征的分析方法,可能对微小差异的识别能力有限。若利用最新的预训练模型移植训练或深度学习方法进行研究,其研究结果可能会有所改善。
本研究的局限性。①单中心采集的数据;②这是一项回顾性研究;③本研究中包含的CT图像来源于不同的CT机(CT采集标准不同),这可能会导致组学特征产生偏差。最后,我们构建的机器学习模型没有设立外部验证集,可能存在过度拟合的问题。
综上所述,在体检胸部CT图像中,传统影像组学模型可有效识别胸椎椎体有无骨质疏松。然而,单椎体骨折风险的识别仍然具有挑战性。
