米诺环素改性纯钛抗菌性能及其对人骨髓间充质干细胞成骨分化的影响
2023-02-18窦林波王子佳闫茹茜乔雪张彦聪
窦林波,王子佳,闫茹茜,乔雪,张彦聪
1 德州市人民医院口腔科,山东德州 253000;2 德州市妇女儿童医院口腔科;3 潍坊医学院口腔医学院
纯钛(Ti)因其良好的生物相容性和耐腐蚀性而被广泛应用于外科植入、骨科固定和牙种植体材料[1-3]。随着种植时间延长,种植体被细胞、细胞因子和骨髓腔等包围,骨髓腔内的部分骨髓间充质干细胞逐渐分化为成骨细胞,诱导种植体表面成骨,形成新的骨组织,促进骨愈合[4-7]。然而,钛植入物及周围组织感染仍然是一个难题,由于种植体表面生物膜的形成常导致植入失败[8-10]。因此,钛植入物的抗菌表面改性对于防止细菌的初始黏附和促进骨结合性能具有重要意义[11-14]。米诺环素是第二代半合成四环素广谱抗生素,其抗菌谱与四环素相似,具有较高的亲脂性,组织穿透性强,抑菌效果好。米诺环素特异性地与核糖体的305 亚基结合,并阻止氨基酞tRNA 进入该位点。因此,它阻止了肽链的延伸,抑制病原体的蛋白质合成,并发挥抗菌作用。该药物在低浓度具有抑菌作用,高浓度具有杀菌作用。其抗菌谱包括革兰阳性菌和革兰阴性菌[15-18]。米诺环素可用于慢性牙周炎的治疗,其强大的抗炎特性使其有望用于种植体周围炎的预防[19]。但目前还不能确定米诺环素是否可以作为金属涂层。口腔种植体表面结构及成分对细菌附着的影响及不同种植体对骨结合的影响,目前尚无系统研究[20]。我们开发了一种米诺环素涂层纯钛作为抗菌材料和骨再生诱导材料,使用聚多巴胺(PD)作为米诺环素涂层的涂层介质[21]。2020 年6 月—2022 年2 月,本研究制备并评价米诺环素包被的纯钛的抗菌性能,并探讨其对人骨髓间充质干细胞(hMSC)成骨分化的影响。
1 材料与方法
1.1 材料 Ti片(纯度>99.9%)购自西北有色金属研究院。Tris-HCl 缓冲液购自美国谢尔顿科学公司,Dulbecco 改良Eagle 培养基含有低糖、磷酸盐缓冲盐水(PBS)、胰蛋白酶-乙二胺四乙胺四乙酸溶液、青霉素-链霉素溶液购自美国GibcoBio-Rad实验室,胎牛血清(FBS)购自加拿大Wisent 公司,脑心浸液培养基购自美国BD 公司。光谱仪购自日本Rigaku 公司,扫描电镜购自荷兰FEI 公司,X 射线光电子能谱(XPS)购自日本Rigaku 公司,激光共聚焦显微镜LSM510 购自德国Zeiss 公司,LIVE/DEADBacLaght 细菌活性试剂盒购自美国Invitrogen 公司,厌氧产气袋购自法国梅里埃公司,37 ℃空气孵箱购自上海一恒精密仪器有限公司。
1.2 米诺环素涂层Ti 片(MHCI-Ti)制备 将Ti 片磨碎并抛光至镜面表面,用丙酮、乙醇和蒸馏水超声清洗15 min。将Ti片浸入盐酸多巴胺溶液(2 mg/mL、10 mmol/L Tris-HCl缓冲液、pH 8.5)中,在轨道振动床上以50 r/min 搅拌4 h。彻底冲洗样品,并在蒸馏水中搅拌过夜。将PD 涂层的Ti 片分别浸入100、200、500 μg/mL米诺环素溶液中,分别为100 μg/mL组、200 μg/mL组、500 μg/mL组,在37 °C下孵育过夜。
1.3 米诺环素的定量检测 将涂层后从样品中提取的上清液75 mL 置于96 孔板中,与100 mg/mL 荧光素溶液25 mL 在室温下反应1 min。使用光谱仪测量样品的荧光强度(480 nm 激发波长、520 nm 发射波长)。将每个样品中米诺环素的实际浓度与已知浓度的米诺环素标准品(500 μg/mL)的荧光强度进行比较。通过排除上清液中未反应的米诺环素,计算固定化的米诺环素的量。
1.4 化学成分分析 将MHCI-Ti 在70%乙醇中浸泡15 min 并用紫外线照射,用PBS 冲洗3 次。通过扫描电镜获取Ti 片的表面形貌。采用XPS 分析表面化学成分,用峰值拟合软件分析每个样品的化学成分。
1.5 细菌黏附检测 取样品在24孔板中加入2 mL无菌人工唾液(0.33 g/L 磷酸一钾、0.34 g/L 磷酸二氢钠、1.27 g/L 氯化钾、0.16 g/L 氯化铵、0.58 g/L氯化钠、0.17 g/L 二水合氯化钙、0.6 g/L 硫氰酸钠、0.2 g/L尿素、0.03 g/L葡萄糖、0.002 g/L维生素C、2.7 g/L 黏蛋白,在37 ℃下培养4 h。将抛光的Ti 和MHCI-Ti 培养在含变形链球菌(30 μL)的2 mL 脑心浸液培养基中,由厌氧产气袋来提供厌氧环境,置于37 ℃空气孵箱。每2天用等量的新鲜无菌培养基替换该培养基。7 d 后从培养基中取出单独的样品进行生物膜评价。样品在2.5%戊二醛0.1 mol/L PBS中固定2 h。然后,将样品用(50%、70%、80%、90%和100%)乙醇溶液进行脱水和风干。通过扫描电镜获得Ti薄片的放大图像。检查前给样品涂上20~30 nm的金。用LIVE/DEADBacLaght 细菌活性试剂盒对黏附菌进行染色。将荧光素二乙酸溶液、溴化乙锭各2 μL 混合在1 mL 冷蒸馏水中,将200 μL 最终混合物滴入取样斑块上,0 ℃培养15 min。然后在LSM510上对固定的生物膜进行观察。
1.6 hMSC 培养与成骨分化 在24 孔培养板中,将hMSC 以每孔5×104个细胞分别接种在抛光的Ti、MHCI-Ti(200 μg/mL)上。样品用70%乙醇消毒,用无菌PBS 洗涤2 次,用短波长紫外光照射30 min。将hMSC在正常培养基中培养1天,然后于成骨培养基中(含有15% FBS、1% 抗生素/抗真菌溶液、10 mmol/L β-甘油磷酸钠、50 μg/mL L-抗坏血酸、1×10-7mol/L 地塞米松)培养,隔48 h 补充1 次培养基,持续28 h。
1.7 细胞活力检测 分别于培养第1、4、7 天,采用MTT法,取1.5中培养的细胞,用PBS洗涤,并在添加40 μL(5 mg/mL)MTT的培养基中培养,用400 μL二甲基亚砜溶解4 h内形成的紫色MTT甲瓒晶体,在96孔的100 μL微孔板中测定570 nm波长处的吸光度值。
1.8 碱性磷酸酶(ALP)活性检测 在成骨诱导后的第7、14、21、28天,取1.5中培养的细胞,与400 μL对硝基苯基磷酸盐(Thermo)在25 ℃下孵育30 min。用95% M-PER 蛋白提取试剂盒(Thermo)和5%蛋白酶抑制剂鸡尾酒(Thermo)提取培养细胞中的总蛋白,用200 μL的氢氧化钠溶液终止反应,测定405 nm波长处的吸光度值,以测定对硝基苯酚的释放量。
1.9 细胞钙沉积检测 采用茜素红染色法。在成骨诱导后第7、14、21、28天,取1.5中培养的细胞,用冰冷的乙醇固定1 h,然后用40 nmol/L 茜素红S 溶液(pH 4.2)处理30 min,茜素红结合钙用10wt%十六烷基吡啶在10 mmol/L 磷酸钠(pH 7.0),室温下提取20 min。在96 孔的100 μL 微孔板中测定570 nm波长处的吸光度值。
1.10 统计学方法 采用SPSS20.0 统计软件。符合正态分布的计量资料以±s表示,两组比较采用t检验;多组比较采用方差分析或重复测量数据的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 MHCI-Ti 的米诺环素定量 100 μg/mL 组、200 μg/mL组、500 μg/mL组最终固定在样品上的米诺环素量分别为1.25、1.90、1.97 μg。200 μg/mL组米诺环素量高于100 μg/mL组(P<0.05),200 μg/mL组米诺环素量与500 μg/mL组比较差异无统计学意义(P>0.05)
2.2 MHCI-Ti 表面的化学成分 扫描电镜图像显示,Ti 和MHCI-Ti 表面形态相似,见图1A。MHCI-Ti表面的N1s(399 eV)峰的强度高于Ti 表面;N1s 和Ti-O-N峰的出现表明PD和米诺环素被成功覆盖,见图1B。
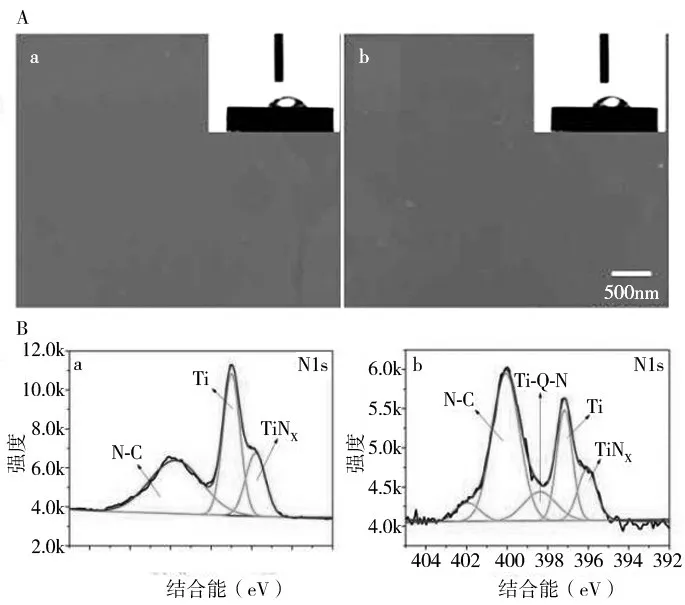
图1 MHCI-Ti的特征
2.3 两种样本细菌黏附情况 变形链球菌在样品上培养7 d 后电镜下观察到大量的细菌簇,见图2A~D,与MHCI-Ti相比,Ti表面附着的细菌相对较多。激光共聚焦显微镜结果显示,Ti表面有一层明显的细菌层绿色细菌层(图2E);MHCI-Ti表面有一层死亡的微生物层(图2F-H),其中MHCI-Ti(200 μg/mL组)完全为红色,表示其抗菌性能最高(图2G)。

图2 培养第7天电镜下及共聚焦荧光显微镜下变形链球菌的情况
2.4 两种样本hMSC 的活力和成骨分化 Ti 与MHCI-Ti 表面的hMSC 活力、ALP 活性、钙沉积比较 见表1~3。
表1 Ti与MHCI-Ti的hMSC活力比较(± s)
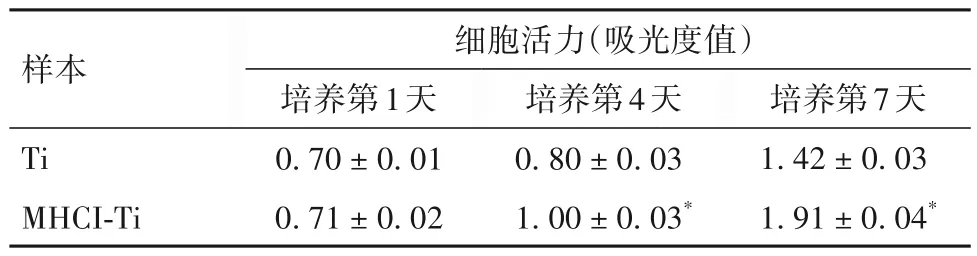
表1 Ti与MHCI-Ti的hMSC活力比较(± s)
注:与Ti比较,*P<0.05。
3 讨论
表2 Ti与MHCI-Ti的ALP活性比较( ± s)
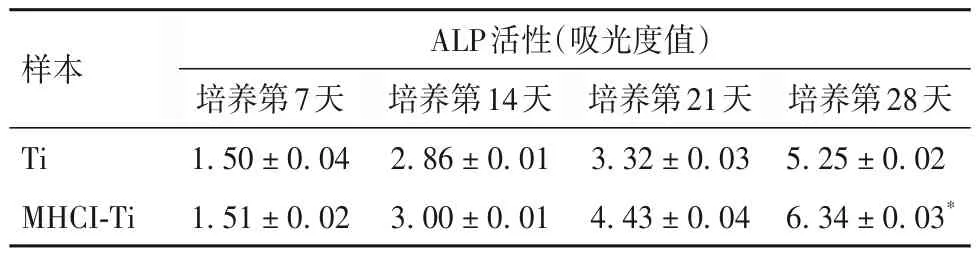
表2 Ti与MHCI-Ti的ALP活性比较( ± s)
注:与Ti比较,*P<0.05。
表3 Ti与MHCI-Ti的钙沉积比较(± s)
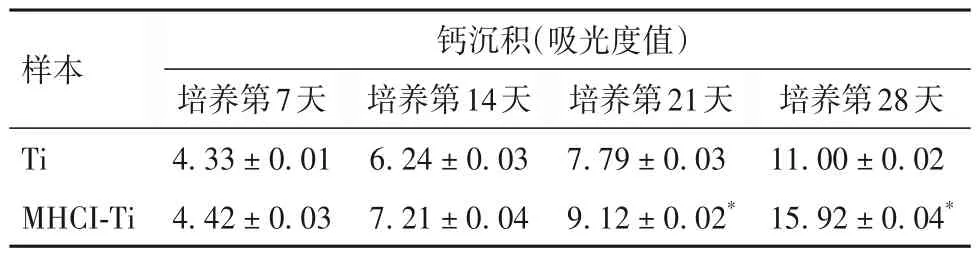
表3 Ti与MHCI-Ti的钙沉积比较(± s)
注:与Ti比较,*P<0.05。
Ti 种植体被广泛应用于临床骨科材料中,牙种植体是其中之一[22]。然而,种植体的使用会导致种植体相关的感染,最终种植体松动甚至脱落。种植体周围的稳定性取决于周围骨组织和软组织的稳定性,特别是骨组织的稳定性,这主要取决于骨结合的过程[23]。口腔的内部环境特别适合病原微生物的定植和繁殖,降低种植体骨结合能力和愈合速度,周围软组织的稳定性被破坏,形成种植体周围炎,进一步影响种植体修复的疗效。菌斑生物膜是一种细菌性生物膜,为基质包裹的互相黏附或黏附于口腔内牙面、牙间或修复体等硬质表面的软而未矿化的细菌性群体[24-25]。细菌在菌斑生物膜内进行复杂的生长代谢活动,并且凭借生物膜这种独特结构能够牢固附着,难以被清除;菌斑生物膜能抵抗宿主防御或抗生素等杀灭作用;还能使其中的各种细菌在合适的微环境下发挥不同的致病作用。以口腔种植体为代表的生物材料一经植入口腔中,菌斑即开始在其表面形成。成熟的龈上菌斑引起龈炎,并会影响龈下菌斑的形成,在可疑致病菌的参与下,会导致牙周炎或种植体周围炎[26]。由纯Ti 制作的种植体系统的基台、体部的穿龈部分以及连接处常暴露于口腔复杂的环境中,易因物理、化学、生物及机械等因素的损伤,造成其表面粗糙度的增加,进而促进细菌的黏附和菌斑生物膜形成、生长。菌斑生物膜的存在及种植体腐蚀是导致种植体周围炎发生的两个重要激发因素[27-28]。因此对纯Ti 进行表面改性,提高其抗菌性能,创造一种可减少细菌黏附的新型表面意义重大。为了解决种植体周围炎的问题,我们对纯钛种植体进行了表面功能化修饰,以实现抗菌效果,增强骨结合能力。在本研究中,我们开发了MHCI-Ti作为抗菌材料和骨再生诱导材料。多巴胺能够通过其邻苯二酚或醌基官能团共价接枝米诺环素上所富含的亲核基团(如氨基)。将Ti 片浸入盐酸多巴胺溶液中继而接枝米诺环素。采用XPS分析表面化学成分,发现MHCI-Ti表面的N1s(399 eV)峰的强度高于Ti 表面和Ti-O-N 峰的出现表明PD 和米诺环素素被成功包被在Ti表面。
链球菌属通常是口腔内主要的定植菌群,最早定植于口腔内,且为龈上菌斑生物膜的优势菌群。牙周菌斑内的细菌绝大多数正常菌群,不会造成宿主致病。只有在致病菌的参与下才会引发种植体周围炎。因此本研究采用变形链球菌菌株来模拟致病性的菌斑生物膜,考察菌斑生物膜在的Ti 和MHCITi 表面的黏附情况。结果显示,MHCI-Ti 具有较低的细菌黏附率。
种植体的远期成功率与种植体材料的成骨诱导活性密切相关。ALP活性是成骨细胞基质成熟的标志,是成骨细胞分泌骨基质继而矿化的功能活性酶。因此ALP 是目前检测成骨细胞分化的主要特征酶之一。ALP 主要存在于胞质中,它可使无机磷酸盐水解,从而降低焦磷酸盐浓度,增加局部无机磷酸浓度,促进骨的矿化。因此,ALP可以作为反映骨形成的标志物。我们通过检测碱性磷酸酶活性和钙沉积来比较Ti 和MHCI-Ti 的成骨活性。结果表明,MHCI-Ti 促进hMSC 成骨分化。当hMSC 在MHCI-Ti上培养28 d 后发现,ALP 活性和钙沉积显著增加。提示这种材料是骨修复和牙种植体的理想材料。
本研究结果表明,纯Ti 种植体表面涂层米诺环素可以增强种植体骨整合,可用于预防种植体周围炎。然而,常规使用局部抗生素以增强骨整合或预防感染是有争议的,并可能增加耐药风险[29]。因此下一步研究有必要对种植体早期感染模型进行分析,以探索米诺环素改性种植体的适应证。
