EXCAP锻炼在多发性骨髓瘤化疗所致周围神经病变患者中的应用研究
2023-02-17徐丽珍孙彩虹杜锋蔚罗皓蔚黄丽华
徐丽珍,孙彩虹,杜锋蔚,罗皓蔚,施 慧,殷 钰,黄丽华
浙江大学医学院附属第一医院,浙江杭州 310003
多发性骨髓瘤是起源于浆细胞的恶性克隆性疾病,能破坏人体造血功能及骨骼、肾脏等系统,愈后不良,好发于老年人,发病率逐年增高,占所有恶性肿瘤的1%,占血液系统恶性肿瘤的10%,居第二位[1]。以硼替佐米为基础药物的联合化疗可以显著提高疾病缓解率并延长患者生存期,但其最主要的不良反应是引起周围神经病变[2]。研究[3-4]显示,多发性骨髓瘤患者化疗所致周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)发生率为50%~81%,症状复杂多样,化疗结束后症状可持续存在,影响患者生活质量,严重时会导致药物使用剂量减小、延迟治疗甚至停药[5-7]。当前干预CIPN的方法以营养神经和止痛对症处理为主,但效果局限[8-9]。研究[10]提出,癌症患者运动(exercise for cancer patients,EXCAP)能有效减轻实体肿瘤患者化疗所致的周围神经病变程度,是一种个性化、循序渐进、无需监督、低至中等强度的居家有氧联合抗阻运动。本研究将EXCAP锻炼引入多发性骨髓瘤化疗所致周围神经病变患者的管理中,探讨该运动方案对血液病患者的实践效果,以期促进患者康复。
1 对象与方法
1.1 研究对象
采用便利抽样法,选取2021年1月至12月,在浙江大学医学院附属第一医院血液科接受以硼替佐米为基础药物化疗后出现周围神经病变的多发性骨髓瘤患者86例为研究对象。纳入标准:符合《中国多发性骨髓瘤诊治指南2020》多发性骨髓瘤的诊断标准[11],并且使用以硼替佐米为基础药物的化疗方案至少2个周期;使用美国国立癌症研究所研制的药物毒性判定标准(National Cancer Institue-Common Toxicity Criteria,NCI-CTC)4.0版评定周围神经病变分级处于2~3级[12];美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能分级标准评分0~1分;年龄18~70周岁,同时具备能准确理解研究者相关问题的能力;知情同意并自愿加入本研究。排除标准:具有明显精神疾病患者;有严重心肺功能、肝功能不全者,接受血液透析者;有糖尿病病史、静脉血栓、3个月内骨折病史,严重骨质疏松、肢体功能活动障碍的患者。剔除标准:患者未完成EXCAP锻炼方案的90%。本研究已通过所在医院临床研究伦理委员会伦理审查,批件号:(2021)IIT快审第(110)号。以避免研究对象间相互影响,遵循同期对照原则,按患者收治不同病区进行分组。
1.2 干预方法
1.2.1对照组
对患者实施多发性骨髓瘤化疗常规护理。药物使用:遵医嘱口服甲钴胺片(每片0.5 mg),每次1片,3次/d;硼替佐米采用皮下注射方式给药。指导患者自我评估周围神经病变症状;给予患者日常生活指导、饮食指导、安全指导,加强心理护理等。
1.2.2试验组
在对照组的治疗和护理基础上借鉴EXCAP锻炼方案[10],根据多发性骨髓瘤的疾病特点对训练方案进行修订并实施。
1.2.2.1 修订EXCAP锻炼方案
针对多发性骨髓瘤患者易发生骨折的特点,讨论分析EXCAP锻炼处方运动机制。由于CIPN患者可出现下肢麻木无力,为保证运动安全,锻炼方案中第一部分有氧运动项目不考虑步幅、步速及行走距离,以步数作为锻炼指标。锻炼方案的第二部分为使用渐进式弹力带抗阻训练,首先由康复医学医生正确演示每一个抗阻动作,根据人体力学进行分析,剔除了划船运动、躯体侧弯、深蹲、扩胸这4个对多发性骨髓瘤患者具有潜在骨折风险的动作,初步保留了针对肱二头肌、肱三头肌、臀部肌群及下肢肌群所设定的6个动作清单。运动频率每周5次,持续6周作为一个疗程。研究者对10例患者进行预试验,6周后予以效果评估并根据患者反馈意见进行第2轮锻炼方案修订。新修订的EXCAP锻炼方案中第一部分有氧运动仍为步行,锻炼开始前先测评患者步行基数,干预1周后鼓励患者每周锻炼日步数在上周平均数上递增10%。第二部分抗阻训练中最终保留坐姿抬腿、坐姿踢腿、坐姿手臂抬举、立位手臂抬举4个动作结合拉伸弹力带,运动方式、方法、强度见表1。抗阻运动由康复医学医生正确演示并录制视频。
1.2.2.2 实施EXCAP锻炼方案
发放运动工具包。每个工具包里含3根不同颜色的弹力带(每根长1.8 m、宽0.15 m,阻力程度以拉伸1倍长度为参考,按照阻力从小到大排列依次有:红色3.7磅、绿色4.6磅、蓝色5.8磅)、1个计步器、1份运动注意事项宣教单、1份步行记录清单、1个运动视频扫描二维码。研究者指导患者工具包内物品使用方法。每周运动5 d,化疗日及次日休息,连续6周为一个锻炼疗程。步行基数测量方法:干预正式实施前患者起床后腰间佩戴计步器,连续4 d记录日常步数,再根据这4 d的平均步数作为第一周锻炼日行走的基数;渐进式抗阻力训练采取4个动作,结合适合患者力量的弹力带,一举一回为一个完整动作,拉伸过程中需保持肌肉紧张感3 s,然后放松3 s,单个动作重复10~15次,每组动作完成后间歇3 min,一次运动需20~40 min,患者也可根据自身体力在1 d内分次完成。弹力带阻力大小选择以患者运动过程中稍微出汗或稍感吃力为宜。嘱患者运动时着宽松衣物和防滑鞋,选择安全的场所,避免人多、空气差的环境,抗阻运动选择在两餐之间进行,当患者出现冒冷汗、头晕、心慌、胸闷、疼痛等不适立即停止运动,在运动记录清单上备注并及时联系研究者。每周对患者进行2次随访,1次为入院化疗时,另1次微信或电话询问患者居家锻炼情况,确保患者能适应每周的运动任务。
1.3 研究工具
1.3.1一般资料调查表
通过查阅文献,研究团队讨论后设计一般资料调查表,内容包括人口社会学资料(性别、年龄、职业状况、受教育程度等)及疾病相关资料(化疗方案、化疗周期、周围神经病变持续时间等)。
1.3.2NCI-CTC 4.0版[13]
该量表常用于评估化疗患者用药安全性,从感觉神经和运动神经病变后的症状是否造成躯体功能障碍,对日常生活能力的影响两个维度评估。每个维度从0级(正常)到5级(死亡)描述。周围神经病变程度评判,恶化:神经毒性分级上升;无效:神经毒性分级未改变;改善:麻木、疼痛、感觉异常等症状好转,神经毒性分级下降。
1.3.3疼痛数字评定量表(Numerical Rating Scale,NRS)
NRS为0~10分11个数字,0分为无痛、1~3分是轻度疼痛(能忍,不影响睡眠)、4~6分是中度疼痛(影响睡眠)、7~10分是重度疼痛。数字越大,则表示疼痛越明显。
1.3.4癌症治疗相关神经毒性功能评估量表(Functional Assessment of Cancer Therapy /Gynaecologic Oncology Group-Neurotoxicity Scale,FACT/GOG-Ntx)[14]
该量表包括感觉、运动、听觉、功能障碍4个维度(11个条目),采用Likert 5级评分,从“没有”到“非常严重”依次记为0~4分,总分为0~44分,得分越高表明CIPN症状越严重,对日常生活质量的影响也越大,Cronbach’s α系数为0.82~0.89。
1.3.5匹兹堡睡眠质量指数量表(Pittsburgh Sleep Quality Index,PSQI)
该量表从主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、使用催眠药物以及日间功能障碍7个维度评估成年人睡眠质量。每个维度得分为0~3分,总分为0~21分,得分越高表示睡眠质量越差。0~5分,睡眠质量很好;6~10分,睡眠质量还行;11~15分,睡眠质量一般;16~21分,睡眠质量很差。本研究以PSQI评分>7分为临床界定患者存在睡眠障碍。刘贤臣等[15]进行信效度检验发现,该量表的内部一致性α系数为0.842。
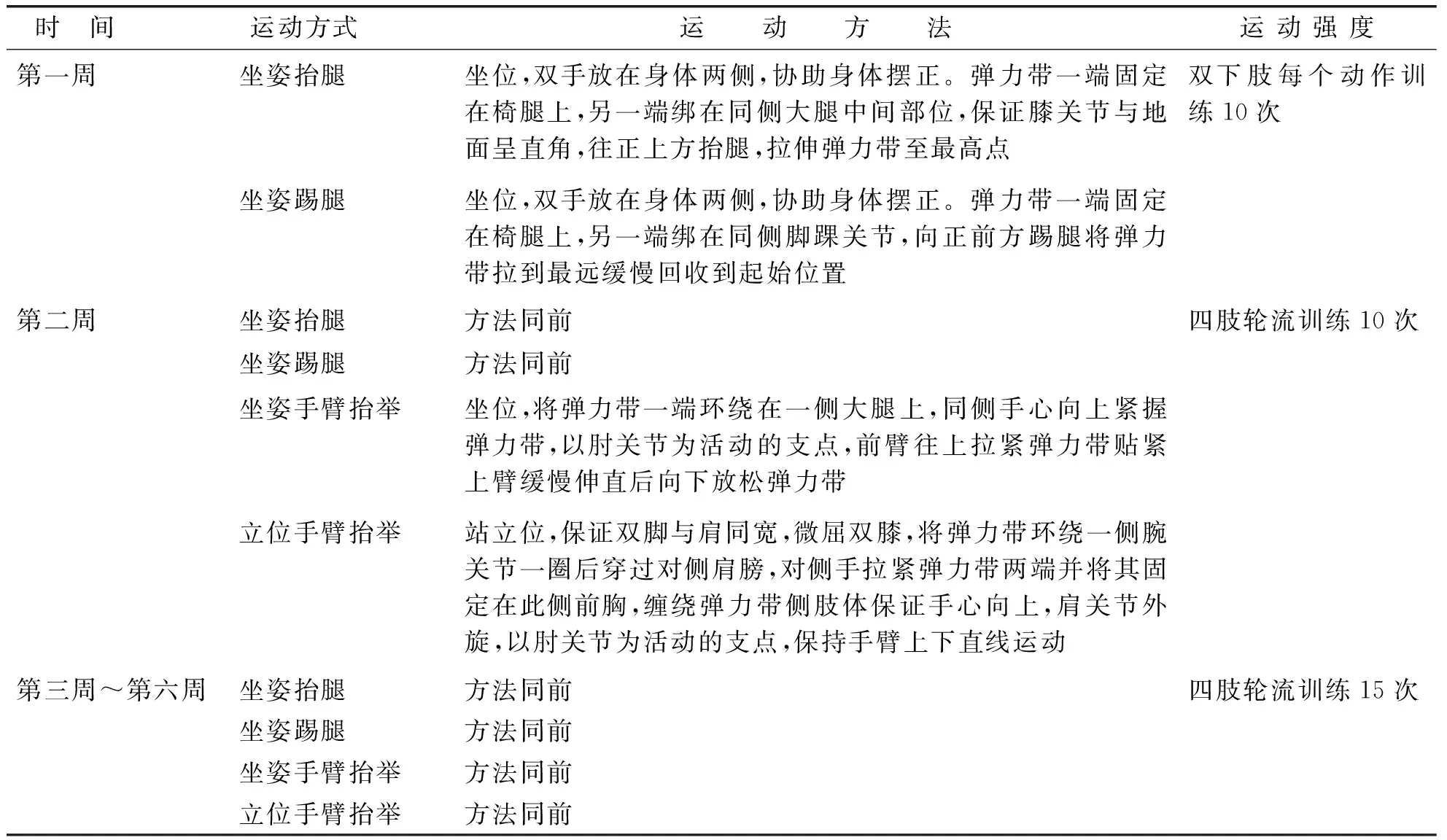
表1 修订后EXCAP锻炼方案(第二部分:抗阻运动)
1.4 资料收集方法与质量控制措施
由进行统一培训过的研究组内专职调查者收集问卷。其中一般资料调查量表干预前收集一次,其他测评工具分别在干预前和干预后6周共收集2次。调查人员对患者进行一对一指导,完成量表填写时间约为20 min。除NCI-CTC 4.0版由经管医生评估外,其他调查表由患者填写,由于客观原因无法亲自填写的由调查者在无诱导情况下为患者阅读并协助填写。量表回收时再次核对患者相关信息以确保无误。研究者和调查者进行双人核对问卷并分类登记。
1.5 统计学方法
使用SPSS 23.0软件进行数据统计分析。计数资料(性别、受教育程度、化疗方案、CIPN病程等)采用例数(百分比)描述,组间比较采用x2检验。计量资料(年龄,两组患者之间以及干预前后的FACT/GOG-Ntx症状评分、NRS、PSQI等)采用均数±标准差或中位数(四分位间距)描述,对于正态分布的数据采用两独立样本t检验;NCI-CTC 4.0版周围神经病变分级属于非正态分布,采用Mann-WhitneyU检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者一般资料比较
本研究共纳入试验组和对照组各43例,两组患者一般资料具有可比性,见表2。
2.2 两组患者干预前后NCI-CTC 4.0版周围神经病变程度比较
两组患者干预前后周围神经病变程度比较差异有统计学意义(P<0.05),见表3。

表2 两组患者一般资料比较
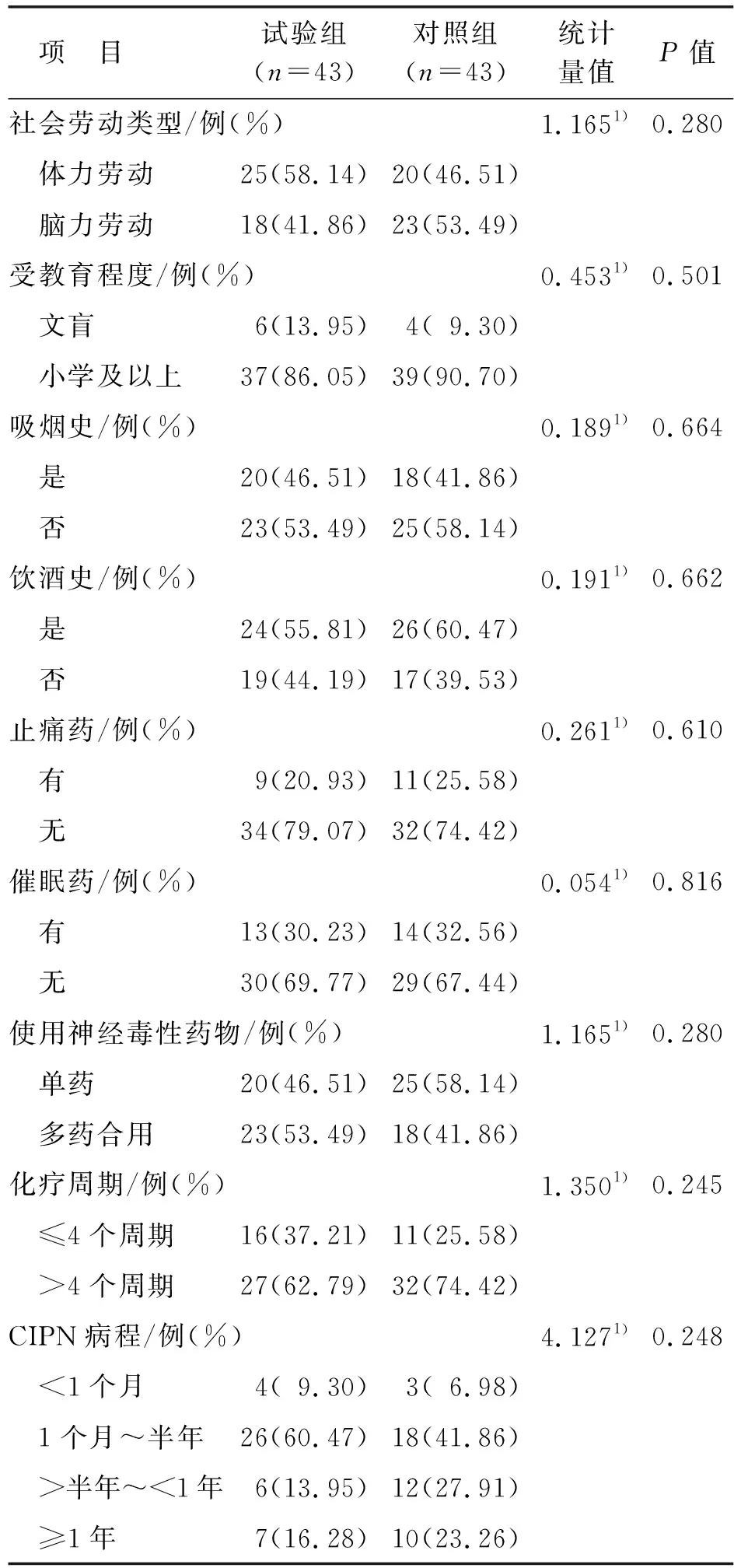
表2(续)
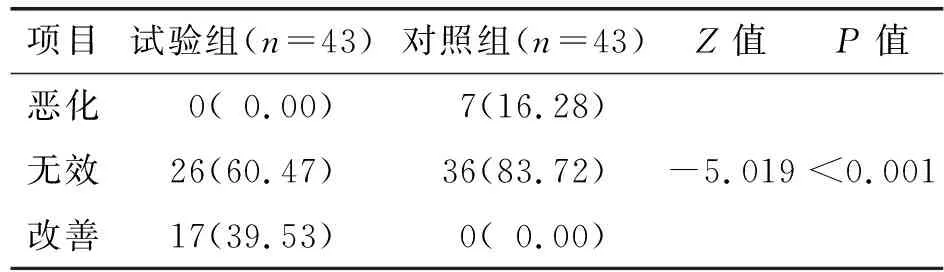
表3 两组患者干预前后NCI-CTC 4.0版程度比较 例(%)
2.3 两组患者干预后NRS评分比较
两组患者干预前后神经疼痛NRS评分及干预差值比较差异有统计学意义(P<0.05),见表4。
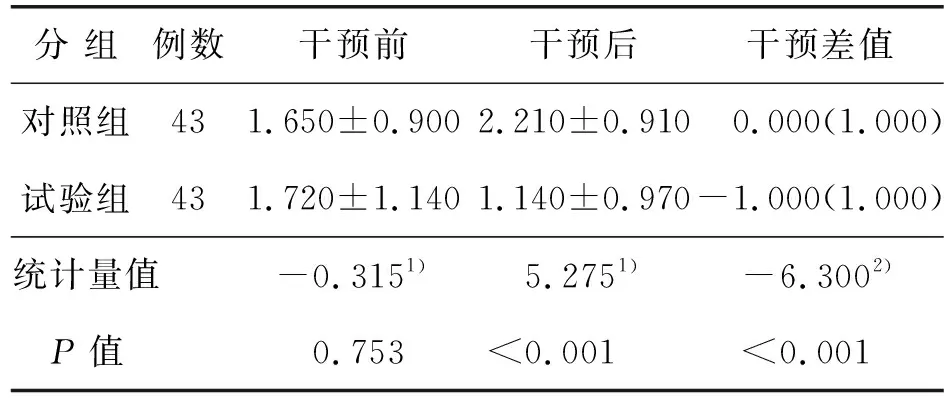
表4 两组干预前后NRS评分比较
2.4 两组患者干预前后CIPN的症状比较
两组患者干预前后FACT/GOG-Ntx总分、维度得分及干预差值比较差异有统计学意义(P<0.05),见表5。
2.5 两组患者干预前后睡眠状态比较
两组患者干预前后PSQI总分、各维度得分及干预差值比较差异有统计学意义(P<0.05),见表6。
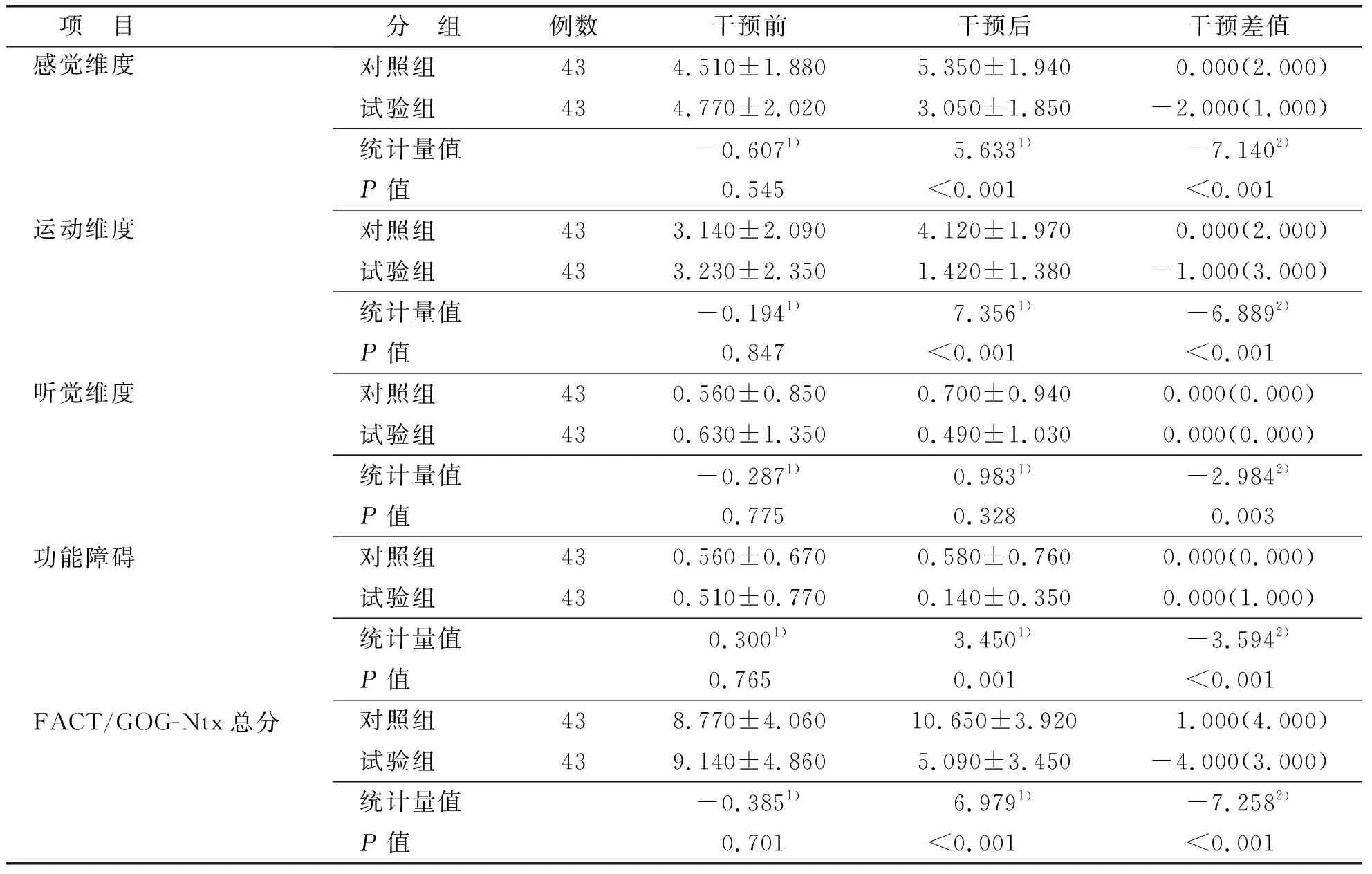
表5 两组患者干预前后FACT/GOG-Ntx得分比较
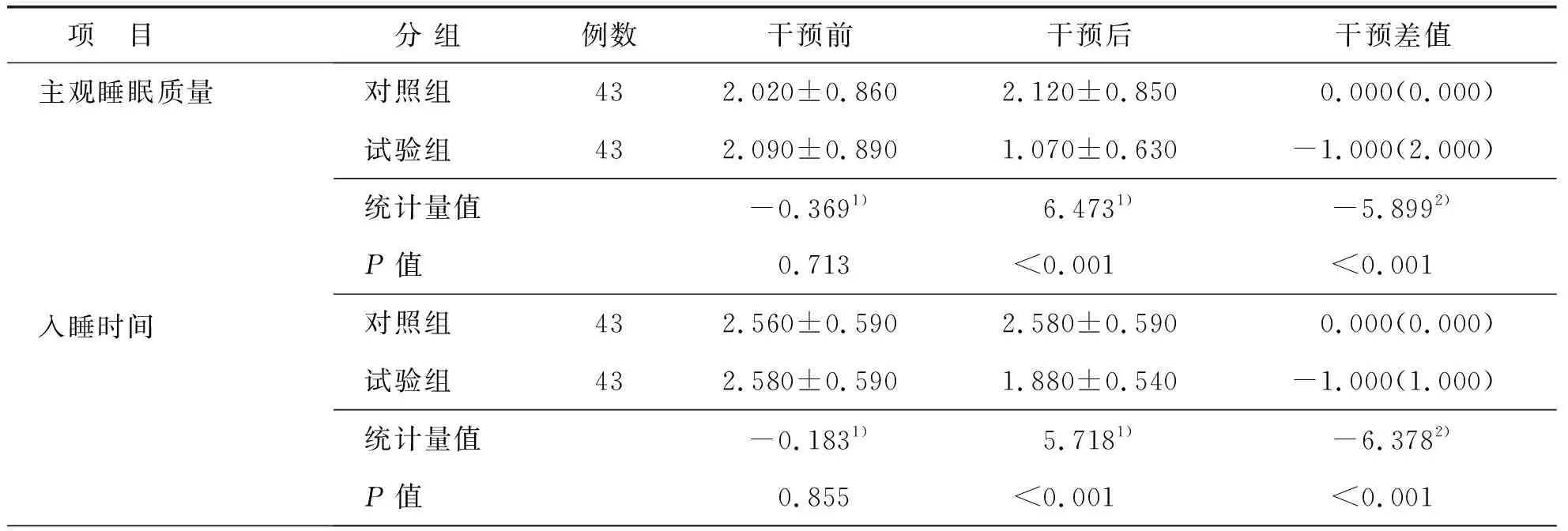
表6 两组患者干预前后PSQI评分比较
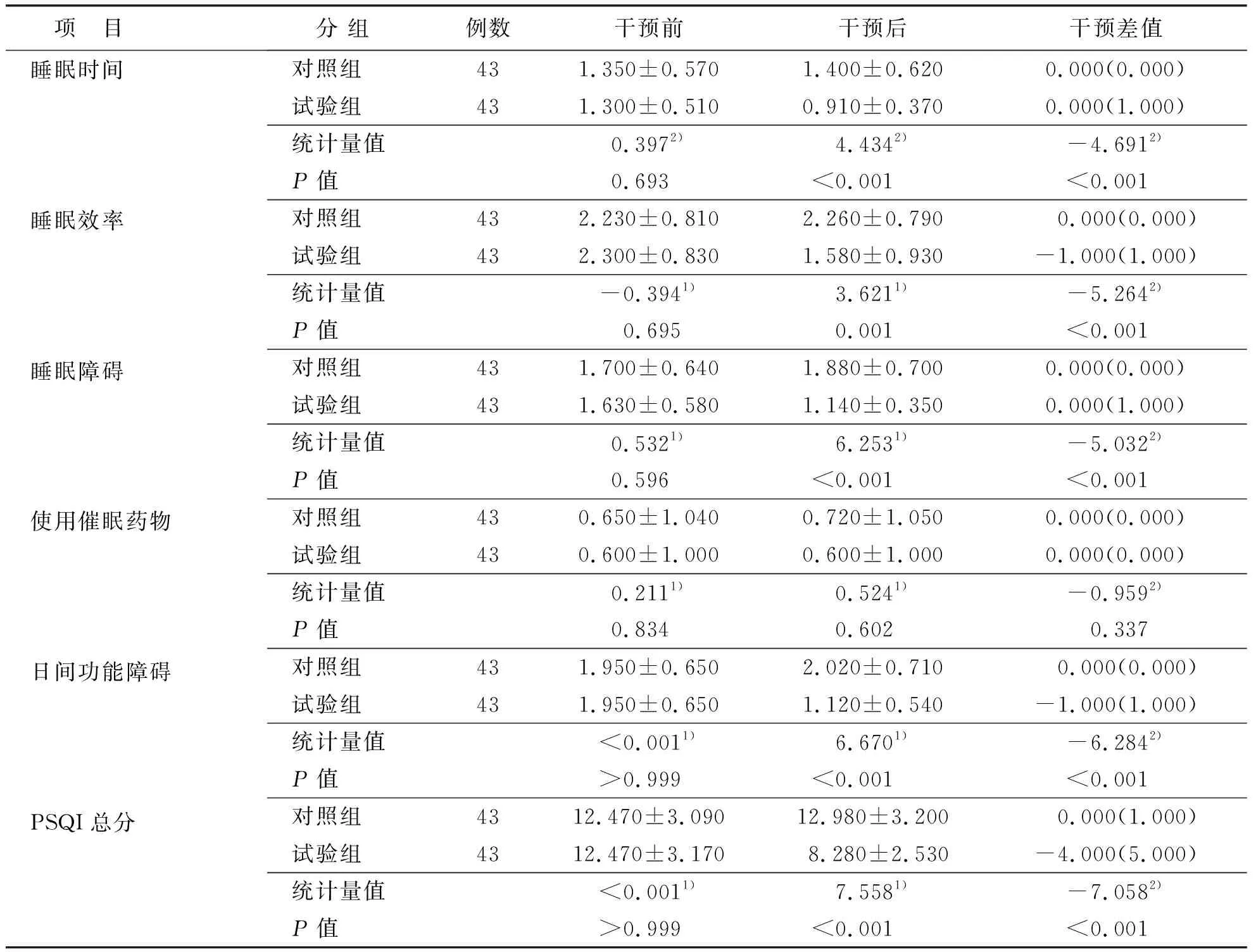
表6(续)
3 讨论
3.1 EXCAP锻炼能减轻多发性骨髓瘤CIPN症状程度
本研究结果显示,干预后试验组与对照组的FACT/GOG-Ntx总分分别为(5.090±3.450)分、(10.650±3.920)分,t=6.979,P<0.001,试验组NCI-CTC 4.0程度优于对照组(P<0.001),与黄孟秋[16]在妇科肿瘤CIPN患者中实施运动疗法的结果一致。Kleckner等[10]对170例肿瘤化疗患者行6周EXCAP锻炼后,试验组四肢麻木刺痛症状及双下肢无力程度比对照组下降,且老年男性患者的获益感强于其他组别。Streckmann等[17]对30例CIPN患者实施6周,每周2次运动训练,发现手足麻木症状明显缓解。研究[18-19]证明,运动疗法可减轻化疗相关周围神经病变症状,降低CIPN的发生率。多发性骨髓瘤化疗相关周围神经病变主要原因有:硼替佐米改变神经元细胞代谢,造成线粒体和内质网损伤,抑制神经生长因子释放;沙利度胺抑制毛细血管生成,导致神经纤维缺血低氧[20]。EXCAP锻炼能改善CIPN的可能机制:有氧运动加速血液循环,清除神经毒性,促使神经生长因子释放[21-22];抗阻运动刺激毛细血管生成,增加末梢循环中血氧含量,促进受损神经纤维再生,提高正常神经纤维的代偿能力[23]。步行是最常见的有氧运动方式,安全简单、患者接受度高;使用弹力带抗阻训练,携带方便,锻炼场地不受限制。此外,本研究发现患者听力损害没有改善,这与化疗引起的耳毒性仍以药物治疗为主观点一致。由于多发性骨髓瘤患者发生骨折的风险较高,缺乏大样本量的运动研究,在借鉴国内外高质量研究基础上,要严格评估患者身体状况。本研究中,患者未发生安全不良事件。
3.2 EXCAP锻炼能降低多发性骨髓瘤患者的疼痛水平
本研究结果显示,干预后试验组与对照组神经疼痛NRS评分分别为(1.140±0.970)分、(2.210±0.910)分,t=5.275,P<0.001,与彭玉晓[24]对CIPN患者进行运动研究后效果相似。CIPN患者会出现四肢肢端针刺样、烧灼样、蚁爬样疼痛以及肌肉酸痛等不适[25]。Dhawan等[26]研究,对19例CIPN患者作为试验组在家中进行中等水平力量和平衡运动训练,每周5 d,每天30 min,持续10周后评估周围神经疼痛水平,结果显示锻炼能减少化疗引起的周围神经疼痛程度。 Kanzawa等[27]研究结果提示,有氧运动对化疗药物引起的手指镇痛效果明显。运动可以减轻机体炎症反应,使机体通过中枢敏化过程,减少神经源性疼痛因子的产生和对神经根的刺激;血液循环改善后加速了对致痛化学介质(组织胺类等)的稀释和迅速排除,缓解或解除疼痛,刺激内源性阿片类物质及5-羟色胺产生,起到镇痛作用[28-29]。另外,可能与运动锻炼转移了患者对疼痛的注意力,减轻其心理紧张、焦虑程度有关。
3.3 EXCAP锻炼能提高多发性骨髓瘤CIPN患者的睡眠质量
本研究结果显示,试验组PSQI总分(8.280±2.530)分,明显低于对照组总分(12.980±3.200)分,t=7.558,P<0.001,与张丽凤等[30]在老年肺癌化疗患者中实施有氧加抗阻运动后的研究结果相吻合。研究[31-32]指出,多发性骨髓瘤患者因疾病本身、医疗费用、焦虑情绪等原因存在睡眠障碍。其他学者[33-34]也指出,麻木、疼痛等不适症状通常会在夜间加剧,引起睡眠困扰。有研究[35-36]显示,有氧联合抗阻运动有利于癌症患者恢复睡眠,减轻疼痛,且血液病患者进行中低水平运动后有利于睡眠障碍及癌性疲乏的恢复。本研究结果显示,两组患者在干预前均存在较重的睡眠障碍,干预后试验组患者睡眠功能和整体生活质量优于对照组。这表明EXCAP锻炼能有效改善患者的睡眠状况,其原因可能是适度的有氧联合抗阻运动有效激发机体主动睡眠机制正常化,提高荷尔蒙水平,增加夜间睡眠时间;促进机体分泌内源性大麻素和内啡肽,缓解焦虑紧张状况[37]。本次研究还发现,患者经过运动干预后对催眠药物的依赖程度并未明显下降,这可能与多发性骨髓瘤化疗方案需要间断性使用激素,同时本研究中纳入的对象口服催眠药物目的以改善使用激素当晚引起失眠为主,与长期依赖催眠药物患者较少有关。本研究中,试验组PSQI总分仍高于常模,后续研究中需通过延长运动疗程观察效果。
