电沉积法构建AChE/COD@AuNPs共固定化酶生物传感器差分脉冲伏安法快速检测有机磷农药
2023-02-17李虹佳辛嘉英
王 艳,赵 宁,李虹佳,王 悦,辛嘉英,张 娜
(哈尔滨商业大学食品工程学院 哈尔滨 150076)
如今,随着各种工艺生产量的提高,对农药的需求也日益增多[1-3]。 有机磷农药(OPPs)因具有高效的杀虫性和低廉的价格而被广泛使用,其是一种含矿物质元素——磷的有机化合物,将其适当地应用于农作物中,可保证农作物产量稳定[4-6]。然而,当有机磷在农作物及果蔬中残留过量时,人类食用后会导致急性中毒,还会导致癌症、突变的发生,因此,有机磷农药残留量的高效、快速检测成为近年来的研究热点[7-9]。 目前普遍采用气相色谱法[10]、高效液相色谱法[11]和快速酶抑制检测法[1]检测有机磷,然而,这些方法所用仪器昂贵,需要专业人员操作,并且易被干扰,灵敏度低,需要较复杂的有机溶剂进行前处理,不能用于现场检测[12-13]。为此,研究一种成本低,操作简单,节省时间的新型快检技术尤为重要。电化学方法具有反应迅速,使用便捷,检测准确等优点,并因灵敏度高、选择性好而备受关注[14-15]。 已成为组分分析的重要方法,并且广泛应用于环境、生物和医药领域[16]。
天然酶在温和适宜的条件下,可以高效催化各类生物化学反应,具有高特异性、底物专一性和高选择性等特点[17-19]。 而活性易受环境影响,并且制备成本高,价格昂贵等缺陷使其应用范围受限,利用纳米材料开展酶的固定化研究是近些年的新兴技术[20-24],特别将金纳米粒子(AuNPs)作为固定化酶的载体材料,不仅可以增加固定分子数量,而且其优良的生物相容性,更有利于维持酶分子高级结构的稳定性[25-27]。 同时,AuNPs 可使传感器表面积呈指数增加,从而显著增加其催化效率[28-29]。
本文采用电沉积法构建固定化酶生物传感器,在差分脉冲伏安(DPV)模式下开展有机磷农药的特异性、超痕量反定量检测研究(图1)。 以氯化乙酰胆碱(ATCh)为底物分子,固定化氯化乙酰胆碱酯酶 (AChE-AuNPs) 与固定化胆碱氧化酶(COD-AuNPs)水解ATCh 为基础催化反应,基于层层组装技术将固定化酶共修饰于金电极上,构建固定化酶生物传感器(AChE/COD@AuNPs-Gold Electrode),通过循环伏安法分析双酶生物传感器的构建过程,利用DPV 法确定电化学检测体系的最佳条件,考察峰电流信号下降高度与有机磷农药浓度的线性关系。 通过有机磷农药(OPP)特异性抑制氯化乙酰胆碱酯酶进行水解反应,使产物无法被氧化,电信号下降,进而实现有机磷的快速、超痕量反定量检测。该方法可以弥补目前电化学方法检测有机磷遇到的一些问题,如: 灵敏度低,检测限高等。 同时,也为实现有机磷的现场快速定量检测奠定了理论基础。
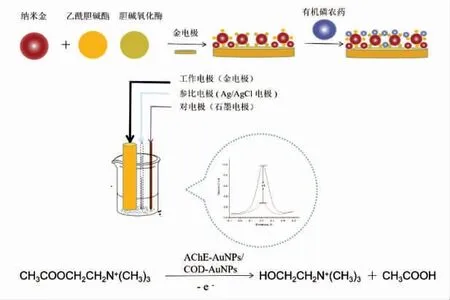
图1 AChE/COD@AuNPs-Gold Electrode 共固定化酶传感器检测有机磷示意图Fig.1 Schematic representation of organophosphorus detection by AChE/COD@AuNPs-Gold Electrode co-immobilized ase sensor
1 材料与方法
1.1 材料与试剂
无水乙醇,上海银典化工有限公司;氯金酸,广州嘉乐化工有限公司; 乙酰胆碱酯酶(AChE)、胆碱氧化酶(COD),上海源叶生物科技有限公司;氯化乙酰胆碱(ATCh)、有机磷(乙酰甲胺磷),济南天佑化工公司;柠檬酸钠、三钾溶液(铁氰化钾、亚铁氰化钾、氯化钾)、磷酸盐缓冲溶液(PBS),厦门海标科技有限公司;分析纯离子溶液(Pb2+、Cu2+、Hg2+、Cr6+、Fe3+、Zn2+)。
1.2 仪器与设备
PHS-3C pH 计,上海仪电科学仪器股份有限公司; 场发射高分辨透射电镜,日本JEOLJEM-2100F;Ag/AgCl 电极(3.4 mol/L KCl 溶液)、铂丝电极、金电极、CS350M 电化学工作站,上海辰华仪器有限公司。
1.3 方法
1.3.1 试剂的配制
1.3.1.1 纳米金的制备 采用柠檬酸钠还原法制备纳米金,利用公式得出纳米金的平均粒径为13 nm。
1.3.1.2 磷酸盐缓冲溶液(PBS)的配制 取8 g 的NaCl、0.2 g 的KCl、2.24 g KH2PO4以 及1.44 g 的Na2HPO4配制浓度为0.1 moL/L 的pH 范围为7.2~8.2 的PBS 缓冲溶液,储存备用。
1.3.1.3 三钾溶液的配制 电解液为三钾溶液,即将5 mmol/L 铁氰化钾、3 mmol/L 亚铁氰化钾和0.1 mol/L 氯化钾三者充分混匀配制而成。
1.3.2 固定化酶的制备与表征
1.3.2.1 乙酰胆碱酯酶的固定化 将2 mL 质量浓度为2.5 mg/mL 的乙酰胆碱酯酶液和2 mL 粒径为13 nm 的纳米金溶液置于10 mL 具塞三角瓶中充分混匀后密封,于30 ℃恒温培养箱中静置4 h,完成固定化乙酰胆碱酯酶的制备。
1.3.2.2 胆碱氧化酶的固定化 同1.3.2.1 节的步骤,制备固定化胆碱氧化酶。
1.3.2.3 固定化酶的表征 通过透射电镜对其结构进行表征,判断结合情况,再将两种固定化酶按1∶1 体积比混合制备共固定化酶液。
1.3.3 双酶传感器的制备与表征 本试验以金盘电极为工作电极,银/氯化银为参比电极,铂金电极为对电极,所组成的三电极体系为工作三电极体系,纳米金和共固定化酶溶液,首先将抛光打磨至镜面的裸金电极氮气吹干,分别将AChEAuNPs、COD-AuNPs 和AChE/COD@AuNPs 电 沉积30 圈,选择是否共固定化制备固定化酶生物传感器; 采用循环伏安法对备用金电极修饰固定化酶酶液电沉积30 圈,确定是否起放大电流信号的作用; 在循环伏安法 (CV) 和差分脉冲伏安法(DPV)模式下,对比考察有无氯化乙酰胆碱时,电流的变化; 在开路电位为0.35 V 的交流阻抗法(EIS)模式下,表征双酶生物传感器的构建过程,考察不同酶修饰层数与共修饰固定化酶电沉积圈数对传感器构建情况的影响。 在DPV 模式下,检测传感器催化氯化乙酰胆碱氧化还原反应产生的电流信号强度,通过底物浓度和体系pH 值筛选,确定最佳检测条件。
1.3.4 有机磷的定量检测 在DPV 模式下,基于双酶传感器催化氯化乙酰胆碱水解偶联氧化反应行为的有机磷检测分析。 测试条件为:阶跃高度0.016 v,振幅0.045 v,脉冲宽度0.06 s,取样间隔0.02 s,待氧化电流峰出现后,向体系加入不同浓度的有机磷溶液。 基于有机磷可以抑制氯化乙酰胆碱酯酶的催化活性,导致氯化乙酰胆碱的水解产物胆碱不能被胆碱氧化酶氧化,两步反应叠加峰值会使氧化电流峰值随着有机磷浓度的升高而迅速下降,进而实现有机磷的检测,并确定最佳检测范围。
1.3.5 有机磷检测的抗干扰能力及传感器重复性与稳定性 在氯化乙酰胆碱为底物的检测体系中,采用时间-电流曲线法(I-T 曲线法)捕捉电流信号变化情况,每隔25 s 向检测体系中加入30 μL 有机磷溶液 (100 nmol/L),随后依次加入30 μL 重金属离子 (Pb2+,Cu2+,Hg2+,Cr6+,Fe3+,Zn2+,10 μmol/L)。双酶生物传感器置于4 ℃冰箱中保存7 d 后,对浓度为100 nmol/L 的有机磷溶液进行重复性检测,观察检测结果并计算相对标准偏差。
2 结果与分析
2.1 固定化酶构建机制研究
纳米金颗粒(AuNPs)与氯化乙酰胆碱酯酶功能化纳米金(AChE-AuNPs)和胆碱氧化酶功能化纳米金(COD-AuNPs)的分散性明显不同,而颗粒状态无明显差别(图2)。 AuNPs(a)中AuNPs 颗粒分散均匀且粒径均一,而AChE-AuNPs (b)和COD-AuNPs(c)中AuNPs 表面因修饰了酶分子,抑制了AuNPs 粒子之间的团聚,因而AuNPs 粒径没有增大,然而酶以AuNPs 为骨架会加大AuNPs颗粒间距,因此AuNPs 颗粒分性增强,进而说明酶分子成功固定于纳米金表面。

图2 AuNPs(a)、AChE-AuNPs(b)、COD-AuNPs(c)的透射电镜Fig.2 TEM images of AuNPs (a),AChE-AuNPs (b),COD-AuNPs (c)
2.2 双酶生物传感器构建过程分析
在以氯化乙酰胆碱为底物的检测体系中,当裸金电极表面只修饰AChE-AuNPs 时,在0.23 V电位处氧化峰值为5.31×10-5A; 只修饰了CODAuNPs 时,也在0.23 V 电位处氧化峰值为2.62×10-5A;将两种固定化酶按体积比1∶1 共修饰同一条件下,在相同电位处,电信号的响应值峰值约为8.03×10-5A,因此共修饰所构建出的固定化酶生物传感器电信号响应程度较好,并且电信号峰值在0.23 V 附近叠加传递。
在电解液溶液中,当酶分子被修饰到电极表面后,电流信号会减弱(图3)电阻不断增加(图4),且电流信号的减弱程度和电阻增加的程度均与修饰层数成正比。 在氯化乙酰胆碱为底物的检测体系中,酶修饰层数不能超过2 层(图5 和图6),当增加到3 层时,氧化反应峰信号便显著减弱。这说明酶的修饰量并不是越多越好,过多的酶分子会互相掩盖催化活性中心,且阻碍底物和产物在活性中心上的传质交换,进而减少了氧化还原反应的发生,使得信号减弱。
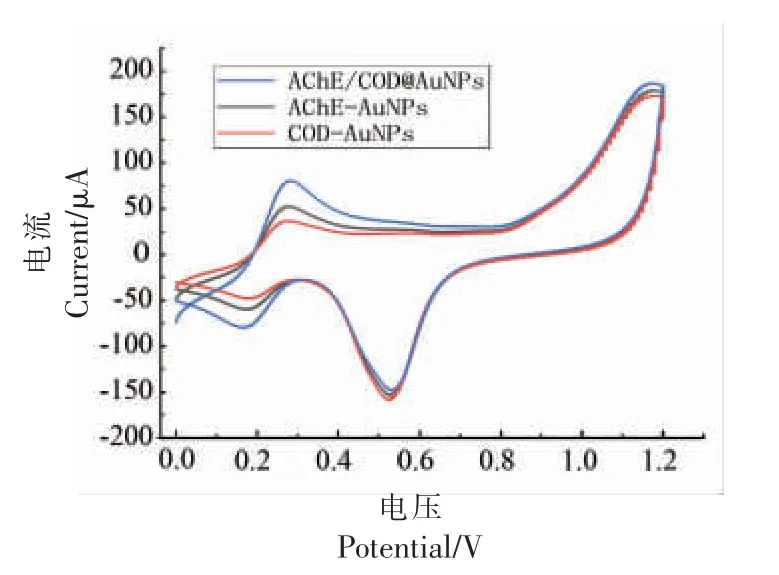
图3 ATCh 中循环伏安法构建方法的选择Fig.3 Selection of CV construction method in ATCh
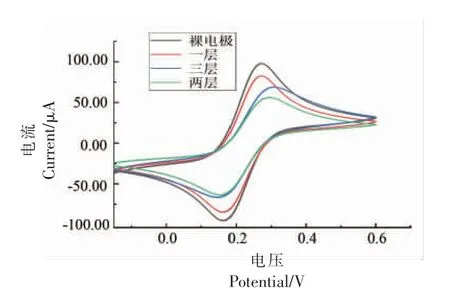
图4 三钾溶液中循环伏安法固定化酶生物传感器修饰层数优化Fig.4 Optimization of modified layers of circulating voltammetry imase biosensor in tripotassium solution
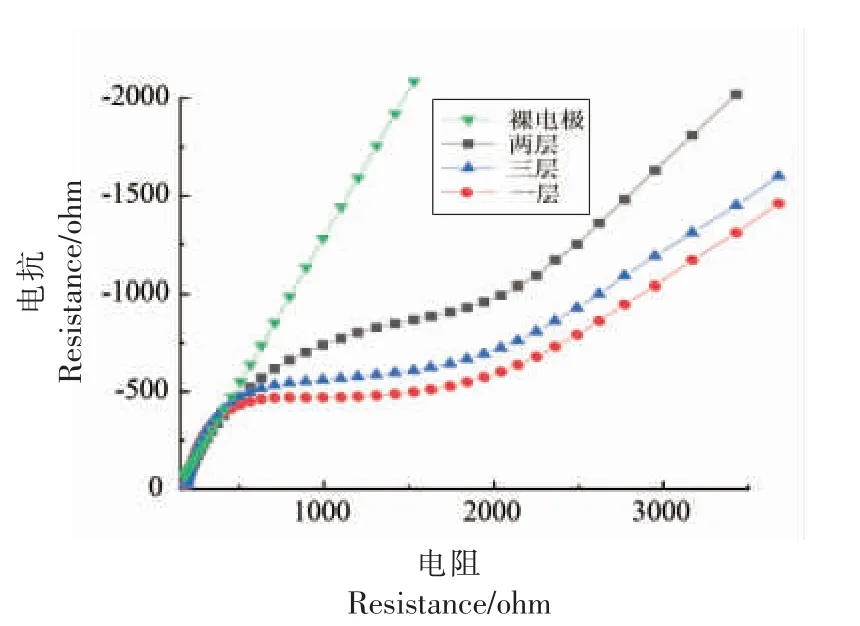
图5 三钾溶液中交流阻抗法固定化酶生物传感器修饰层数优化Fig.5 Optimization of fixase biosensor modified layer in tripotassium solution
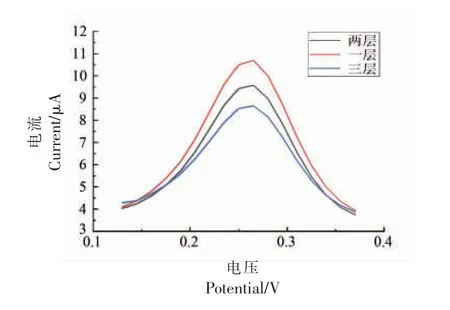
图6 ATCh 中DPV 法检测酶层数的选择Fig.6 Selection of enzyme layers detected by DPV method in ATCh
在以氯化乙酰胆碱为底物的检测体系中,采用循环伏安法电沉积电化学行为构建固定化酶生物传感器,30~45 圈的变化范围。 由图7 可知,当圈数为35 圈时,电沉积构建的固定化酶生物传感器催化底物的电流信号最佳,可达到1.06×10-5A,随着电沉积圈数的增加,如图8 所示,传感器检测性能不增反降,可能是因为随着构建圈数的增加,固定化酶生物传感器中酶的催化位点被互相遮盖,形成空间位阻,酶的催化活性与电信号不能更好的被传感器捕获,因此选择电沉积圈数为35 圈最佳。

图7 ATCh 中DPV 法检测电沉积圈数的选择Fig.7 Selection of DPV method for detecting the number of electrodeposition turns in ATCh
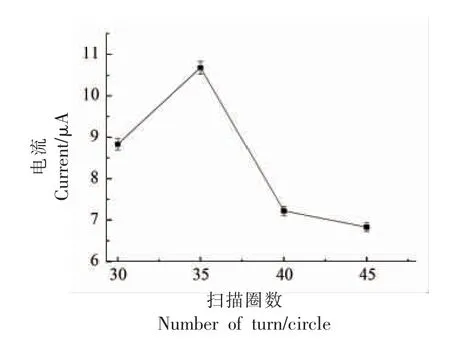
图8 ATCh 中DPV 法检测电沉积圈数的选择折线图Fig.8 Selected line chart of DPV method in ATCh for detecting the number of electrodeposition turns
2.3 DPV 法对有机磷检测体系的优化
2.3.1 固定化酶传感器催化底物浓度的确定 如图9 所示,在0.1~0.4 V 电位区间,当电压为0.26 V 时,氧化峰电流达到最大值。 且当氯化乙酰胆碱浓度为2 mmol/L 时,最大电流强度达到1.35×10-5A(图10)。 氯化乙酰胆碱浓度不宜太高,多余的底物会导致酶的催化活性中心过饱和而引发信号衰减,即宏观表现为电流信号减弱。当底物浓度过低时,单位质量的酶可催化反应底物没有达到饱和,酶的催化效率没有达到最高,因此电化学体系中的介电系数无法达到最高。 如图10 所示,当氯化乙酰胆碱浓度为2 mmol/L 时,电化学体系的介电系数达到最大。所以,检测体系中氯化乙酰胆碱的最佳浓度为2 mmol/L。
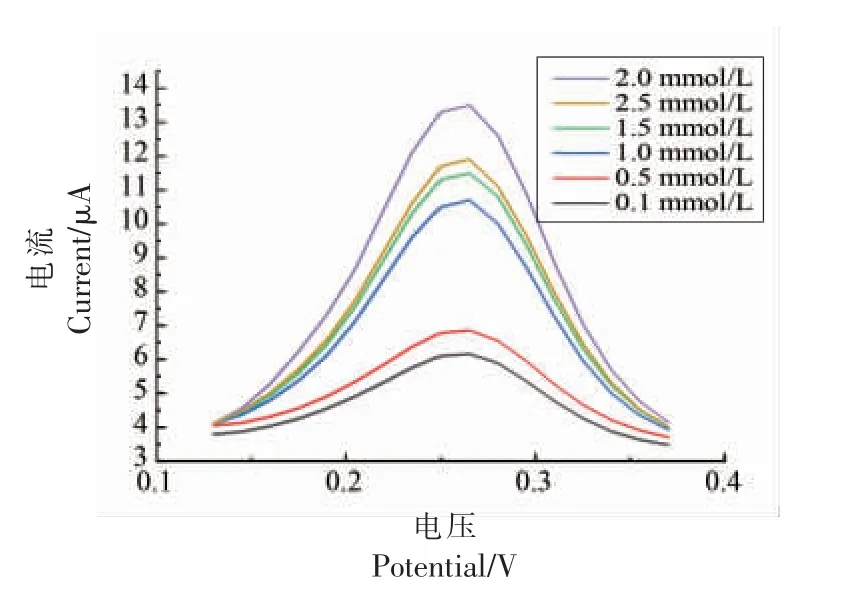
图9 DPV 法检测固定化酶传感器催化不同浓度ATChFig.9 DPV method to detect different concentrations of ATCh catalyzed by immobilized enzyme sensor
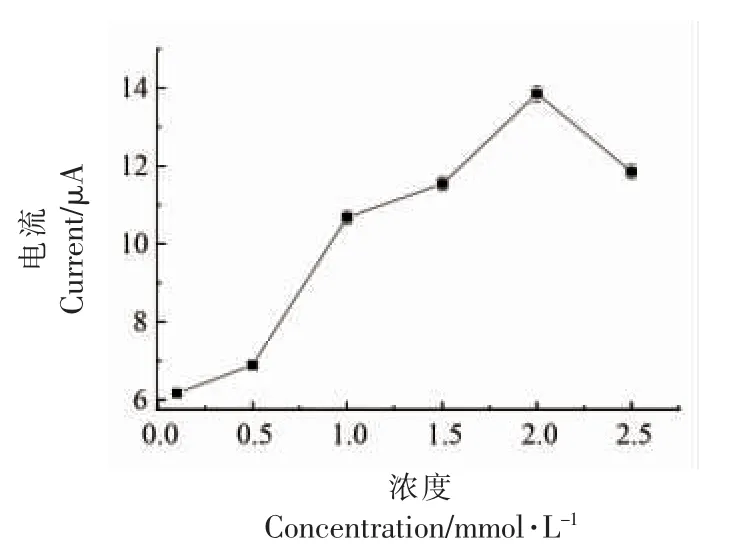
图10 DPV 法检测固定化酶传感器催化不同浓度ATCh 折线图Fig.10 DPV method for detecting different concentrations of ATCh catalyzed by immobilized enzyme sensor
2.3.2 pH 值对双酶生物传感器催化氯化乙酰胆碱的影响 如图11 所示,当体系pH 值在7.8~8.2范围内时,电位在0.26 V 时氧化峰电流达到最大值。 如图12 所示,不同pH 值体系下,得到的电流响应信号值也不同,这主要是由于体系pH 值对传感器上酶的催化活性会产生影响。 当pH 值为7.8时,电信号强度最大为1.98×10-5A,这主要是由于pH 值会改变酶的高级结构,使酶的活性氨基酸以及残基部分或全部失活,进而影响酶的催化活性,因此该检测体系的最佳pH 值为7.8。
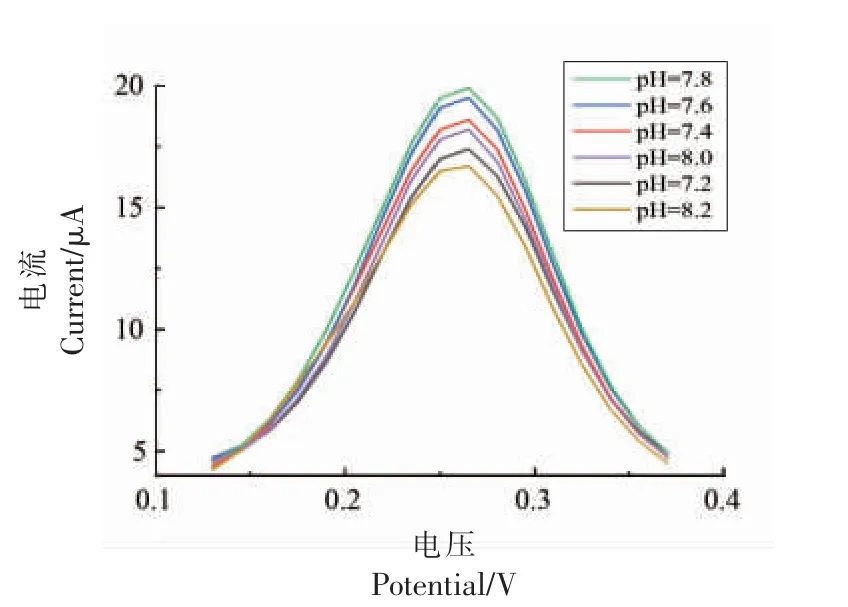
图11 DPV 法检测固定化酶传感器不同pH 催化ATChFig.11 DPV method to detect ATCh catalyzed by immobilized enzyme sensor at different pH
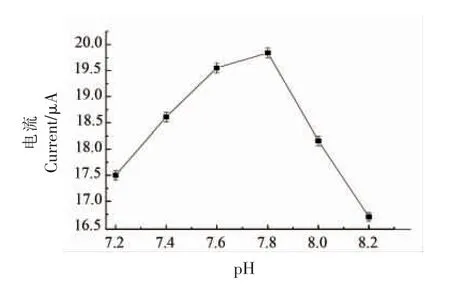
图12 DPV 法检测固定化酶传感器催化不同浓度ATCh 折线图Fig.12 Line chart of different concentrations of ATCh catalyzed by immobilized enzyme sensor by DPV method
2.4 有机磷的检测范围及检出限
以+0.26 V 处氧化峰电流为指标,考察不同质量浓度有机磷对该双酶生物传感器催化氯化乙酰胆碱水解及其产物胆碱氧化反应活性的抑制作用,实现有机磷的反定量检测。如图13 所示,通过对不同质量浓度有机磷与其加入前、 后电流强度的变化差值之间的线性拟合得到线性回归方程为y=0.0468x+1.2124(R2=0.9985),即有机磷在1×10-9~100×10-9mg/L 质量浓度范围内,与电流信号差值之间具有良好的线性关系,且其最低检出限为1.15×10-11mg/L。

图13 固定化酶生物传感器检测有机磷线性关系Fig.13 Organophosphorus linearity detected by immobilized ase biosensors
2.5 有机磷检测体系抗干扰性能研究
在以氯化乙酰胆碱为反应底物的PBS(pH 7.8)体系中,利用I-T 曲线法对以每隔25 s 加入10 μL 的3×10-10mg/L 有机磷溶液进行100 倍浓度常见重金属离子抗干扰性能评估。 如图14 所示,无论是否加入高于有机磷浓度100 倍的各种重金属离子,电流均呈相同趋势的阶梯状有序下降,且双酶生物传感器感应电流强度无变化,说明在此检测范围内传感器可以排除常见伴随性重金属离子的干扰,对有机磷实现特异性识别。
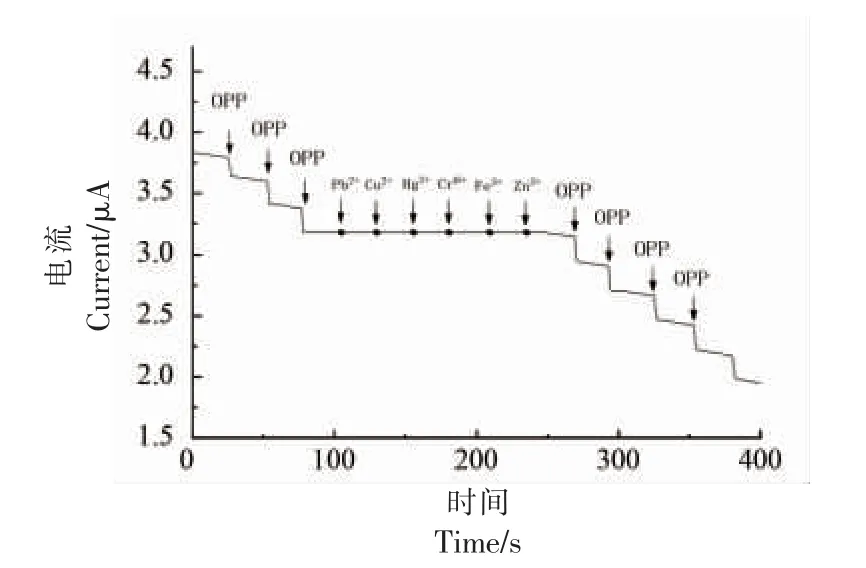
图14 抗干扰能力I/T 曲线Fig.14 Anti-interference ability I/T curve
2.6 酶生物传感器的稳定性
当所构建的AChE/COD@AuNPs 双酶生物传感器在检测体系中 (氯化乙酰胆碱+PBS 缓冲溶液)对有机磷进行连续性多次重复检测时,其电流响应值几乎没有变化,相对标准偏差仅为1.97%。说明该双酶生物传感器具有优良的检测稳定性,如图15 所示,该传感器在4 ℃冰箱中放置7 d 后,对有机磷响应的峰电流可达到97.95%。
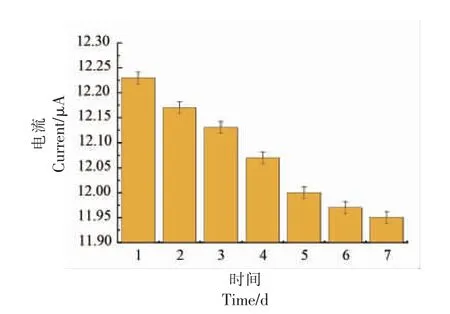
图15 固定化酶生物传感器稳定性时间-电流响应图Fig.15 Time-current response diagram of stability of immobilized enzyme biosensor
3 结论
利用电沉积法通过层层组装纳米金、 共固定化乙酰胆碱酯酶与乙酰胆碱氧化酶构建双酶生物传感器,修饰层数为2 层的传感器催化性能稳定;当在底物氯化乙酰胆碱的浓度为2 mmol/L、pH 值为7.8 的检测体系下,该传感器具有良好的电流信号响应值; 有机磷质量浓度在1×10-9~100×10-9mg/L 范围内,与电流强度线性拟合程度最好,线性方程为y=0.0468x+1.2124(R2=0.9985),最低检出限为1.15×10-11mg/L(S/N=3)。 且在此检测体系下,该双酶生物传感器可以有效抵抗Pb2+、Cu2+、Hg2+、Cr6+、Fe3+、Zn2+等常见重金属离子的干扰;构建的新型AChE/COD@AuNPs 双酶生物传感器在差分脉冲伏安工作模式下,对有机磷农药进行快速检测具有较高的灵敏度和稳定性,检测时间仅需7.5 s,该新型传感器的研制及应用为食品中痕量有机磷农药残留的快速检测提供新思路。
