超声辅助酶改性典型晶型淀粉的结构及消化特性
2023-02-17代香临郑启航胡楠楠许秀颖吴玉柱刘景圣
代香临,郑启航,胡楠楠,李 琦,许秀颖,吴玉柱,刘景圣
(吉林农业大学食品科学与工程学院 长春 130118)
淀粉是植物中含碳水化合物最集中的有机成分,其提供的能量占据了人类食物能量来源的一半[1]。 淀粉消化率影响餐后血糖应答,诸多与饮食相关的疾病,如Ⅱ型糖尿病、肥胖症和结肠癌等均与其相关[2]。淀粉和淀粉基食品的消化率可以用血糖指数(Giycemic index,GI)来表征,它反映餐后血液中葡萄糖水平[3]。天然淀粉基食品普遍具有很高的GI 值,会引起餐后血糖水平迅速升高,因此预测及控制摄入淀粉基食品的餐后血糖释放至关重要。 根据淀粉的消化率,可分为快速消化淀粉(Rapidly digesting starch,RDS)、 慢速消化淀粉(Slowly digesting starch,SDS)以及抗性淀粉(Rasistant starch,RS),其中SDS 和RS 是低升糖食品,具有缓慢吸收,持续释放能量,维持血糖稳态,预防和治疗各种疾病的作用[4]。诸多研究表明淀粉的结构与其消化特性密切相关。例如,Sorndech 等[5]利用麦芽糖酶协同分支酶改性木薯淀粉,结果发现随着淀粉结构的改变,淀粉的抗消化性能显著提高。Ren 等[6]发现分支酶的两阶段改性可以显著提高淀粉分支密度,并且与其慢消化特性密切相关。 Lee 等[7]发现诸多因食用GI 未受调控的食品所引起的慢性疾病,可以通过改变淀粉的结构,延长其在小肠中的消化时间,以达到预防及治疗的目的。
不同结构的天然淀粉,根据X-射线衍射图谱可划分为A 型、B 型和C 型,其中玉米淀粉(Corn starch,CS)、马铃薯淀粉(Potato starch,PS)和豌豆淀粉(Pea starch,PEA/S)分别是3 种晶型的典型代表[8]。研究人员发现天然玉米淀粉以及蜡质玉米淀粉(A 型) 中SDS 含量较高,而马铃薯淀粉(B型)中RS 含量较高,表明淀粉的结晶类型影响其消化特性[9]。据报道,使用物理、化学及酶法处理可以改变淀粉结构,从而降低淀粉消化率[10]。 其中,化学法改性会引入有害副产物,无法保证食品的安全性。而物理和生物酶法因绿色环保,改性效率高,不会引入不良副产物等特点,而成为相对理想的改性方式。 通常采用葡萄糖基转移酶来改性淀粉,对其水解以及转糖基化,来达到缓慢消化的目的[11]。 作为一种重要的葡萄糖基转移酶,分支酶(Brachzyme,BE)是通过水解α-1,4 糖苷键,并且重连α-1,6 糖苷键以改变淀粉结构[12]。 在淀粉消化过程中,α-1,6 糖苷键的断裂速率低于α-1,4糖苷键[13],因此提高α-1,6 糖苷键的比例是改性的有效方法。 然而,BE 的转糖基化活性会随着短链的积累而受到抑制[14]。 研究者们将其它酶与BE结合,来降低淀粉的消化率。 Lee 等[7]的研究发现相比于单独使用BE,BE 与β-淀粉酶联合修饰蜡状玉米淀粉,产生了更高分支度的麦芽糊精并显示出缓慢消化的特性。相比于其它酶,β-淀粉酶能够更高效地生产慢消化淀粉。 β-淀粉酶(β-Amylase,BA) 通过水解非还原末端的α-1,4 糖苷键,进而除去麦芽糖残基并且缩短部分分支的链长,同时提高分支密度[15]。 通过BE 和BA 的结合以制备SDS 和RS 是较为理想的策略。 然而,酶易受温度、pH、盐离子等因素的影响,不易控制其改性程度[16]。 通过其它技术辅助提高改性的效率及得率至关重要。超声作为新型绿色技术,在诸多领域的应用方面展现出巨大的潜力。 超声与酶具有协同效应[17],Hu 等[18]发现无论是单频还是双频超声波都与α-淀粉酶有协同效应,其引起的分子运动能够克服酶处理过程中内部传质障碍,进而有效地提高传统酶改性的效率。
本文选择CS、PS 和PEA/S 3 种典型晶型的淀粉,采用复合酶、超声-复合酶两种方法对其改性,研究不同改性方法对淀粉分子结构的影响,并分析改性后的淀粉消化特性,进一步探究新型改性淀粉的慢消化机制。 本研究将为新型功能性淀粉基食品的开发,以及功能性食品的原料来源提供理论依据。
1 材料与方法
1.1 材料及试剂
玉米淀粉和马铃薯淀粉,荣振化工公司;豌豆淀粉,河南颂扬生物科技公司;直链淀粉试剂,格锐思生物公司;α-淀粉酶(猪胰腺)、葡萄糖苷酶,Sigma 公司;GOPOD 试剂盒,爱尔兰Megazyme 公司;β-淀粉酶,麦克林公司;分支酶,诺维信公司;除有特别说明外,试验中的其它试剂均为分析纯级。
1.2 仪器与设备
Alpha1-4LDplus 冷冻干燥机,德国Christ 公司;AV400NMR 谱仪,瑞士Bruker 公司;VERTEX 70 傅里叶红外光谱仪,费尔伯恩精密仪器公司;D/max200PC X 射线衍射仪,日本理学公司;恒温水浴振荡摇床,深圳优米仪器公司;Allegra X-30 高速离心机,美国Beckman 公司;Spectramax190 全波长酶标仪,PerkinElmer 公司。
1.3 试验方法
1.3.1 复合酶改性淀粉的制备 称取10 g 玉米淀粉、马铃薯淀粉、豌豆淀粉,分别加入至200 mL NaAc(pH 6.5,0.02 mol/L)缓冲液中,配制成淀粉乳0.05 g/mL,放入65 ℃水浴振荡30 min,加入BE(500 U/g),振荡12 h。 添加400 mL 无水乙醇,醇沉、抽滤并收集固形物,预冻12 h 后,冷冻干燥24 h,研磨、过筛。 处理后的淀粉加到200 mL NaAc(pH 5.5,0.02 mol/L)缓冲液中,将其置于55 ℃水浴中振荡30 min,以达到BA 作用的最佳温度,加入BA(干基的0.64%),振荡12 h。 加入2 倍体积无水乙醇,醇沉、抽滤、收集固形物。接着用上述步骤再次用BE 处理,得到复合酶改性产物。
1.3.2 超声-复合酶改性淀粉制备 称取10 g 玉米淀粉、马铃薯淀粉、豌豆淀粉,分别加入至200 mL NaAc 缓冲液(pH 6.5,0.02 mol/L)中,配制0.05 g/mL 的淀粉乳,在120 W 的功率下超声15 min。 将其置于65 ℃水浴中振荡30 min,加入BE(500 U/g),振荡12 h。 添加400 mL 无水乙醇,醇沉、抽滤并收集固形物,预冻12 h 后,冷冻干燥24 h,研磨、过筛。处理后的淀粉加入至200 mL NaAc缓冲液(pH 5.5,0.02 mol/L)中,将其置于55 ℃水浴中振荡30 min,以达到BA 作用的最佳温度,加入BA(干基的0.64%),振荡12 h。 加入2 倍体积无水乙醇,醇沉、抽滤、收集固形物。用上述步骤再次用BE 处理,得到超声-复合酶改性产物。
1.3.3 直链淀粉含量测定 分别称取0.01 g 样品于离心管中,加入1 mL NaOH,充分混匀,80 ℃水浴提取30 min,4 000 r/min 常温离心5 min,弃上清,留沉淀。 加入1 mL 石油醚振荡5 min,4 000 r/min 离心5 min,弃上清液,留沉淀。 加蒸馏水混匀,90 ℃水浴10 min,冷却,待测。按直链淀粉含量试剂盒说明书来添加显色试剂。 混匀,测定620 nm 波长处的吸光度值。
绘制标准曲线:将10 mg/mL 的直链淀粉标准液分别稀释成0.05,0.1,0.2,0.4,0.6,0.8,1.0 mg/mL,按照说明书要求测定吸光度值,以绘制标准曲线。 直链淀粉含量=(样品OD 值-空白OD 值-b)/a×V提取液/W[19],式中,a——标准曲线的斜率;b——标准曲线的截距。
1.3.4 分支密度测定 通过核磁共振1H 谱(1H NMR) 测定淀粉α-1,6-糖苷键的比例。 淀粉(80 mg/mL)溶解于重水(D2O)中,沸水浴30 min。 糊化后的样品冷冻干燥72 h 后,重新溶解于重水(40 mg/mL)中,通过1H NMR 测定其α-1,6-糖苷键比例。 依据对应峰面积计算得到α-1,6-糖苷键比例[20]。
1.3.5 傅里叶红外光谱测定 使用傅里叶红外光谱仪(FT-IR)测定样品的结构。 取2 mg 样品和0.2 g 溴化钾在红外灯下研磨混匀,放置于模具中,真空压片60 s。 以KBr 为背景,在4 000~400 cm-1范围内扫描128 次,分辨率为4 cm-1,得到FT-IR 图[21]。
1.3.6 结晶特性测定 通过X 射线衍射仪(XRD)检测结晶结构。 参数设定为:电流200 mA,电压40 kV,步宽0.02°,衍射角2θ=5°~40°,扫描速率1.2°/min,在此条件下连续扫描[22]。
1.3.7 体外模拟消化测定 参考Englyst 方法并稍加修改,对样品进行体外模拟消化测定[23]。 酶解液制备: 取6 g 胰α-淀粉酶加入至40 mL 去离子水中,搅拌30 min,5 000 r/min 离心30 min,取上清34.5 mL 置于预冷烧杯中;向3.15 mL 葡萄糖苷酶中加入3.6 mL 蒸馏水,稀释后取4.5 mL 倒入烧杯中制成酶解液。 消化率测定:取1 g 样品,20 mL乙酸钠缓冲液 (0.1 mol/L,pH 5.2),6 枚玻璃珠于锥形瓶中,在37 ℃摇床中保温10 min,滴加5 mL酶解液。 然后,在37 ℃、170 r/min 条件下,反应120 min。第20 min 与第120 min 时,分别取出0.5 mL 反应液于20 mL 66%乙醇中灭酶。酶解后的葡萄糖含量使用GOPOD 试剂盒测定,具体操作按照说明书完成。 其中RDS、SDS 及RS 含量的计算公式如下:
式中,Mt——t 时刻(min),离心管内上清液中葡萄糖的质量(g);0.9——比例转换系数。
1.3.8 淀粉消化动力学 基于Yu 等[24]的方法建立一级淀粉消化动力学方程,将消化曲线进行拟合,拟合方程如下:C=C∞×(1-e-kt)研究改性淀粉的消化动力学及预测血糖生成指数 (pGI),式中,C——在t 时刻消化的淀粉 (g/100 g 干淀粉);C∞——样品的最终葡萄糖平衡浓度(g/100 g 干淀粉);k——消化速率常数 (min-1);t——消化时间(min)。 分别测定样品酶解10,20,30,40,50,60,80,100,120 min 时的水解率(HR):
式中,M——不同时间水解后的葡萄糖质量(mg);m——样品质量(mg)。
水解指数(Hydrolysis index,HI)通过样品和空白对照样品的消化水解曲线的面积比例求得。样品的预测血糖指数(pGI)通过下式计算得到:
1.3.9 数据处理与分析 数据采用Microsoft Excel、Origin 8.5 及AI 等软件完成;采用SPSS 软件进行Ducan 差异显著性分析,P<0.05 表示差异显著。
2 结果与分析
2.1 产物直链淀粉含量分析
通过碘蓝法测定3 组样品的直链淀粉含量。如图1 所示,改性前PEA/S 直链淀粉含量最高。经复合酶(BE、BA)处理后,CS 组淀粉、PS 组淀粉和PEA/S 组淀粉的直链淀粉含量均下降,其中CS 组及PEA/S 组尤为显著,分别下降了5.21%和38.48%(P<0.05);随着超声的引入,直链淀粉含量均进一步下降。 以上结果是由于复合酶的水解作用,除去了一部分直链淀粉,加之BE 的分支作用,引入新的α-1,6 糖苷键,形成新的分支点,从而将直链结构转移至支链分子上,致使直链淀粉比例降低。另外。超声破坏了淀粉分子表面的水束层,因此提高了复合酶的作用效率[25]。 在3 种晶型淀粉的改性过程中,PEA/S 直链淀粉含量下降幅度最大,表明直链淀粉含量越高,改性效果越明显。
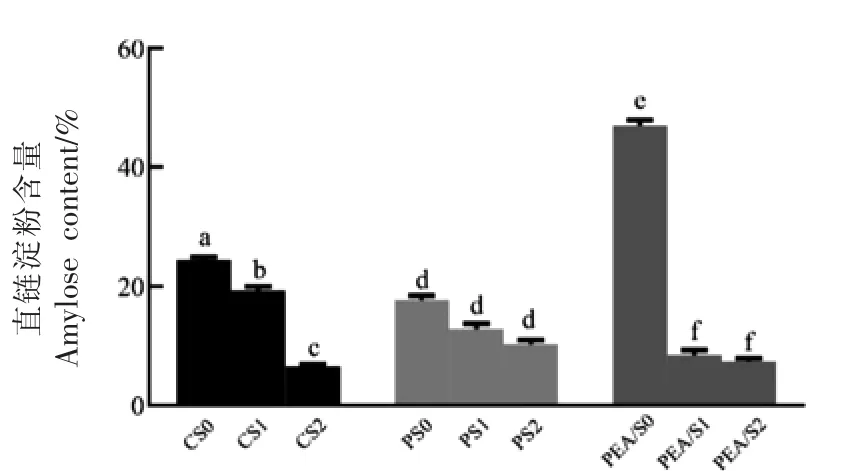
图1 改性前、后3 种晶型淀粉直链淀粉含量Fig.1 Amylose contents of three kinds of starches before and after modification
2.2 分支密度分析
采用1H NMR 来表征改性后的3 种淀粉的分支密度,通过计算α-1,6 糖苷键比例来量化各样品的分支密度,如图2 所示。在淀粉分子中,α-1,4糖苷键和α-1,6 糖苷键的中端基质子化学位移分别为5.3 ppm 与4.9 ppm。 通过图2 计算的峰面积得到以下结果,与对照组相比各组样品的α-1,6糖苷键比例均有所提高。 其中,CS1、PS1 和PEA/S1 的α-1,6 糖苷键比例分别提高了16.4%,26.6%,139%。引入超声后的各组样品的α-1,6 糖苷键比例又进一步提高,相比于CS1、PS1、PEA/S1分别提高了14.5%,26.6%,51.3%。 以上结果是因为复合酶能够水解淀粉的α-1,4 糖苷键,同时复合酶作用后出现链转移,进而除去麦芽糖残基并且缩短部分分支的链长[26];超声通过增加淀粉分子的比表面积[26],从而增强了分支酶的转糖激化活性,因此进一步提高了淀粉的分支密度。 此外,研究还发现淀粉底物分支密度低时,改性效果更显著。

图2 改性前、后3 种晶型淀粉核磁共振氢谱分析图Fig.2 1H NMR analysis of three kinds of starches before and after modification
2.3 傅里叶红外光谱分析
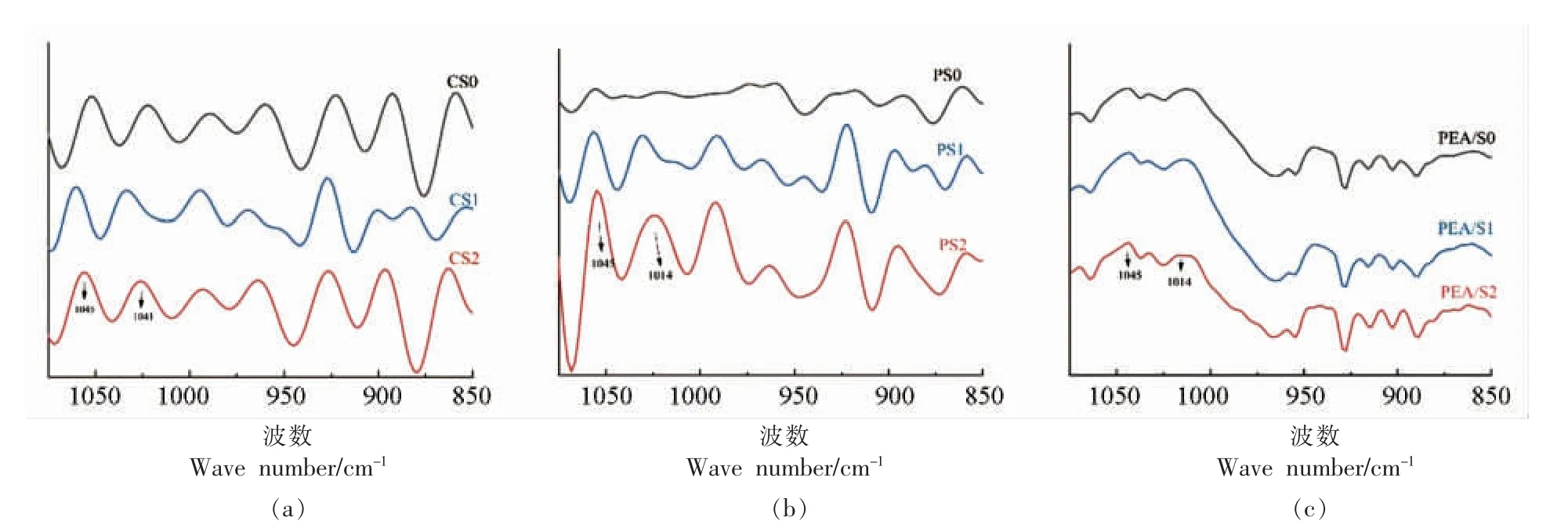
改性前、 后3 种淀粉的原始红外光谱如图3所示。与对照组相比,经复合酶改性后的3 种淀粉的氢键吸收峰出现红移,这是由于分支密度增加,酶处理后氢键的强度下降。 超声辅助改性后的各组淀粉的氢键吸收峰出现蓝移,这是由于一定的超声作用能使淀粉分子链断裂成相似的片段,有利于淀粉链间相互靠近形成氢键,并提高分子的有序状态[27]。

图3 改性前、后3 种晶型淀粉红外光谱Fig.3 Infrared spectra of three crystalline starches before and after modification
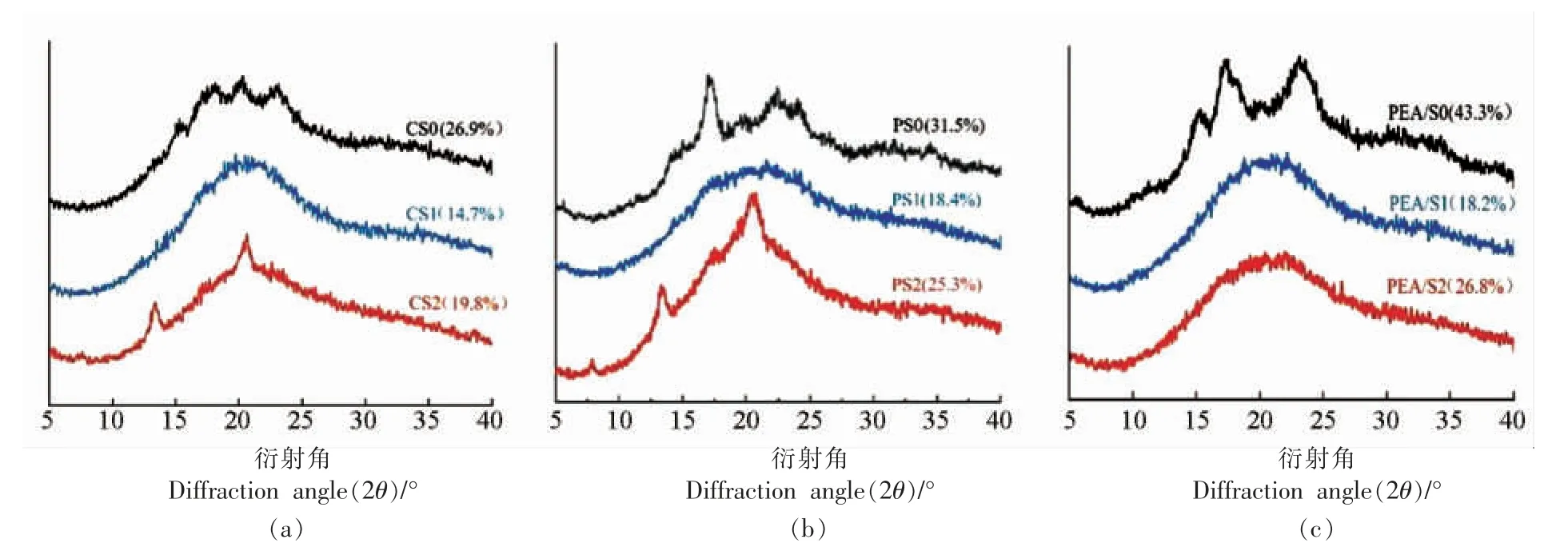
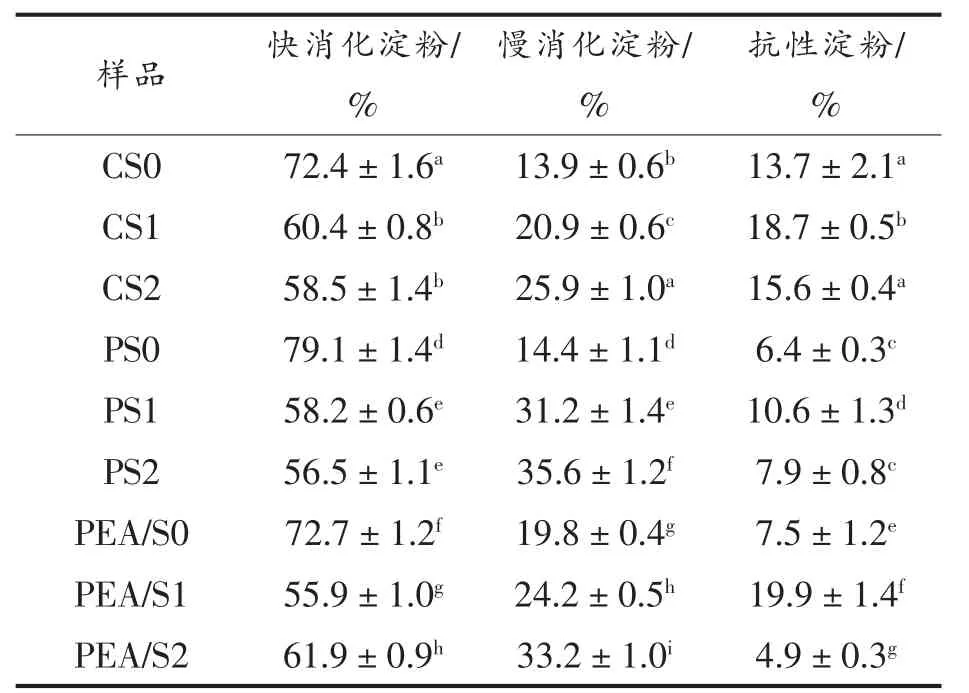
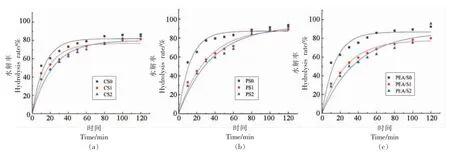
为了进一步分析红外光谱,本研究对光谱数据进行去卷积处理。1 045 cm-1 和1 014 cm-1处的峰分别与淀粉中的有序结构和无定形结构相关,因此1 045 cm-1和1 014 cm-吸收峰强度比值(R1045/1014)表示短程范围内结晶度和晶体有序性,R值越大有序度越高,反之有序度越低[28]。 由图4 所示,改性前、后3 种淀粉的去卷积红外光谱图可以计算出样品的R1045/1014值,结果如表1 所示。3 种淀粉的R 值从小至大依次为:CS 表1 改性前、后3 种晶型淀粉短程有序结构分析Table 1 Analysis of short-range ordered structure of three crystalline starches before and after modification 图4 改性前、后3 种晶型淀粉去卷积红外光谱图Fig.4 Infrared deconvolution spectra of three kinds of starches before and after modification 图5 为3 种晶型淀粉改性前、 后的XRD 图谱,利用Jade 6.5 软件计算得到相对结晶度(图5)。 CS 在衍射角为15.3°,18.1°,20.3°,23°处有特征峰,PS 在衍射角为5.6°,17°,22.4°,24°处有特征峰,PEA/S 在衍射角为15.2°,17.3°,19.7°,23.1°处有特征峰,它们的晶型分别呈A 型、B 型、C 型[29]。复合酶改性后CS、PS 及PEA/S 的原始峰强度变弱,相对结晶度下降。这是由于复合酶处理改变了淀粉分子内部的微晶型取向,淀粉晶体被破坏,长程有序结构减少,从而导致相对结晶度降低[30]。 然而,随着超声的引入CS 和PS 在13.2°和19.7°处出现2 个强衍射峰,在5.6°和17.3°处显示出2 个弱衍射峰,并且PEA 还在23°处出现特征峰,3 种淀粉相对结晶度显著升高。 这说明超声使得破坏的晶体重排成弱C 型晶体结构,又由于13.2°及19.7°处的峰是V 型结构的特征峰[31],因此超声辅助酶修饰的淀粉呈C+V 型的晶型结构,且V 型为主要晶型。 上述结果是由于超声的“空穴效应”产生的剪切力切断淀粉长链,产生大量短链,为复合酶改性提供了更多的底物,并且这些短链与无水乙醇形成的复合物,也有利于形成V 型结构,而V型结构是具有慢消化特性的结构[14]。 图5 改性前、后3 种晶型淀粉晶型结构Fig.5 Crystal structure analysis of three kinds of starches before and after modification 由表2 可知,经改性后,各组α-1,6 糖苷键的含量均有不同程度的增加。 Ocieczek 等[32]指出α-1,6 糖苷键的含量增加有助于消化率的降低。 因此,在含有胰酶和葡萄糖苷酶的体外消化系统中,对CS 组、PS 组及PEA/S 组进行消化率的测定,结果如表2 所示。利用复合酶和超声-复合酶两种策略均可高效调控淀粉结构,来达到优化其消化性能的目的。经复合酶改性后,3 组淀粉中的RDS 含量均降低,SDS 和RS 含量均显著提高。 其中CS组经复合酶处理后,SDS 和RS 相比对照组分别增加了7%和5%,引入超声后SDS 含量进一步增加至25.9%; 样品PS1 中SDS 和RS 相比对照组分别增加了16.8%和4.2%,引入超声后SDS 含量进一步增加至35.6%;PEA/S 组,样品PEA/S1 中SDS 和RS 相比对照组分别增加了4.4%和12.4%,引入超声后SDS 含量进一步增加至33.2%。 综合比较,与单一复合酶改性相比,超声-复合酶改性是更为高效的改性手段,其中PEA/S 对复合酶更为敏感。 表2 改性前、后3 种晶型淀粉消化性能分析Table 2 Analysis of digestibility of three crystalline starches before and after modifacation 各组淀粉改性前、 后体外水解曲线如图6 所示。3 种晶型淀粉在120 min 之内水解率先快速升高,然后缓慢升高并逐渐达到平衡。水解平衡浓度从大到小依次为:PEA/S>PS>CS。 图6 改性前、后3 种晶型淀粉水解曲线Fig.6 Hydrolysis curves of three starches before and after modification 基于Yu 等[24]的体外消化动力学方法,采用Origin 2018 软件对图6 中数据进行拟合,得到水解动力学模型结果(表3)。经复合酶改性后,CS 和PS 的水解平衡浓度均有显著降低(P<0.05),而经过超声辅助后,各组水解平衡浓度均显著降低。另外,3 种晶型淀粉经两种策略改性后水解指数(HI)和血糖指数(GI)均显著降低(P<0.05),说明两种改性策略均能有效降低餐后血糖的释放速率,并且超声辅助酶改性法的效率更高。 表3 改性前、后3 种晶型淀粉体外模拟消化动力学特征参数Table 3 In vitro simulated digestion kinetics parameters of the three starches before and after modification 研究结果表明,经复合酶处理后,3 种晶型淀粉的直链淀粉含量均降低,α-1,6 糖苷键比例有不同程度的增加,分子有序程度降低,相对结晶度降低,其中豌豆淀粉变化幅度最大,说明3 种典型晶型中豌豆淀粉对复合酶最为敏感; 相比于复合酶改性,经超声-复合酶改性后各组淀粉的直链淀粉含量均进一步降低,分支密度显著提高,相对结晶度升高,3 种晶型淀粉均转化为以V 型结构为主要晶型的C+V 型结构,说明改性后分子排列更加有序,结构趋于稳定;3 组淀粉经改性后,RDS均显著降低,SDS 显著提高,HI 和GI 显著降低。以上结果说明两种策略均能够通过改变淀粉结构来改善其消化性能,而超声处理能够有效提高复合酶的改性效率,因此超声辅助酶法是调节淀粉餐后血糖释放速率的有效改性策略,为开发低GI功能性食品的加工技术优化提供了新思路。
2.4 结晶结构分析
2.5 体外消化模拟分析
2.6 淀粉水解消化动力学

3 结论
