活性引导结合高速逆流色谱分离蓝莓活性成分及其与α-葡萄糖苷酶的相互作用
2023-02-17杨兆艳田艳花王玲丽谭佳琪
杨兆艳,田艳花,王玲丽,谭佳琪
(1 山西药科职业学院食品工程系 太原 030031 2 运城学院生命科学系 山西运城 044000 3 北京大学前沿交叉研究院 北京 100091)
天然产物的化学成分非常复杂,传统的分离方法存在操作复杂、 耗时长和效率低等问题。 因此,提出一种潜在的以活性为导向的分离方法,以提高活性化合物的分离效率[1]。通过活性引导结合色谱技术对活性化合物进行富集和分离,最终得到高纯度活性化合物,该技术已被成功应用于抗菌香豆素[2]、抗肿瘤药物[3]和水溶性抗氧化剂[4]分离。柱色谱是活性引导中最重要的色谱技术,常用于从天然植物资源中分离各种活性化合物,然而,该技术在分离化合物的过程中,不可逆吸附会造成微量活性化合物丢失[5]。 该现象可以通过液-液萃取来避免,液-液萃取通常被用于粗提物的初步纯化。 传统的液-液萃取分离效率低,导致萃取物的组成仍非常复杂,因此需改进以获得目标活性成分。高速逆流色谱(High-speed counter-current chromatography,HSCCC) 作为一种不需要任何固体相作为载体的连续液-液萃取方法,被广泛用于从粗提物中制备活性化合物[6-7]。 HSCCC 可以避免样品在固相上的不可逆吸附。与传统色谱法相比,HSCCC 可以提高样品的载样能力,便于活性物质的大规模制备。 采用HSCCC 分离后,目标组分中的杂质大幅减少,有效成分的分离成功率显著提高。
蓝莓(Vaccinium spp.)属杜鹃花科越橘属,广泛种植于世界各地,尤其在我国东北地区种植面积较广。 蓝莓中富含花色苷、酚酸、超氧化物歧化酶和各种维生素等活性成分[8]。大量研究表明蓝莓中活性化合物具有抗氧化、抗肿瘤、抗炎和抗衰老等功效[9]。 此外,蓝莓中的一些化合物可以改善血糖和血压水平[10]。 α-葡萄糖苷酶作为一种水解酶,具有水解和转糖苷的双重功能。 它被广泛应用于乙醇发酵、低聚糖生产、淀粉水解、食品成分分析和代谢机理研究等方面[11]。 α-葡萄糖苷酶通过加水切割寡糖/多糖中的α-1,4-糖苷键,产生游离的α-D-葡萄糖,易被肠细胞从血液中吸收,导致餐后血糖水平升高[12]。 而控制餐后血糖水平是治疗或预防2 型糖尿病的关键。 目前α-葡萄糖苷酶被用作治疗2 型糖尿病的靶点酶,临床药物一般通过抑制其活性来治疗2 型糖尿病[13]。 虽然这些药物在临床上有效,但是长期使用耐药性增强,同时会产生不良反应。 天然活性化合物被作为潜在的α-葡萄糖苷酶抑制剂,可以避免上述问题。 目前,有研究表明,酚酸和黄酮类化合物对α-葡萄糖苷酶具有较好的抑制作用[14-15],而蓝莓中具有α-葡萄糖苷酶抑制活性的成分及与酶的相互作用尚未阐明。
鉴于此,本研究建立活性引导结合HSCCC 分离蓝莓中具有抑制α-葡萄糖苷酶活性的组分,并通过紫外光谱、傅立叶红外光谱、高效液相色谱-质谱联用及核磁技术鉴定其结构;采用荧光光谱、圆二色谱和分子对接技术研究活性组分与α-葡萄糖苷酶的相互作用。
1 材料与方法
1.1 材料与试剂
新鲜矮丛蓝莓购于小兴安岭地区,经除杂清洗后,自然晾干。 利用九阳破壁机将其打浆,果浆首先置于-80 ℃冰箱预冷12 h,预冷结束后将其置于真空冷冻干燥机中,连续干燥72 h,然后采用植物粉碎机将其粉粹,过40 目筛,制得蓝莓果粉,将其避光保存在-18 ℃冰箱中备用。
α-葡萄糖苷酶(50 U/mg,68.5 ku,酿酒酵母),上海联硕生物科技有限公司; 对硝基苯-α-D-吡喃葡糖苷 (4-Nitrophenyl α-D-glucopyranoside,PNPG),上海吉至生化科技有限公司;对硝基苯酚(P-nitrophenol,PNP),泰州苏泽化工材料有限公司; 甲基叔丁基醚 (Methyl tert-butyl ether,MTBE),上海金锦乐实业有限公司;正丁烷(1-butane,1-BU),上海脉铂医药科技有限公司; 乙腈(Acetonitrile,ACN),上海升德医药科技有限公司;三氟乙酸(Trifluoroacetic acid,TFA),南京草本源生物科技有限公司;Sephadex LH-20 葡聚糖凝胶,北京绿百草科技发展有限公司;甲醇、乙醇和甲酸(分析纯级),湖北惠择普医药科技有限公司。
1.2 仪器与设备
LC-40 高效液相色谱,广东晟泽科技有限公司;LCMS-8080日本岛津三重四极杆液相色谱质谱联用仪,日本岛津公司;HSCCC-TBE1000A 高速逆流色谱,深圳同田生化技术有限公司;LANYI-650CT 超声波提取仪,上海兰仪实业有限公司;3-18KS 高速离心机,北京博迈星仪器有限公司;SHZ-D 台式循环水多用真空泵,河南金博仪器制造有限公司;Advance 400MHz 核磁共振谱仪,德国布鲁克公司;752N 紫外可见分光光度计,济南好来宝医疗器材有限公司;PHSJ-3F 高精度台式数显pH 酸度计,上海力辰仪器科技有限公司;RGF-6300 原子荧光分光光度计,杭州俊升科学器材有限公司;DSM 20 CD 圆二色光谱仪,皕赫国际贸易(上海)有限公司;DJ10R-K6 九阳豆浆机,山东九阳股份有限公司;124-1CN 分析天平,爱来宝(济南)医疗科技有限公司。
1.3 方法
1.3.1 样品提取物制备 在预试验的基础上,采用超声辅助提取蓝莓中具有抑制α-葡萄糖苷酶活性的成分,利用60%乙醇作为提取溶剂。 称取1 000 g 蓝莓粉末,按照料液比1∶3 g/mL 加入60%乙醇,将其充分混合后,置于超声提取设备中,设定超声功率350 W,提取温度50 ℃,提取时间25 min,待提取结束后,将提取液通过高速离心机离心(7 000 r/min,15 min),过滤收集滤液。 残渣采用同样的方式提取3 次,合并滤液。 滤液先通过40℃旋转蒸发仪除去大部分溶剂,后置于真空冷冻干燥机中将其冻干,得到蓝莓粗提物样品(43.18 g)。蓝莓粗提物样品经水复溶后,再依次通过500 mL 石油醚、乙酸乙酯和正丁醇萃取,将每种溶剂得到的提取液进行浓缩干燥后,分别得到0.69 g石油醚提取物 (样品1)、2.84 g 乙酸乙酯提取物(样品2)、7.03 g 正丁醇提取物(样品3)和18.47 g水提取物(样品4)。
1.3.2 HSCCC 分离 参考薛宏坤等[16]的方法,选择1-BU-MTBE-ACN-水-TFA (2∶2∶1∶5∶0.01,V/V)作为HSCCC 溶剂体系,设定上相作为固定相,下相作为流动相。 依据α-葡萄糖苷酶抑制活性试验发现,样品4 对α-葡萄糖苷酶抑制效果明显优于其它样品。 因此,选择样品4 进一步分析。 分别称取0.20 g 样品4,溶于20 mL 上相和20 mL 下相,待两相平衡后,将上、下相分离,并利用超声脱气30 min。样品在分离前,设定温度和固定相流速分别为25 ℃和15 mL/min,直到固定相充满整个螺线管后,打开主机,设定转速850 r/min,待转速恒定后,将流动相以2 mL/min 流速泵入进行分离,在波长254 nm 处检测,根据HPLC 对应的出峰时间进行分步收集组分,并对其浓缩干燥,然后避光保存于-18 ℃冰箱中备用。
1.3.3 Sephadex LH-20 葡聚糖凝胶分离 采用Sephadex LH-20 葡聚糖凝胶进一步纯化,经HSCCC 分离获得具有最高α-葡萄糖苷酶抑制活性组分(F4)。 称取20 g Sephadex LH-20 凝胶,加200 mL 蒸馏水充分饱和,转移至洗脱柱(30 cm×2.5 cm)中,并用体积分数45%丙酮洗脱。称取1.0 mg F4,用蒸馏水溶解,采用0.22 μm 微孔膜对样品溶液过滤,然后将其转移至凝胶床上,待组分完全渗透到凝胶床后,采用体积分数50%甲醇溶液洗脱色谱柱,收集洗脱液,并将其浓缩干燥后,即可获得高纯度的α-葡萄糖苷酶抑制活性组分(组分Ⅰ)。
1.3.4 组分Ⅰ鉴定
1.3.4.1 紫外扫描 将组分Ⅰ配制成0.1 mg/mL样品溶液,然后在波长200~700 nm 范围内扫描,分析组分Ⅰ的紫外光谱特征。
1.3.4.2 傅里叶红外光谱扫描 称取2.0 mg 组分Ⅰ,按照1 ∶100(g/g)加入KBr 粉末,共同研磨压片,然后对其在波长400~4 000 cm-1范围内进行光谱扫描,分析组分Ⅰ的红外光谱特征。
1.3.4.3 HPLC 分析 样品处理:分别称取1.0 mg样品4、F4 和组分Ⅰ于试管中,加入0.1%HCl-甲醇溶液,配制成0.1 mg/mL 溶液,利用0.45 μm 滤膜对溶液进行过滤,用于HPLC 分析。
色谱条件: 岛津-228 C18柱 (6.0 mm×150 mm,5.0 μm);选择体积分数20%甲酸作为流动相A,体积分数60%乙腈作为流动相B。 洗脱程序:5%~20%B,10 min;20%~25%B,5 min;25%~30%B,10 min;30%~33%B,5 min;33%~5%B,15 min。柱温、 进样量和检测波长分别设为25 ℃,20 μL,520 nm。 依据公式(1)计算样品组分的纯度。
式中,Pi——待测样品 (i) 峰面积百分数;λi——校正因子;Ai——待测样品(i)峰面积。
1.3.4.4 HPLC-MS 分析 质谱条件:质谱采用正离子扫描方式对样品进行扫描,扫描范围100~1 000 m/z,同时分别设定雾化器压力、干燥气温度和毛细管电压分别为138 kPa,335 ℃,4.5 kV。
1.3.4.5 NMR 鉴定 样品处理:称取5.0 mg 组分Ⅰ,加入氚代甲醇将其溶解,配制成0.1 mg/mL 的溶液,利用0.45 μm 滤膜对其过滤,用于1H NMR和13C NMR 分析。
1.3.5 α-葡萄糖苷酶抑制试验 α-葡萄糖苷酶能水解PNPG 生成黄色的PNP,PNP 在波长405 nm 处有最大吸收峰。参考文献[17]的方法,分别取1 mL α-葡萄糖苷酶(0.2 μmol/L)置于试管中,分别加入1 mL 质量浓度为10,20,40,80,160 μg/mL样品溶液(样品1~4 和HSCCC 分离获得的组分)和1 mL 组分Ⅰ(矢车菊-3-O-葡萄糖苷,Cyanidin-3-O-glucoside,C3G)(10,20,40,80,160 μmol/L),并将其充分混合,其余操作参考文献[17]的方法。依据式(2)计算样品对α-葡萄糖苷酶抑制率。
1.3.6 荧光光谱测定 参照Zeng 等[18]的方法,将1 mL 不同浓度C3G(10,20,40,80,160 μmol/L)分别与4 mL α-葡萄糖苷酶液(0.2 U/mL)均匀混合,分别在25,30,37 ℃条件下反应10 min,然后对其进行荧光光谱扫描,设定扫描波长范围为320~380 nm,激发波长为295 nm,发射和激发的狭缝宽度均为10 nm。
1.3.7 圆二色谱 采用圆二色谱仪测定C3G 对α-葡萄糖苷酶二级结构的影响。样品分别为α-葡萄糖苷酶(20 μmol/L)和α-葡萄糖苷酶(20 μmol/L)+C3G(40 μmol/L)。 圆二色谱设置条件为:扫描速率60 nm/min,光谱分辨率1 nm,响应1 s,带宽1 nm。 测定样品在200~250 nm 下的远紫外吸收,计算α-葡萄糖苷酶二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲的变化。
1.3.8 分子对接模拟 采用AutoDck4.2 软件进行分子对接模拟。C3G(CID:132989527)的分子结构来自PubChem 分子库,用于配体对接。 晶体结构α-葡萄糖苷酶(PDB ID:3A47) 可在RSCB 蛋白质数据库中获得(https://www.rcsb.org/)在对接过程中被用作受体。 利用Lamarck 遗传算法计算配体和大分子可能的构象。 根据计算结果中以结合能最小为原则,得到最优对接结果,并进一步分析。
2 结果与分析
2.1 α-葡萄糖苷酶抑制效果
本研究以α-葡萄糖苷酶抑制活性为导向,进行提取分离,筛选出具有α-葡萄糖苷酶抑制活性的蓝莓组分。 蓝莓粗提物样品对α-葡萄糖苷酶抑制效果如图1a 所示。 由图1a 可知,当蓝莓粗提物样品质量浓度在10~160 μg/mL 范围内,α-葡萄糖苷酶抑制率随蓝莓粗提物样品质量浓度增加而显著增加(P<0.05),且呈浓度依赖性。 当蓝莓粗提物样品质量浓度为160 μg/mL 时,α-葡萄糖苷酶抑制率高达72.82%±1.64%。 结果表明,蓝莓粗提物样品中含有具有α-葡萄糖苷酶抑制作用的活性成分。为使活性成分被分段和富集,本研究将蓝莓粗提物样品依次通过石油醚、 乙酸乙酯和正丁醇萃取,分别得到不同提取物,提取物在最大质量浓度(160 μg/mL)条件下对α-葡萄糖苷酶抑制效果如图1b 所示。 由图1b 可知,样品1~4 对α-葡萄糖苷酶抑制效果存在显著差异(P<0.05)。 样品1和样品2 能促进α-葡萄糖苷酶发挥作用。 其原因可能是由于石油醚提取物和乙酸乙酯提取物中的活性成分促进α-葡萄糖苷酶活性位点的释放,有利于酶发挥作用。 样品3 和样品4 均能有效抑制α-葡萄糖苷酶活性,而样品4 对α-葡萄糖苷酶抑制效果明显优于样品3(P<0.05)。 因此,选择样品4 作为下一步的研究对象,利用活性引导结合HSCCC 分离纯化样品4 中具有α-葡萄糖苷酶抑制效果的活性成分。
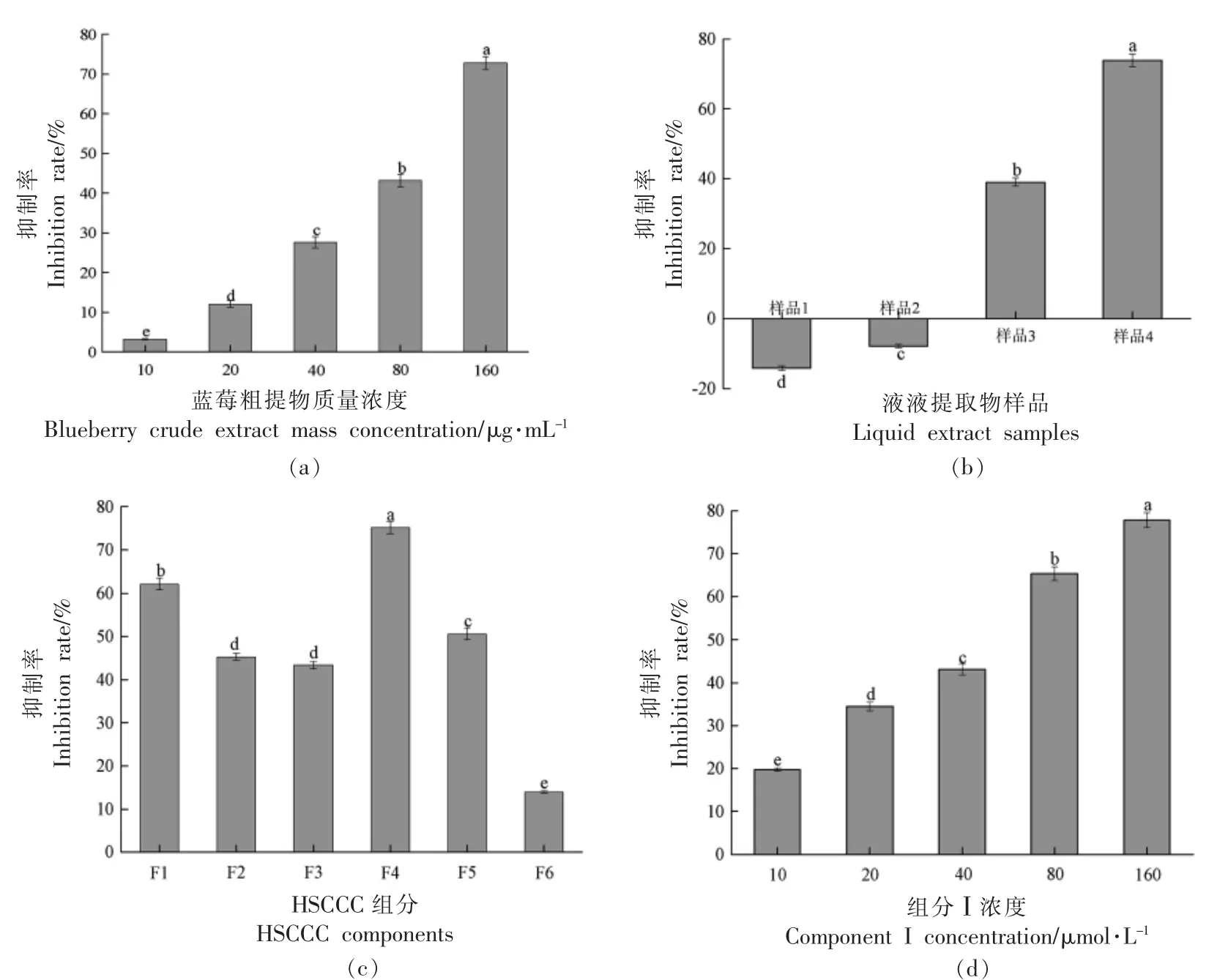
图1 蓝莓粗提取物(a)、液-液提取物(b)、HSCCC 组分(c)和组分Ⅰ(d)对α-葡萄糖苷酶抑制率的影响Fig.1 Effect of blueberry crude extract (a),liquid-liquid extract (b),HSCCC component (c) and component I (d)on the inhibition rate of α-glucosidase
2.2 HSCCC 组分及其对α-葡萄糖苷酶抑制效果
选取1-BU ∶MTBE ∶ACN ∶水∶TFA=2 ∶2 ∶1 ∶5 ∶0.01(V/V)作为HSCCC 溶剂体系,用于分离样品4,其结果如图2 所示。 由图2 可知,样品4 经HSCCC 分离后得到6 种组分,分别命名为F1、F2、F3、F4、F5 和F6,此时固定相保留率为68.52%。固定F1、F2、F3、F4、F5 和F6质量浓度为160 μg/mL,测定其对α-葡萄糖苷酶的抑制率,结果如图1C 所示。 由图1c 可知,F4 对α-葡萄糖苷酶抑制率显著高于其它组分(P<0.05)。 因此,选择F4 进一步分析其组成。
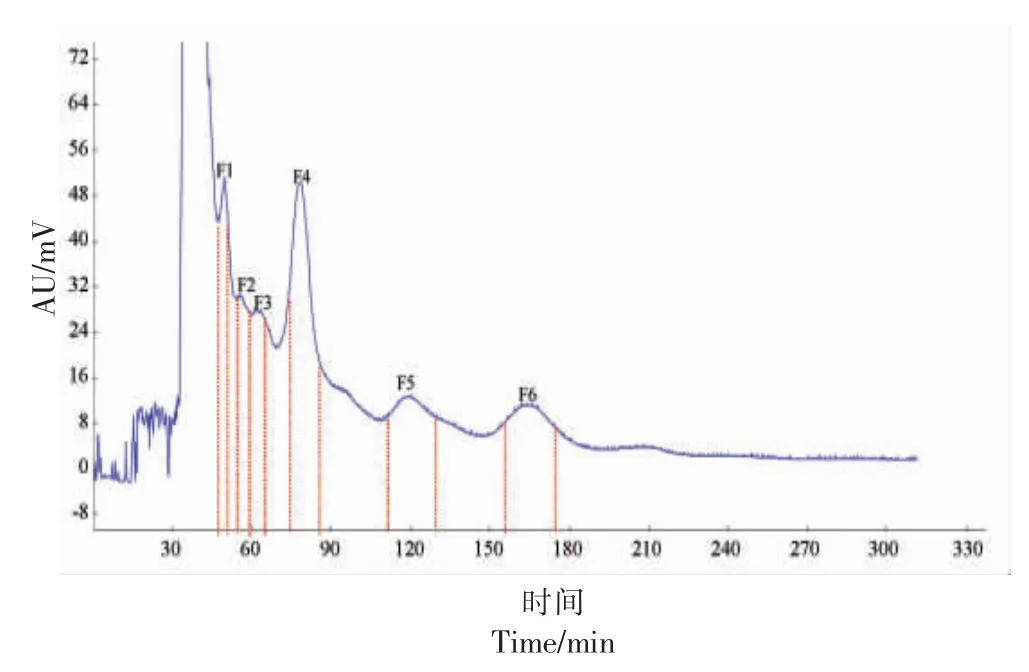
图2 HSCCC 分离样品4 活性成分的色谱图Fig.2 Chromatogram of active components in sample 4 separated by HSCCC
2.3 组分结构鉴定
2.3.1 HPLC 分析 采用HPLC 对样品4 和F4 进一步采用HPLC 分析,其结果如图3 所示。 由图3a~3b 可知,样品4 和F4 均有多个峰。说明样品4和F4 是混合物,含有多种组分,含量最高的组分被记为组分Ⅰ。采用Sephadex LH-20 葡聚糖凝胶进一步纯化F4,获得高纯度的组分Ⅰ。 组分Ⅰ的HPLC 图见图3c,由图3c 可知,组分Ⅰ仅有1 个单峰。 结果表明,组分Ⅰ为单一高纯度化合物,依据式(1)计算组分Ⅰ的纯度为95.06%。
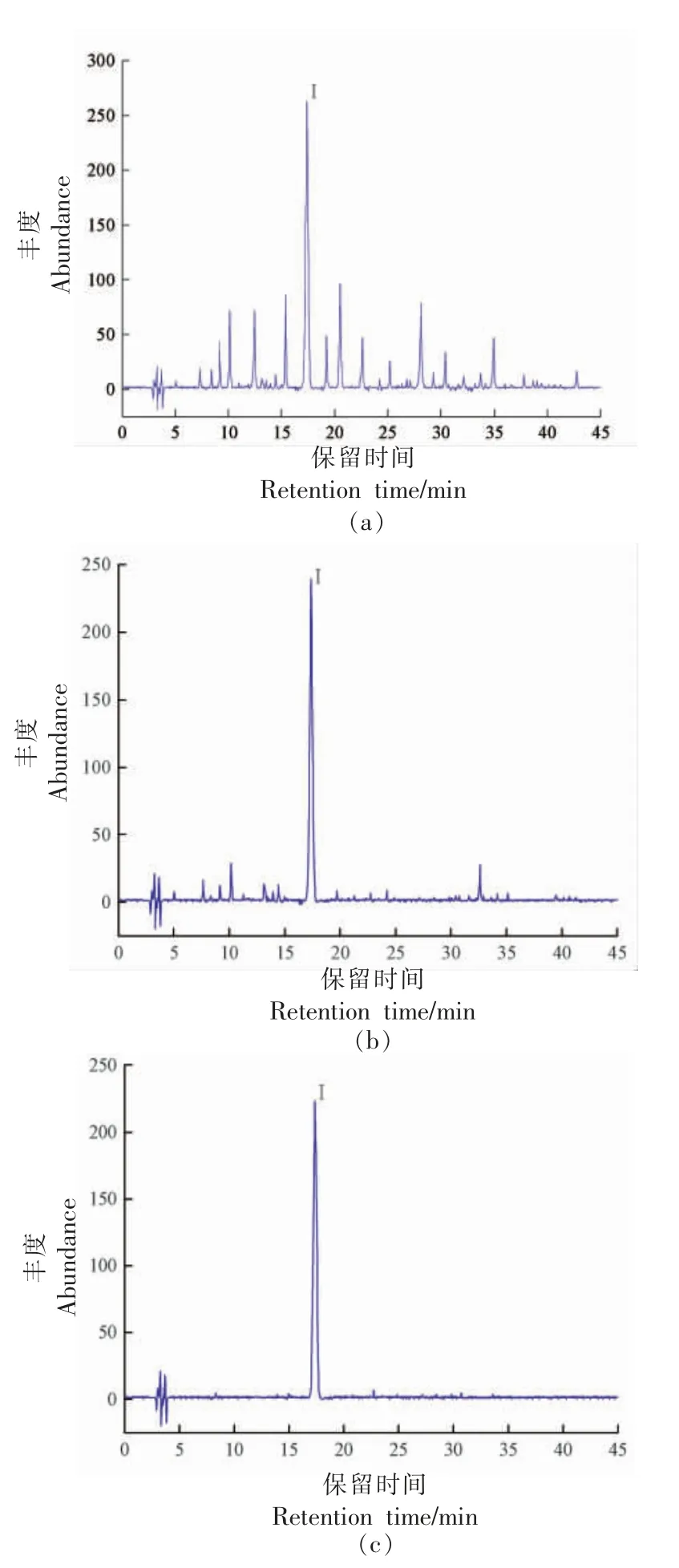
图3 样品4(a)、F4(b)和组分Ⅰ(c)的HPLC 色谱图Fig.3 HPLC chromatogram of sample 4 (a),F4 (b)and component I (c)
2.3.2 紫外和傅里叶红外光谱分析 为了鉴定组分Ⅰ的结构,首先利用紫外光谱对组分Ⅰ进行扫描,其结果如图4a 所示。 由图4a 可知,组分Ⅰ在278 nm 和519 nm 波长处具有特征吸收峰,说明组分Ⅰ属于花色苷类物质。 随后进一步对组分Ⅰ采用傅里叶红外光谱扫描,其结果如图4b 所示。 由图4b 可知,3 372 cm-1和2 927 cm-1波长处对应的吸收峰分别是由O-H 和C-H 伸缩振动引起[19]。1 631 cm-1波长处对应的吸收峰可能与C=C 剪切振动有关。此外,1 497 cm-1和1 116 cm-1之间的红外波段作为“指纹”区域,该区域是由C-O、C-C、C-H 伸缩振动引起,为有机化合物提供大量信息[20]。Molaeafard 等[21]和Ma 等[22]同样利用傅里叶红外光谱分析樱桃和黑米中花色苷的官能团。
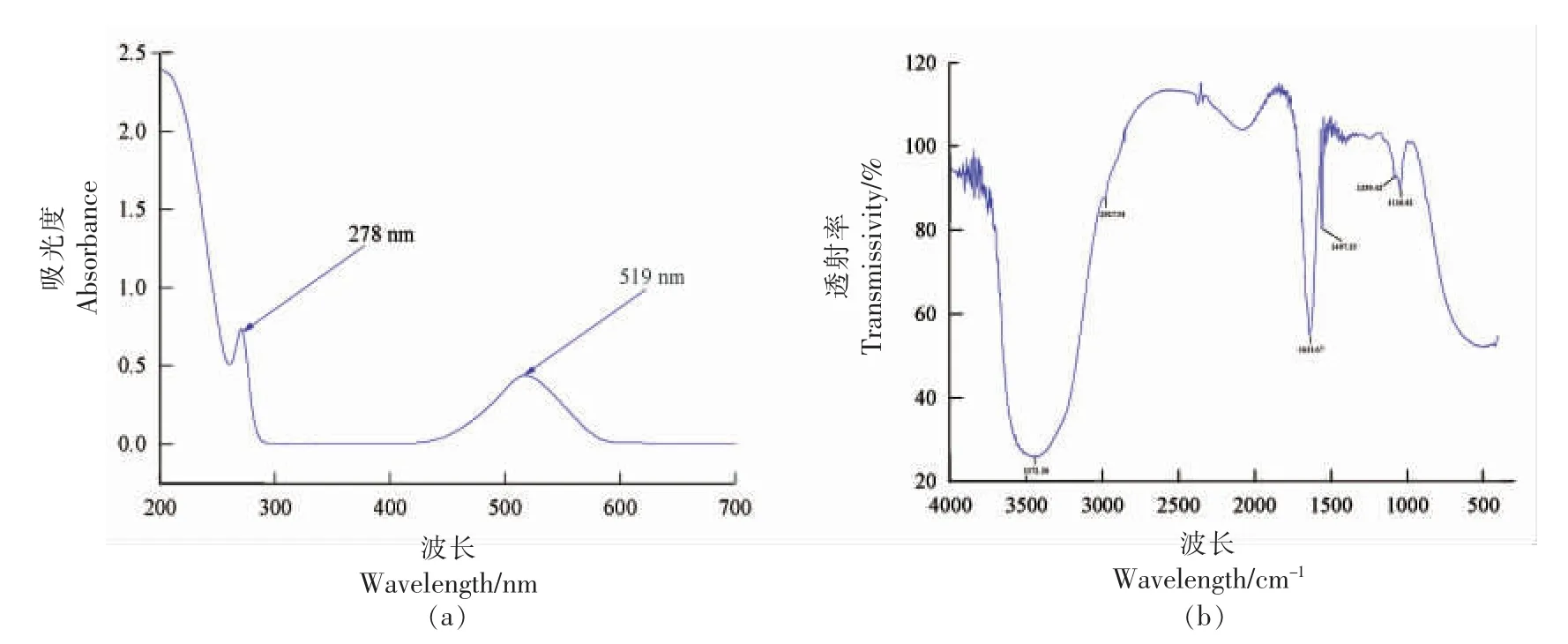
图4 组分Ⅰ的紫外(a)和傅里叶红外光谱(b)Fig.4 UV (a) and FTIR spectra (b) of component I
2.3.3 HPLC-MS 和NMR 分析 为进一步鉴定组分Ⅰ的结构,利用HPLC-MS、NMR 和参考文献共同确定组分Ⅰ的结构。 组分Ⅰ的一级质谱和二级质谱分别如图5a~5b 所示。组分Ⅰ分子离子峰[M+]为m/z 449.2,在质谱中,检测到碎片离子为m/z 287.1。 m/z 287 属于矢车菊素的特征离子,丢失的碎片m/z 162,可能是失去半乳糖和葡萄糖,同时检测到组分Ⅰ最大吸收波长为516 nm,参考相关文献报道[16],初步判断组分Ⅰ为矢车菊-3-O-葡萄糖苷。 随后对组分Ⅰ进行NMR 检测,数据如下:1H NMR (CF3COOD-CD3OD): δ6.64 (1H,d,J=1.2 Hz,H-6),δ6.86 (1H,d,J=1.2 Hz,H-8),8.22(1H,dd,J=8.8,2.2 Hz,H-60),8.02(1H,d,J=2.2 Hz,H-2'),7.04(1H,d,J=8.8 Hz,H-5'),8.98(1H,s,H-4); 5.31(1H,d,J=7.8 Hz,H-1 glc),3.69(1H,m,H-2 glc),3.56(2H,m,H-3,5 glc),3.46(1H,m,H-4 glc),3.73(1H,dd,J=12.2,5.6 Hz,H-6b glc),3.96(1H,dd,J=12.2,2.2 Hz,H -6a glc);13C NMR (CF3COOD -CD3OD): δ164.5 (C-2),145.8 (C-3),137.2(C-4),159.6 (C-5),103.7(C-6),170.8(C-7),95.4(C-8),157.9(C-9),113.6(C-10),121.5(C-1'),118.7 (C-2'),147.6 (C-3'),156.0 (C-4'),117.7(C-5'),128.4 (C-6'),104.1 (C-1 glc),75.0 (C-2 glc),78.3(C-3 glc),71.3(C-4 glc),79.0(C-5 glc),62.6(C-6 glc)。 组分Ⅰ1H 和13C 谱图如图5c~5d所示。 该研究结果与Lee 等[23]鉴定鹅掌楸果实中矢车菊-3-O-葡萄糖苷的NMR 信息一致。 故最终确定组分Ⅰ为矢车菊-3-O-葡萄糖苷 (Cyanidin-3-O-glucoside,C3G)。

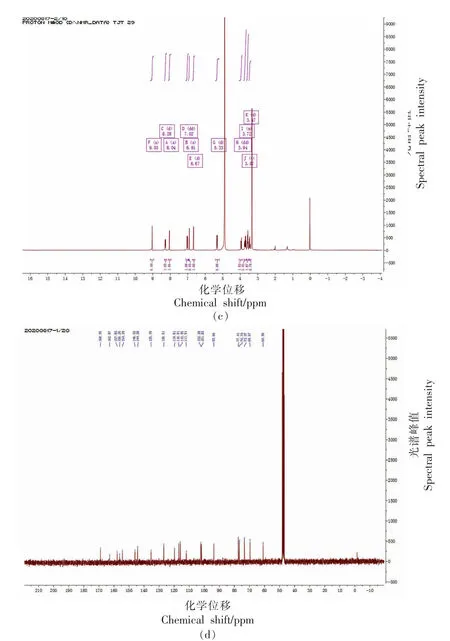
图5 组分Ⅰ一级质谱(a)、二级质谱(b)、1H(c)和13C(d)谱图Fig.5 primary mass spectrometry (a),secondary mass spectrometry (b),1H (c) and 13C spectra (d) of component I
组分Ⅰ(C3G)对α-葡萄糖苷酶的抑制率结果如图1d 所示。 由图1d 可知,随组分Ⅰ浓度增加α-葡萄糖苷酶抑制率显著增加(P<0.05),呈浓度依赖性。 对上述数据进行非线性拟合可得组分Ⅰ对α-葡萄糖苷酶抑制率的IC50值为(47.52±0.85)μmol/L。 因此,选取组分Ⅰ(C3G)进一步探究其与α-葡萄糖苷酶的相互作用。
2.4 荧光光谱分析
不同浓度C3G(0~160 μmol/L)对α-葡萄糖苷酶荧光光谱影响结果如图6a~6c 所示。由图6a~6c 可知,在3 个温度(25,30,37 ℃)下,α-葡萄糖苷酶的荧光强度随C3G 浓度增加而逐渐减弱。 温度和C3G 浓度越高,α-葡萄糖苷酶的荧光强度减弱越显著。结果表明,α-葡萄糖苷酶的荧光强度受C3G 浓度和温度依赖性猝灭的影响[18]。 此外,在C3G 作用下,α-葡萄糖苷酶的最大吸收峰(339 nm)没有发生移动。 表明C3G 可能与α-葡萄糖苷酶形成复合物,改变了α-葡萄糖苷酶中色氨酸的微环境,猝灭α-葡萄糖苷酶内荧光[12]。 戴涛涛[24]研究发现多酚类物质(原花青素B2 和茶多酚)能与α-葡萄糖苷酶结合猝灭α-葡萄糖苷酶内荧光。

图6 C3G 在25 ℃(a)、30 ℃(b)和37 ℃(c)时对α-葡萄糖苷酶荧光光谱的影响;C3G 对α-葡萄糖苷酶荧光猝灭的Stern-Volmer 曲线(d); C3G 对α-葡萄糖苷酶荧光猝灭修正的Stern-Volmer 图(e)Fig.6 The effect of C3G on the fluorescence spectrum of α-glucosidase at 25 ℃(a),30 ℃(b) and 37 ℃(c);Stern-Volmer curve of fluorescence quenching of α-glucosidase by C3G(d); Modified Stern-Volmer diagram of C3G on the fluorescence quenching of α-glucosidase (e)
2.4.1 荧光猝灭机制及结合常数 荧光光谱法是探究小分子物质与酶相互作用中最常用的一种方法,其原理是基于小分子活性成分与酶发生相互作用进而引起酶内源性荧光发生变化,并通过数据分析获得小分子活性成分与酶的结合常数和结合位点数等参数信息[17]。 采用Stern-Volmer 方程分析不同温度下(25,30,37 ℃)荧光数据,得到相关的参数,如表1 所示。
式中,F0和F——分别为在没有猝灭剂和有猝灭剂下反应体系荧光强度(au);Kq和Ksv——分别为α-葡萄糖苷酶猝灭速率和Stern-Volmer 猝灭常数;τ0——在没有猝灭剂下荧光分子寿命(s)。
由图6d 可知,在3 个温度下(25,30,37 ℃),Stern-Volmer 方程线性拟合较好,拟合R2均在0.95 以上。结果表明,α-葡萄糖苷酶荧光猝灭为动态猝灭或静态猝灭,相关的拟合参数如表1 所示。由表1 可知,在温度为25,30,37 ℃下,Ksv分别为(4.26±0.04)×103,(3.95±0.02)×103,(3.27±0.03)×103L/mol。 随温度升高Ksv降低,表明α-葡萄糖苷酶荧光猝灭过程为静态猝灭。此外,α-葡萄糖苷酶最小荧光猝灭速率为(3.27±0.03)×1011/L(mol·s),该值远大于最大动态荧光猝灭常数2×1010L/(mol·s)。 进一步表明α-葡萄糖苷酶荧光猝灭过程属于静态猝灭。在静态猝灭过程中,采用双对数方程计算C3G 与α-葡萄糖苷酶之间的结合常数(Ka)和结合位点数(n)。

表1 不同温度下C3G 与α-葡萄糖苷酶的猝灭和结合常数Table 1 The values of quenching and binding parameters for C3G binding with α-glucosidase at different temperatures
由图6e 可知,在3 个温度下(25,30,37 ℃),双对数方程线性拟合较好,拟合R2均在0.95 以上,回归计算所得结合常数(Ka)和结合位点数(n)可信度较高,相关数据如表1 所示。 由表1 可知,在温度为25,30,37 ℃下,Ka分别为 (1.30±0.01)×105,(1.27±0.03)×105,(1.11±0.02)×105L/mol。随温度升高Ka降低,说明C3G 与α-葡萄糖苷酶复合物的形成是个温和的过程。 在温度为25,30,37 ℃下,结合位点数(n)在1 附近,表示C3G 与α-葡萄糖苷酶有一个活性部位结合。
2.4.2 热力学参数 采用荧光数据计算热力学参数被用于确定C3G 与α-葡萄糖苷酶之间的相互作用。小分子与蛋白相互作用力主要有氢键、疏水相互作用、静电相互作用和范德华力等作用力。相关研究已经证实[25]:①当ΔS<0、ΔH<0,小分子和蛋白主要相互作用力为氢键; ②当ΔS>0、ΔH>0,小分子和蛋白主要相互作用力为疏水相互作用;③当ΔS>0、ΔH<0,小分子和蛋白主要相互作用力为静电相互作用。 采用Van't Hoff 方程计算C3G与α-葡萄糖苷酶结合过程中的ΔS、ΔH 和ΔG,其结果如表2 所示。
式中,ΔS——商变 (kJ/mol·K);ΔH——焓变(kJ/mol);ΔG——吉布斯自由能变(kJ/mol);R——理想气体状态常数(J/mol·K)。
由表2 可知,ΔS(kJ/mol·K)和ΔH(kJ/mol)分别为(-0.096±0.004)kJ/mol·K 和(-32.61±0.58)kJ/mol,ΔS 和ΔH 均为负值。 表明C3G 与α-葡萄糖苷酶主要相互作用力为氢键。 在25,30,37 ℃下,ΔG 分别为(-3.42±0.03),(-2.47±0.04),(-1.45±0.02)kJ/mol。不同温度下ΔG 为负值。说明C3G 与α-葡萄糖苷酶的结合是自发进行的。

表2 不同温度下C3G 与α-葡萄糖苷酶的热力学常数Table 2 Thermodynamic constants of C3G and α-glucosidase at different temperatures
2.5 圆二色谱分析
采用圆二色谱仪测定C3G 对α-葡萄糖苷酶二级结构 (α-螺旋、β-折叠、β-转角和无规则卷曲)的变化的影响,其结果如图7 和表3 所示。
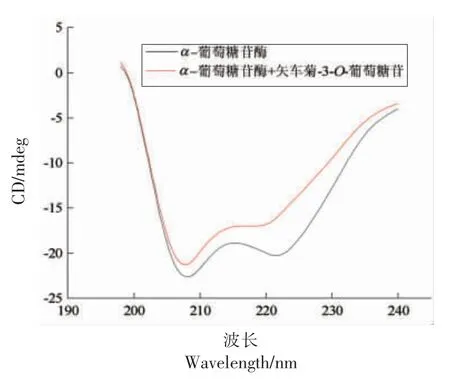
图7 C3G 对α-葡萄糖苷酶二级结构及含量的变化Fig.7 Changes of secondary structure and content of α-glucosidase by C3G
由图7 可知,当α-葡萄糖苷酶与C3G 作用后,α-葡萄糖苷酶负的椭圆峰上升,结果表明C3G的确影响了α-葡萄糖苷酶的二级结构。 图7 显示α-葡萄糖苷酶在209 nm 和221 nm 波长处出现2个负的椭圆峰,这个椭圆峰是α-螺旋结构特征。由表3 可知,α-葡萄糖苷酶二级结构中的α-螺旋、β-折叠、β-转角和无规则卷曲分别为22.6%±0.3%,23.4%±0.1%,24.2%±0.4%,32.3%±0.3%,当加入C3G 后,此时α-葡萄糖苷酶二级结构中的α-螺旋、β-折叠、β-转角和无规则卷曲分别为19.5%±0.3%,26.2%±0.3%,20.5%±0.5%,35.0%±0.4%。 结果表明加入C3G 后,α-葡萄糖苷酶二级结构中α-螺旋和β-转角显著降低(P<0.05),β-折叠和无规则卷曲显著增加(P<0.05)。 该现象可能是由于C3G 与α-葡萄糖苷酶的结合促进了蛋白质多肽链的去折叠,破坏了α-葡萄糖苷酶的氢键网络结构,进而导致α-葡萄糖苷酶构象发生改变[26]。

表3 C3G 对α-葡萄糖苷酶二级结构及含量的影响Table 3 Effect of C3G on the secondary structure and content of α-glucosidase
2.6 分子动力学模拟分析
采用AutoDock 软件对C3G 与α-葡萄糖苷酶进行分子对接,通过分子对接结果验证上述试验的结果。 经过100 次对接操作,从AutoDock 对接结果中选择能量最低、 组合数最多的一次作为最终分析结果,其对接结果如图8 所示。
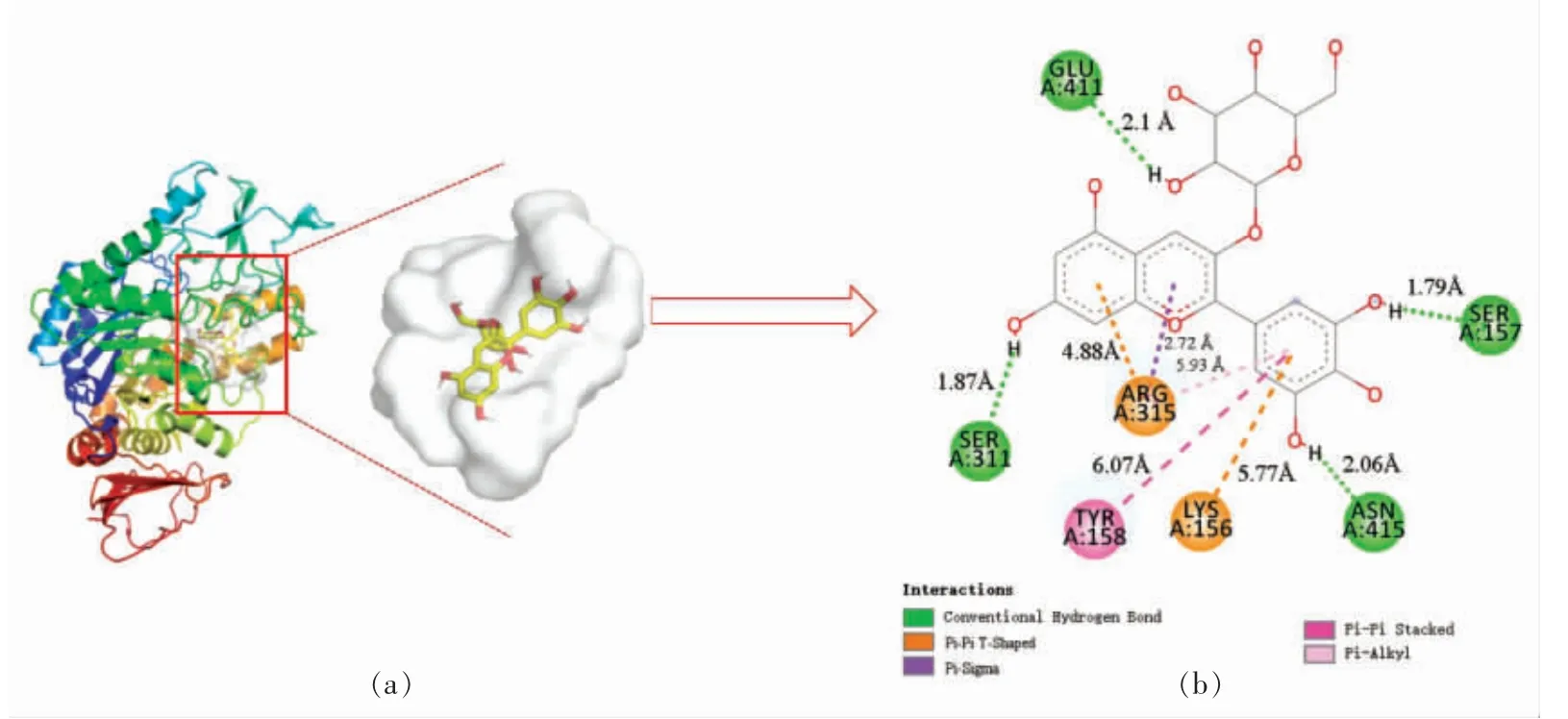
图8 α-葡萄糖苷酶与C3G 的3D 对接图(a)和二维平面对接图(b)Fig.8 3D docking diagram (a) and 2D planar docking diagram (b) of α-glucosidase and C3G
C3G 与α-葡萄糖苷酶形成复合物的捆绑结合能为-11.71 kcal/mol,该结果与估算的结合能一致,说明分子对接结果是准确可行的。 结合3D 对接模式和2 维示意图,可以清楚地显示C3G 插入到α-葡萄糖苷酶活动腔中。 图8b 展示C3G 与氨基酸残基发生相互作用,其中发生相互作用的氨基 酸 残 基 包 括Ser 157、Tyr 158、Phe 314、Arg 315、Asp 307、His 280、Val 232 和Leu 313,它们是C3G 与α-葡萄糖苷酶之间可能的相互作用位点。 C3G 和氨基酸残基 (Leu 313、Ser 157、Tyr 158、Phe 314、Arg 315 和2 个Asp 307)之间形成7 个氢键。 C3G 和氨基酸残基(Val 232、Leu 313、Arg 315 和His 280)之间形成4 种疏水相互作用(1 个Pi-Pi T-Shaped,1 个Pi-Cation 和2 个Pi-Alkyl)。Tyr 和Phe 具有固有的荧光吸收特性。C3G和α-葡萄糖苷酶的氨基酸残基(Tyr 和Phe)通过氢键形成复合物。 这一结果较好地解释了C3G 与α-葡萄糖苷酶相互作用降低α-葡萄糖苷酶荧光强度。 图8b 分别显示了7 个氢键的距离(2.12,3.47,2.01,2.60,2.58,2.13,2.18Å)和4 个疏水力的距离(6.18,5.81,4.71,4.52Å)。C3G 与α-葡萄糖苷酶相互作用的综合比较,证实氢键是C3G 与α-葡萄糖苷酶相互作用的主要驱动力。
3 结论
采用活性引导结合HSCCC 技术成功从蓝莓中分离获得纯度为95.06%的C3G,C3G 并对α-葡萄糖苷酶具有较强的抑制作用。此外,利用光谱分析和分子对接的方法阐明C3G 与α-葡萄糖苷酶相互作用的主要驱动力为氢键。 α-葡萄糖苷酶与C3G 结合后,其二级结构发生了不同程度的变化。 其中α-螺旋和β-转角含量降低,β-折叠含量和不规则的螺旋结构增加。 研究结果可为C3G 抑制α-葡萄糖苷酶的机制提供新的认识。
