基于TLR4/NF-κB通路研究穿心莲内酯对脑出血大鼠急性期炎症的影响*
2023-02-17姜燕强陈俊丽陈利平段国华张昆刘亚利刘英
姜燕强,陈俊丽,陈利平,段国华,张昆,刘亚利,刘英
武安市第一人民医院,河北 武安 056300
脑出血是指非外伤所导致的脑实质出血,约占脑卒中患者的30%,急性期死亡率超过35%,且超过50%的存活患者将伴有终身残疾,极大地威胁着患者的生命健康和生活质量[1]。病理学研究发现,脑出血初期即出现的炎性细胞浸润将加重脑组织水肿和继发性脑损伤,在脑出血疾病进展过程中发挥着重要作用。因此,抑制炎症反应作为脑出血的治疗靶点成为当前的研究热点[2]。小胶质细胞为先天性免疫细胞,其在脑出血后最先被活化并分泌趋化因子、前列腺素等参与炎症反应的调节,其中Toll样受体4(toll-like receptor 4,TLR4)/核转录因子-κB(nuclear transcription factor-κB,NF-κB)通路发挥着重要的调控作用[3-5]。
中医药是具有独特理论及技术方法的医药学体系,在脑出血治疗领域逐渐得到关注与认可。脑出血在中医属于“中风”范畴,气虚血瘀、痰瘀阻络是其主要病机[6]。中药穿心莲是爵床科植物穿心莲干燥地上部分,性寒、味苦,具有清热解毒、凉血消肿之功效,常用于急性菌痢、肺炎、气管炎、胃肠炎等疾病的治疗。穿心莲内酯(andrographolide)是中药穿心莲的主要有效成分,具有良好的抗炎活性,能够通过抑制TLR4/NF-κB通路改善脓毒症所致心肺组织炎症、细菌性肺部炎症[7-9]。基于此,本研究探讨穿心莲内酯对脑出血大鼠急性期炎症反应及TLR4/NF-κB通路的影响。
1 材料
1.1 实验动物240只清洁级健康雄性SD大鼠,7周龄,体质量220~240 g,购自河北省实验动物中心,实验动物生产许可证号:SCXK(冀)2018-004,动物合格号:202004012。分笼饲养1周后进行实验,饲养环境:温度25 ℃,相对湿度60%~70%,光照黑暗各12 h交替,自由进食和饮水。本实验经武安市第一人民医院医学伦理委员会审核批准(伦理批号:WASYY-KY-2020-013)。
1.2 药物与试剂穿心莲内酯胶囊(惠州市九惠制药股份有限公司,批号:20191217);尼莫地平胶囊(海南普利制药股份有限公司,批号:200125)。伊文思蓝(国药集团化学试剂有限公司,批号:W20190418);白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒、HE试剂盒(南京建成生物工程研究所,批号:200130、200413、200105、191014);TLR4抗体、NF-κB抗体、β-肌动蛋白(β-actin)抗体、IgG二抗、2,2′-联喹啉-4,4′-二甲酸二钠(2,2′-biquinoline-4,4′-dicarboxylic acid disodium salt,BCA)、增强型化学发光液(enhanced chemiluminescence,ECL)(北京博奥森生物技术有限公司,批号:bs-20595R、bs-20355R、bs-0061R、bs-0295G、D10616、C05-07004)。
1.3 仪器BN-51700型脑立体定位仪(美国Stoelting公司);100 μL微量注射器(上海安亭微量进样仪器厂);SpectraMax M3型多功能酶标仪(美国BioTek公司);Allegra 21R型低温离心机(美国Beckman公司);EG1150型包埋机、CM1950型冰冻切片机(德国Leica公司);SE300型蛋白质电泳仪(美国Hoefer公司);VE186型转膜仪(上海天能科技有限公司)。
2 方法
2.1 动物分组、模型制备与给药采用随机数字表法将240只大鼠随机分为假手术组、模型组、尼莫地平组和穿心莲内酯低、中、高剂量组,每组40只。除假手术组外,其余组大鼠均参照文献报道的自体血注射法制备脑出血大鼠模型[10],具体如下:大鼠禁食禁水12 h后,以3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉,经左侧股动脉取血后俯卧位固定于脑立体定位仪下,沿正中切开头皮和骨膜、暴露前囟,在中线右旁3.5 mm与前囟前 0.2 mm 交汇处钻孔,通过微量注射器在脑基底节区(深度6 mm)以10 μL·min-1速度注射50 μL自身股动脉血,无菌骨蜡封闭钻孔,逐层缝合皮肤。大鼠清醒后,按照Zea-Longa评分标准进行神经功能评分:神经功能无缺损为0分;左侧前肢不能完全伸展为1分;行走时向左侧转圈为2分;行走时向左侧倾倒为3分;意识丧失为4分。当大鼠的Zea-Longa 评分≥2分时,即为造模成功[11]。造模完成后,尼莫地平组灌胃给予浓度2 g·L-1的尼莫地平溶液[12],穿心莲内酯低、中、高剂量组分别灌胃给予浓度5 g·L-1、10 g·L-1、20g·L-1的穿心莲内酯溶液(根据人和大鼠药物剂量换算公式,分别为0.5倍、1倍、2倍的人临床剂量),假手术组和模型组灌胃给予等体积生理盐水,灌胃体积均为 5 mL·kg-1,每天1次,疗程7 d。
2.2 采用改良神经功能缺损评分标准(modified neurological scoring standard,mNSS)进行神经功能缺失评分按随机数字表法每组各取8只大鼠,对照mNSS评分标准对大鼠神经功能进行评分[13],得分越高则说明神经功能缺失越严重。
2.3 采用多田公式计算脑血肿体积[12]大鼠神经功能缺损评分后以3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉,颈椎脱臼处死大鼠并迅速断头,剥取脑组织并置于4%多聚甲醛溶液中固定72 h,采用高速冷冻切片机以注射给药针孔为中心连续切片(厚度0.5 mm),血肿为暗红色,检测血肿最大层面互为垂直的最大横径和最大纵径长度,然后根据多田公式计算脑血肿体积。
血肿体积(mm3)=(π/6)×最大横径(mm) ×最大纵径(mm)×血肿层数×切片厚度(mm)
2.4 干湿比重法计算脑含水量按随机数字表法各组另取8只大鼠,以3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉后,颈椎脱臼处死大鼠并迅速断头,剥取脑组织后采用生理盐水冲洗并拭干,取去除小脑和脑干后的大脑和间脑,称其质量为湿质量(W湿),置于烘箱中100 ℃烘干至恒质量后称其质量为干质量(W干),计算脑含水量。
脑含水量=(W湿-W干)/W湿×100%
2.5 伊文思蓝渗透法测定血脑屏障(blood brain barrier,BBB)通透性按随机数字表法各组另取8只大鼠,以4 mL·kg-1的体积尾静脉注射2%伊文思蓝溶液,1 h后以3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉,开胸暴露大鼠心脏,由左心室-右心耳通路由快到慢灌注300 mL生理盐水后大鼠断头并剥取脑组织,切取右侧半脑,研磨匀浆后加入质量体积比13的50%甲酰胺溶液,60 ℃ 孵育24 h后3 000 r·min-1离心10 min(离心半径8 cm),取上清液,酶标仪检测610 nm波长处的光密度值(optical density,OD),用标准液绘制标准曲线,然后根据标准曲线计算脑组织伊文思蓝含量,通过脑组织伊文思蓝含量反映BBB通透性。
2.6 HE染色检查脑组织病理学按随机数字表法各组另取8只大鼠,以3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉后,颈椎脱臼处死并迅速断头、剥取脑组织,置于4%多聚甲醛溶液中固定72 h后,通过高速冷冻切片机、以注射给药针孔为中心连续切片(厚度4 μm),按照HE染色试剂盒操作说明依步处理,通过光学显微镜观察各组大鼠脑组织病理学改变。
2.7 ELISA法检测脑组织和血清中IL-1β、IL-6、TNF-α的水平取各组剩余的8只大鼠,以 3 mL·kg-1的体积腹腔注射10%水合氯醛溶液实施麻醉后,经腹主动脉取血并1 500 r·min-1离心 5 min(离心半径8 cm),取血清。颈椎脱臼处死大鼠,迅速断头、在冰上剥取脑组织,取右脑注射给药针孔周围脑组织,剪碎后加入4 ℃ RIPA裂解液在冰上静置30 min使其充分裂解,3 500 r·min-1离心10 min(离心半径8 cm),取上清液。参照ELISA试剂盒操作说明书,依步骤处理后通过酶标仪检测脑组织和血清中IL-1β、IL-6、TNF-α的水平。
2.8 Western Blot检测脑组织TLR4、NF-κB蛋白表达水平取2.7制备的脑组织裂解溶液,4 ℃、12 000 r·min-1离心25 min(离心半径8 cm)后取上清液,BCA法检测总蛋白浓度,沸水浴10 min使蛋白变性后分别取30 μg蛋白行SDS-PAGE凝胶电泳(120 V电压50 min,80 V电压40 min)分离蛋白,湿法转PVDF膜后置于5%脱脂奶粉溶液室温封闭2 h,滴加TLR4(稀释比例为11 000)、NF-κB(稀释比例为11 000)、β-actin(稀释比例为 12 000)抗体后4 ℃孵育过夜,洗膜后滴加IgG二抗(稀释比例为15 000)室温孵育1.5 h,洗膜后滴加ECL显色,以目标蛋白条带灰度值与内参(β-actin)条带灰度值的比值计算目标蛋白相对表达量。

3 结果
3.1 各组大鼠神经功能缺失评分、脑血肿体积、脑含水量比较与假手术组比较,模型组大鼠神经功能缺失评分、脑血肿体积、脑含水量显著升高(P<0.01);与模型组比较,穿心莲内酯中、高剂量组和尼莫地平组大鼠神经功能缺失评分、脑血肿体积、脑含水量显著降低(P<0.05或P<0.01);与尼莫地平组比较,穿心莲内酯高剂量组神经功能缺失评分、脑血肿体积显著降低(P<0.05或P<0.01)。见图1,表1。

表1 各组大鼠神经功能缺失评分、脑血肿体积、脑含水量比较
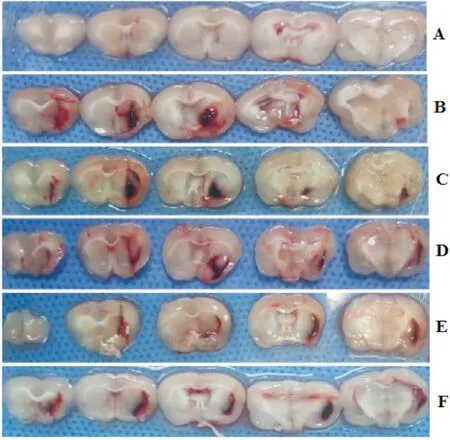
注:A:假手术组;B:模型组;C:穿心莲内酯低剂量组;D:穿心莲内酯中剂量组;E:穿心莲内酯高剂量组;F:尼莫地平组
3.2 各组大鼠脑组织病理学改变HE染色发现,假手术组大鼠未见脑组织血肿,脑组织形态和结构未见异常;模型组大鼠可见血肿红细胞,脑组织呈现明显水肿,神经元数量减少、形态不规则、间隙增大,胞核固缩深染、大量炎性细胞浸润等病理学改变;与模型组比较,穿心莲内酯低、中、高剂量组和尼莫地平组大鼠脑组织病理学改变呈现不同程度的改善,且穿心莲内酯高剂量组效果最佳。见图2。
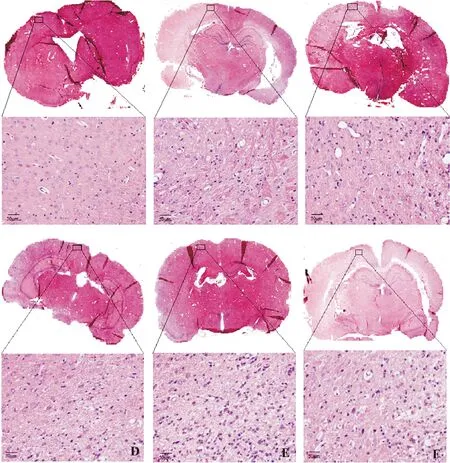
注:A:假手术组;B:模型组;C:穿心莲内酯低剂量组;D:穿心莲内酯中剂量组;E:穿心莲内酯高剂量组;F:尼莫地平组
3.3 各组大鼠BBB通透性比较与假手术组比较,模型组大鼠脑组织伊文思蓝含量显著升高(P<0.01);与模型组比较,穿心莲内酯中、高剂量组和尼莫地平组脑组织伊文思蓝含量显著降低(P<0.01);与尼莫地平组比较,穿心莲内酯高剂量组脑组织伊文思蓝含量显著降低(P<0.01)。见图3、表2。

注:A:假手术组;B:模型组;C:穿心莲内酯低剂量组;D:穿心莲内酯中剂量组;E:穿心莲内酯高剂量组;F:尼莫地平组

表2 各组大鼠脑组织伊文思蓝含量比较
3.4 各组大鼠脑组织和血清IL-1β、IL-6、TNF-α水平比较与假手术组比较,模型组大鼠脑组织和血清IL-1β、IL-6、TNF-α含量均显著升高(P<0.01);与模型组比较,穿心莲内酯中、高剂量组和尼莫地平组脑组织和血清IL-1β、IL-6、TNF-α含量均显著降低(P<0.05或P<0.01);与尼莫地平组比较,穿心莲内酯高剂量组脑组织IL-6、TNF-α 含量显著降低(P<0.05),血清IL-6、TNF-α 及IL-1β含量极显著降低(P<0.01)。见表3。

表3 各组大鼠脑组织及血清中IL-1β、IL-6、TNF-α水平比较
3.5 各组大鼠脑组织TLR4、NF-κB蛋白表达水平比较与假手术组比较,模型组大鼠脑组织TLR4、NF-κB蛋白表达水平显著上调(P<0.01);与模型组比较,穿心莲内酯中、高剂量组和尼莫地平组TLR4、NF-κB蛋白表达水平显著下调(P<0.01);与尼莫地平组比较,穿心莲内酯高剂量组TLR4、NF-κB蛋白表达水平显著下调(P<0.05)。见图4、表4。

注:A:假手术组;B:模型组;C:穿心莲内酯低剂量组;D:穿心莲内酯中剂量组;E:穿心莲内酯高剂量组;F:尼莫地平组

表4 各组大鼠脑组织TLR4、NF-κB蛋白相对表达量比较
4 讨论
脑出血是一种发病急且致残、致死率高的脑血管疾病,目前临床上主要采取外科手术结合血压管理的治疗方案,虽能挽救部分患者生命,但急性期死亡率和存活患者残疾率仍居高不下。脑出血病理机制复杂,其中炎症反应在脑出血急性期及继发性脑损伤过程中发挥着重要作用[14]。
随着中医药现代化研究的深入,中药活性提取物在临床中的应用逐渐广泛。穿心莲内酯为我国传统中药穿心莲的主要有效成分,属于二萜内酯类化合物,具有良好的抗炎活性,目前临床上主要用于上呼吸道感染、细菌性痢疾的治疗。尼莫地平为钙离子拮抗剂类降压药,是临床防治蛛网膜下腔出血等急性脑血管病的常用药物。本实验采用自体血注射法制备脑出血大鼠模型,模型大鼠呈现明显的神经功能缺失、脑含水量升高,脑组织可见水肿、神经元数量减少、胞核固缩深染、炎性浸润等病理学改变,与田青等[15]报道一致。进一步研究发现,经穿心莲内酯或尼莫地平治疗7 d能够明显降低脑出血大鼠急性期神经功能缺失评分、脑含水量和脑血肿体积,明显改善脑出血所致脑组织病理学改变,改善BBB通透性,并且穿心莲内酯高剂量组效应优于尼莫地平组,提示穿心莲内酯具有抑制脑出血大鼠急性期脑组织损伤的作用。
炎症反应贯穿在出血性脑损伤的全过程,是导致继发性脑损伤的重要原因。小胶质细胞、星型胶质细胞、中性粒细胞、T淋巴细胞等均参与脑出血后炎症反应过程[16]。其中,小胶质细胞是特异性存在于脑组织中的免疫细胞,具有抗原传递、炎症反应调节等生理学作用,脑出血发生后血肿占位和颅内高压等将病理性刺激小胶质细胞活化,分泌细胞因子、炎性趋化因子而引发炎症级联反应[17]。活化小胶质细胞分泌的TNF-α、IL-1β、IL-6是引发机体炎症反应的重要原因,并且IL-1β、TNF-α作为炎性趋化因子能够进一步刺激粒细胞合成与释放 IL-6 等炎性因子,从而形成炎症级联反应[18]。此外,脑出血后,星型胶质细胞能够被病理性激活,进而释放IL-6、环氧化酶-2(cyclooxygenase-2,COX-2)等炎性细胞因子[19];中性粒细胞黏附于血肿周围脑血管内皮细胞,快速浸润进入脑组织并释放炎性趋化因子[20];T淋巴细胞是细胞免疫系统的重要组成部分,有研究发现,脑出血后T淋巴细胞CD4+、CD8+等能够通过BBB进入脑组织而引发炎症反应[21]。紧密连接复合体是BBB的基础结构,陆正齐[22]和Dohgu等[23]研究发现,IL-1β、IL-6、TNF-α将破坏紧密连接复合体的结构并诱导内皮细胞黏附分子表达,从而导致BBB通透性升高。本研究发现,穿心莲内酯或尼莫地平治疗7 d能够明显降低脑出血大鼠急性期脑组织和血清 IL-1β、IL-6、TNF-α含量,并且穿心莲内酯高剂量组的效应明显优于尼莫地平组,提示穿心莲内酯对脑出血后炎症反应具有抑制作用,并说明穿心莲内酯对脑出血后BBB损伤的保护作用可能与其抑制炎症作用有关。
TLR是一类跨膜识别受体,其中TLR4广泛存在于中枢神经系统小胶质细胞、星形胶质细胞、中性粒细胞及淋巴细胞中,在脑组织免疫应答及炎症反应调节过程中发挥着重要的信号传导作用[24]。本研究发现,脑出血大鼠脑组织TLR4蛋白表达水平明显上调,该结果与张玉杰等[25]研究报道一致。NF-κB为TLR4下游靶基因,能够被TLR4诱导表达与活化,活化NF-κB核转位后能够诱导IL-1、IL-1β、IL-6、TNF-α等炎性因子释放,从而加重炎症反应[26]。因此,TLR4/NF-κB信号通路在脑组织炎症反应过程中具有重要调控作用。本研究结果显示,穿心莲内酯或尼莫地平治疗7 d能够明显下调脑出血大鼠脑组织TLR4、NF-κB蛋白表达水平,并且穿心莲内酯高剂量组对TLR4、NF-κB表达的调节作用优于尼莫地平组,提示穿心莲内酯对脑出血后炎症反应的抑制作用可能与抑制TLR4/NF-κB信号通路有关。
综上所述,穿心莲内酯能够抑制脑出血大鼠急性期炎症反应,减轻脑组织损伤,其机制可能与穿心莲内酯抑制TLR4/NF-κB信号通路激活有关,本研究结果为穿心莲内酯作为脑出血急性期治疗备选药物提供了支持。
