鼻咽癌放疗后颅底组织坏死的CT影像分级及手术治疗探讨
2023-02-17邱前辉陈海铃刘遗斌高俊潇朱振潮
邱前辉, 陈海铃, 崔 毅, 刘遗斌, 高俊潇, 朱振潮
鼻咽癌是我国南方最常见的恶性肿瘤之一,目前放疗是鼻咽癌无远处转移时的首选治疗方法[1]。但伴随而来的是各种并发症,其中颅底放射性组织坏死是鼻咽癌放疗后最严重的并发症之一,总发病率为10.1%[2-3],潜伏期平均为放疗后7年,单程放疗者发生颅底放射性骨坏死的潜伏期为3~15年,而再次放疗者潜伏期缩短至7月~2年[4],严重影响患者的生活质量,甚至危及生命[5]。截至目前,治疗方法从药物、高压氧、鼻咽清创术,发展到内镜经鼻入路手术清除颅底坏死骨[6]。基于目前本病内镜手术治疗的不确定性,我们试图找到可以预测预后、评估手术操作难度和风险的分级方法。鉴此,本研究回顾分析100例手术患者的相关临床资料,根据患者病变部位的影像资料、手术风险和手术效果对放射性组织坏死提出了初步分级建议,并提出了治疗和修复的要点。
1 资料与方法
1.1临床资料 筛选了2017年1月至2020年1月南方医科大学珠江医院、广东省人民医院收治的临床资料齐全的100例手术患者,均为鼻咽癌放疗后颅底组织坏死确诊者。纳入标准:(1)有鼻咽癌放疗史;(2)主诉头痛、头晕、鼻臭、鼻出血等症状;(3)有1个月内的鼻内镜和(或)鼻咽纤维镜资料,内镜检查可见鼻咽颅底表面坏死软组织;(4)具有术前详细的鼻咽颅底CT和(或)MRI影像资料;(5)由笔者主刀行内镜鼻咽坏死清除术以避免手术技能造成的差异性。排除标准:术后病理发现合并鼻咽癌复发患者。具体临床资料见表1。

表1 100例患者临床资料
续表1
1.2评估方法 (1)术前:每位患者均接受病史(包括年龄、性别、病程、放疗次数)的基线评估,所有患者在入院时进行薄层CT平扫、三维重建及头颈部血管造影(computed tomography angiography,CTA)。对纳入患者进行颅底解剖部位的影像判断,并且采用CT三维重建选择平行于颅底平面的最大面积测量。(2)术后:复查薄层CT平扫,必要时进行磁共振检查进一步验证诊断结果,术后行内镜检查黏膜瓣的存活情况,将术后黏膜瓣存活、内镜和CT提示术腔无病变残留或进展定义为手术成功。术后发生临床恶化和(或)紧急指征(如颈内动脉破裂出血或颅内感染),根据相关的临床共识进行介入治疗或抗感染治疗[7-8]。
1.3分级方法 根据病变的部位、操作难度、临床手术风险,分级方法见表2。所有CT影像资料输入ITK-Snap 3.6.0软件,分别对水平、冠状位及矢状位进行标注,使病变组织与正常组织分离,通过软件处理,形成病变组织的整体三维图像。Ⅰ~Ⅳ级颅底组织坏死解剖范围见图1。

表2 颅底组织坏死解剖范围分级方法

图1 Ⅰ~Ⅳ级颅底组织坏死解剖范围示意图
1.4手术处理原则和方式 经鼻内镜下尽可能切除颅底放射性坏死骨和软组织,在保证血供较为丰富的组织创面前提下,进行创面及颅底修复。
1.5统计学方法 应用SPSS25.0统计软件进行数据分析。对非正态分布数据进行组间比较时,采用Kruskal-Wallis H检验来评估组间的显著差异性,并采用logistic单因素、多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1影像学检查结果 通过拟定的分级标准划分,100例患者中Ⅰ级17例,Ⅱ级30例,Ⅲ级22例,Ⅳ级26例,Ⅴ级5例。采用平行于蝶鞍-斜坡-枕骨骨质的切面,测量颅底坏死病灶的最大面积,采取我们前期的研究作为分组依据[5]。Ⅰ级病灶最大面积1.02(0.00,2.71)cm2,Ⅱ级5.46(3.16,8.85)cm2,Ⅲ级11.59(4.41,21.58)cm2,Ⅳ级12.07(8.43,18.00)cm2,差异有统计学意义(H=23.194,P<0.001),提示分级越高,病变范围越大。
2.2放疗次数与手术成功率的分析结果 二程放疗患者的手术成功率(45.71%,16/35)显著低于一程放疗(84.62%,55/65)(χ2=16.720,P<0.001),说明辐射累积剂量对术后黏膜瓣的存活有影响。
2.3修补黏膜瓣及效果 Ⅰ~Ⅲ级69例中,有63例修补采用鼻内黏膜瓣(包括鼻中隔带蒂瓣、游离鼻甲黏膜瓣),6例未使用黏膜瓣修复;Ⅳ级26例患者中21例采用鼻内黏膜瓣,5例采用颞肌瓣;Ⅴ级5例患者中4例采用鼻内黏膜瓣,1例采用颞肌瓣。比较鼻内黏膜瓣(鼻中隔带蒂瓣和游离鼻甲黏膜瓣)的生长情况,27例采用游离鼻甲黏膜瓣修复,成活18例,成功率为66.67%;61例采用鼻中隔带蒂瓣修复,成活42例,成功率为68.85%,二者相比较,未发现有明显差异(χ2=3.277,P=0.365)。综合比较Ⅳ、Ⅴ级患者中鼻内黏膜瓣和颞肌瓣二者的生长情况发现,颞肌瓣存活率[考虑1例颞肌瓣末端部分坏死,列为不成功,总成活率为83.30%(5/6),其中Ⅳ级80.00%(4/5),Ⅴ级100.00%(1/1)]高于鼻内黏膜瓣[总成活率为40.00%(10/25),其中Ⅳ级47.62%(10/21),Ⅴ级0%(0/4)],且差异有统计学意义(P<0.05)。
2.4影响手术成功率的logistic回归分析结果 多因素logistic回归分析结果显示,放疗次数(OR=0.214,P=0.004)、CT分级(OR=19.371,P=0.022)是影响手术成功率的独立危险因素(P<0.05)。见表3。
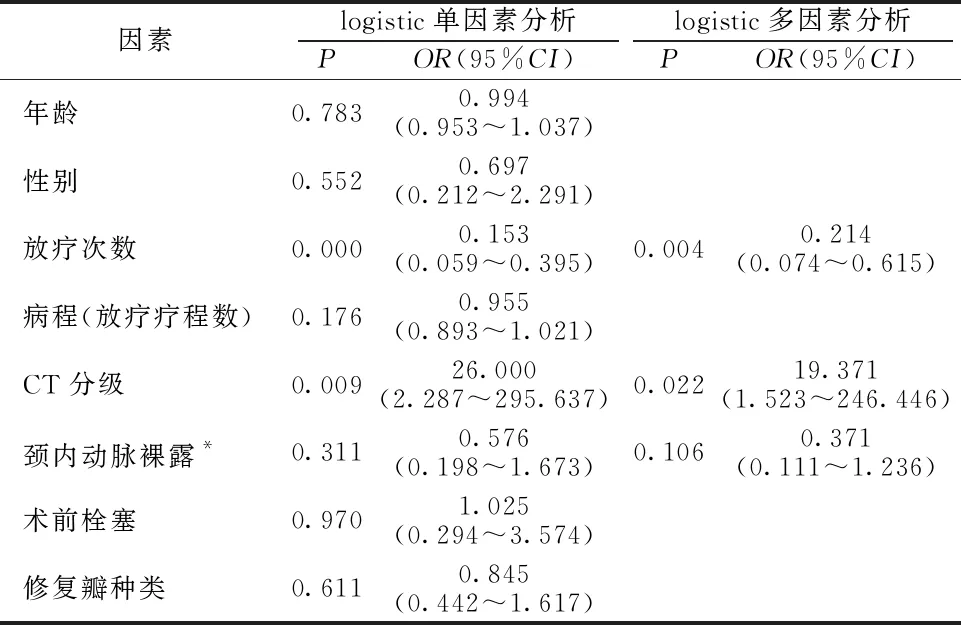
表3 影响手术成功率的logistic回归分析结果
2.5不同分级的手术成功率比较 手术总成功率为71.00%,其中Ⅰ级88.24%,Ⅱ级86.67%,Ⅲ级68.18%,Ⅳ级53.85%(鼻内黏膜瓣47.62%,颞肌瓣80.00%),Ⅴ级20.00%(鼻内黏膜瓣0%,颞肌瓣100%)。不同分级之间的手术成功率差异有统计学意义(χ2=7.814,P=0.047)。见表4。不同分级患者的CT图像及内镜照片见图2~6。

表4 不同分级手术成功率比较
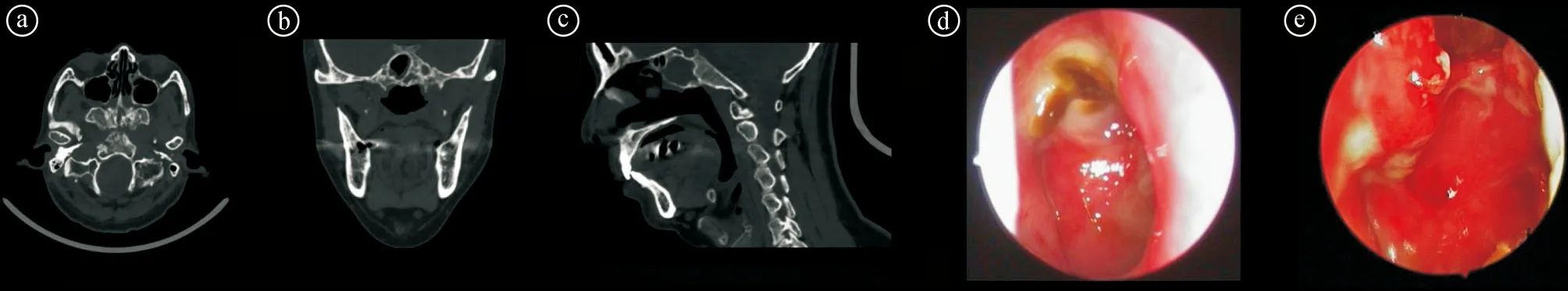
ⓐ~ⓒ术前的CT图像;ⓓ术前鼻内镜检查照片;ⓔ手术后鼻内镜检查照片
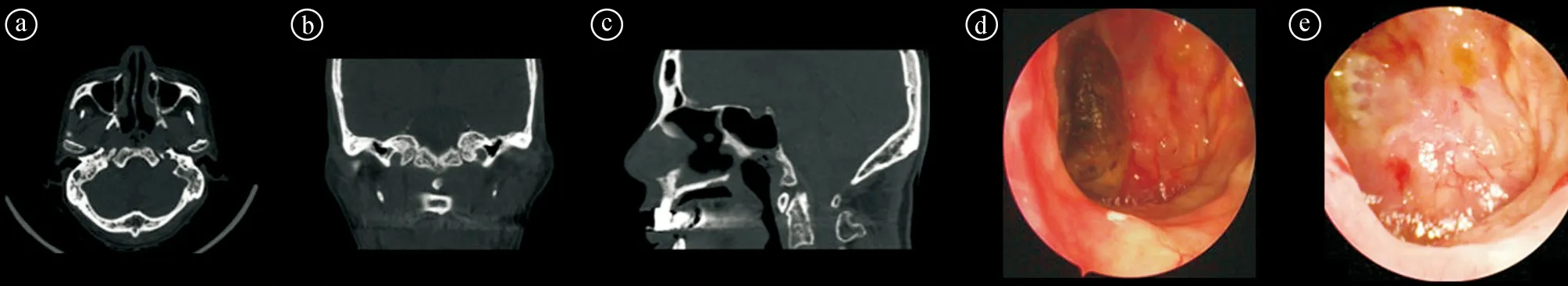
ⓐ~ⓒ术前的CT图像;ⓓ术前鼻内镜检查照片;ⓔ手术后鼻内镜检查照片

ⓐ~ⓒ术前的CT图像;ⓓ术前鼻内镜检查照片;ⓔ手术后鼻内镜检查照片

ⓐ~ⓒ术前各方位的CT图像;ⓓ术前鼻内镜检查照片;ⓔ采用带蒂鼻中隔黏膜瓣修复后复查部分坏死
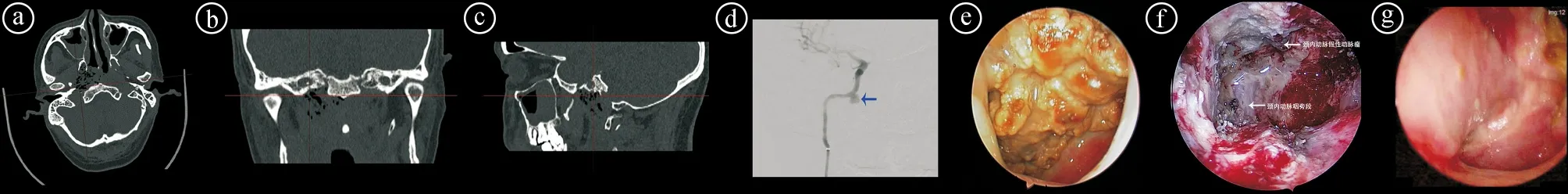
ⓐ~ⓒ术前各方位的CT图像;ⓓ术前的数字减影血管造影(digital subtraction angiography,DSA)图像,蓝色箭头处指的是右侧颈内动脉岩骨段假性动脉瘤;ⓔ术前内镜图,结合CT骨窗,可以判断坏死灶与颈内动脉的相对位置;ⓕ术中鼻内镜图像;ⓖ采用颞肌瓣术后内镜图像
2.6并发症发生情况 住院时间3~13 d,中位住院时间为5 d。随访时间6~64个月,中位随访时间为10.29个月。4例采用鼻内黏膜瓣修复的Ⅴ级患者在术后6~22个月后出现大出血而行介入手术,1例Ⅲ级患者在术后18个月出现迟发性脑脊液漏。除4例因恶病质死亡外,其他患者在随访时间内未发生明显手术并发症。
3 讨论
3.1放射性组织坏死的病理生理学可以描述为辐射导致的不愈合伤口[9]。还有学者提出放射线诱发纤维萎缩的机制,包括纤维化前特异性炎症阶段、成纤维化细胞阶段、基质致密化和重塑阶段,可最终导致组织坏死[10]。该类患者常表现为鼻腔恶臭、头痛、鼻出血或耳道出血,及时清除病灶有利于阻止病情进展[9]。本研究入组的患者中,表现有头痛66例(66.00%),鼻腔恶臭34例(34.00%),鼻出血14例(14.00%)。
3.2放射性组织坏死的发生和严重程度与辐射剂量、放射疗法、原肿瘤体积和患者自身因素有关,尤其与辐射剂量有关[11-12]。由于鼻咽癌的治疗需要高辐射剂量,颅底放射性组织坏死在鼻咽癌放疗后患者中常见[13]。虽然随着放疗技术的进步,从20世纪90年代的常规二维放射治疗到三维放射治疗,至目前调强放射治疗的应用,特别调强放射治疗能够在保留器官的同时,向肿瘤靶区提供更高、更准确的剂量[14],患者的生存率得到了很大提高,但放疗后的并发症仍未解决。Han等[11]通过分析1 348例接受1个疗程放疗的病例资料发现,当鼻咽总辐射剂量超过72 Gy时,放射性骨坏死的发生率明显上升。Chen等[13]回顾分析67例接受放疗的鼻咽癌患者的MRI胶片,发现颅底坏死区域和辐射最高剂量区域具备一致性。对于复发的患者,调强放射治疗是目前最常用的方式[15],大多数方案是向复发病灶递送约60 Gy的辐射剂量[3],而再次放疗后辐射剂量的累积促进了骨坏死的进展。Liu等[16]在最新局部早期复发鼻咽癌的前瞻性研究中,对比了内镜手术与二程放疗(调强放射治疗)之间的安全性,99例采用内镜治疗的患者中仅4例(4.04%)发生了放射性骨坏死,101例采用二程放疗的患者中24例(23.76%)发生了骨坏死。本研究有35例二程放疗患者,其中27例(77.14%)归为Ⅲ~Ⅴ级,即范围广泛或高风险的级别,而一程放疗的65例患者中仅26例(40.00%)归为Ⅲ、Ⅳ级。根据本次研究纳入的数据分析,放疗次数是影响手术成功率的独立危险因素,二程放疗患者的手术成功率(45.71%)显著低于一程放疗(84.62%),说明辐射累积剂量对手术成功率有影响。
3.3内镜下鼻咽颅底坏死组织清除并组织创面修复术是目前治疗鼻咽癌放疗后放射性组织坏死最常用方法和有效途径,由于病灶范围和部位不同,手术切除和修复难度差异较大。2000年Chang等[17]报道6例鼻咽癌放疗后颅底骨坏死患者用鼻内镜行颅底放射性骨坏死切除,5例治愈,1例症状明显改善。2004年黄晓明等[6]报道15例放射性骨坏死病例,其中9例局限性颅底放射性骨坏死内镜手术治疗,2例死于放射性颞叶坏死,7例生存,生存时间2~7年;5例广泛性颅底放射性骨坏死和1例局限性颅底放射性骨坏死保守治疗,3例死于鼻咽大出血,1例死于呼吸循环衰竭,2例生存(生存时间3~5年)。2016年王雅宁等[18]报道7例鼻咽部放射性骨坏死患者,2例于术后1年分别因颅内感染、肺部感染死亡,5例生存。5例存活患者中,3例感染控制,骨质坏死未见扩大,2例放射性骨坏死范围扩大。2016年本研究团队首次报道了广泛性颅底放射性骨坏死内镜手术治疗,17例鼻咽癌放疗后广泛性颅底放射性骨坏死患者,12例患者清除颅底坏死骨并行创面软组织重建,5例患者仅清除颅底坏死骨,未行软组织修复,全部患者未行颅底骨质缺损重建,无围手术期死亡,随访时间8个月~6年,仅1例患者术后第4年出现迟发性脑脊液鼻漏,其余无并发症发生[5]。2017年,Yang等[19]报道了276例鼻咽黏膜坏死和(或)颅底放射性骨坏死的患者进行内镜下鼻咽颅底切除术后,1年和2年总生存率分别为65.0%和51.6%。在内镜手术普及前,放射性骨坏死多采用保守治疗,当颈内动脉暴露于坏死灶时,死亡率高达72.7%[13,19]。而颈内动脉、颈总动脉覆膜支架植入治疗具有较好的止血效果[20]。本研究中有18例(18.00%)颈内动脉暴露,其中Ⅳ级13例,Ⅴ级5例,均未在围手术期因大出血发生死亡。值得注意的是,该类放射性组织坏死患者常合并严重放射性脑病和(或)后组颅神经放射性损伤等后遗症,表现为低血压、电解质紊乱,吞咽功能障碍引起营养不良、吸入性肺炎等,最终导致恶病质。本研究100例患者中有4例死亡,其中Ⅱ级、Ⅳ级各2例。死亡原因均为恶病质,因此必须重视术前术后的支持治疗。
3.4颅底创面修复时,所在部位的累积辐射剂量对组织瓣存活有很大影响,一般认为带蒂瓣比游离瓣能承受更大的辐射危害[21],对于Ⅱ级、Ⅲ级以及累及颈内动脉骨管和(或)海绵窦的病例,创面修复时,采用对侧带蒂鼻中隔黏膜瓣为佳。为尽量满足黏膜瓣覆盖创面范围,制作鼻中隔黏膜瓣时,尽量靠前并可扩大到鼻底部。本研究Ⅲ级愈合不佳7例患者中2例黏膜瓣术后萎缩,5例术中遗漏坏死骨质。如遇超大范围创面,鼻腔组织缺损、无法取材,颅底放射性组织坏死波及脑膜致脑脊液漏病例,建议优先选择颞肌瓣[5]。本研究61例采用了鼻中隔带蒂瓣修补,27例采用游离鼻甲黏膜瓣,6例采用颞肌瓣,鼻内黏膜瓣(鼻中隔带蒂瓣和游离鼻甲黏膜瓣)的生长情况比较未发现有明显差异。为保障游离瓣成活,创面制作是关键,骨面需要达正常骨质并有“渗血”状态,而非“象牙白”骨面,最好是软组织裸露,这样可保障组织瓣成活的足够血供。比较Ⅳ~Ⅴ级中鼻内黏膜瓣和颞肌瓣二者的生长情况发现,颞肌瓣存活率(83.30%,1例颞肌瓣末端部分坏死)高于鼻内黏膜瓣(40.00%)且差异有统计学意义(P<0.05),说明病灶范围过大,颅底重建需要采用血供佳、足够厚的带蒂颞肌筋膜瓣。
3.5虽然本组病例均无糖尿病,但考虑到糖尿病多伴有微循环障碍,毛细血管血流不畅[22],同时更易出现电解质紊乱,可能会影响修复所用带蒂组织瓣的存活,建议多加关注。
本研究的目的是基于目前很多临床医师缺乏对本疾病的认知和早期判断病情的能力,对颅底放射性组织坏死的影像分级关注较少,因此,提供便于临床应用,准确度高,经济-效益最大化的分级方法非常有必要[19,23-24]。本研究结果显示,鼻咽癌放疗后颅底组织坏死的CT影像分级对手术治疗颅底组织坏死并修复具有较好的临床指导意义,可以根据病变累及的部位计算病灶的最大直径和面积,以便创面修复组织瓣的选择。同时,对于不同级别中的放疗后颅底放射性组织坏死患者,其手术成功率和并发症发生率、围手术期死亡事件发生有明显差异,结合CT影像分级,还可预测术后预后情况。此外,对于不同分级术后修复存在的问题可更为清晰化,有助于进一步改进手术方式,将对治疗效果的提高,具有积极的作用。
