半导体-酶光催化体系的研究进展*
2023-02-16李冠霖李梅钰李雪辰崔岱宗
李冠霖 李梅钰 李雪辰 崔岱宗*
(东北林业大学生命科学学院,哈尔滨 150006)
半导体在特定波长的光激发条件下产生的光生电子可以为原核生物以及其细胞内氢化酶、固氮酶等酶所利用,促进细菌的合成代谢及各类酶的催化反应[1]。目前,半导体-酶光催化体系的可行性与效率均已经得到广泛的论证,该体系的提出和发展为酶催化反应的大规模应用提出新思路,在化工原料生产、简单有机产品合成、新型清洁能源等领域具有广泛应用前景[2-9]。
本文梳理了近年来“半导体-酶”光催化领域内的部分研究成果,对该杂化体系的构建及功能进行解析,分析了现有研究的局限,并对未来的研究方向提出一些构想。
1 杂化系统的构建
杂化系统主要由提供电子的半导体和催化反应的酶两部分组成。在光激发条件下,半导体内的电子会获能跃迁,产生光电子。光电子通过体系中相应途径传递到酶的活性中心,参与酶催化相应的反应[1]。受到光激发后,半导体在原位形成的氧化空穴可以通过引入外源牺牲剂进行填补。外源牺牲剂起到提供电子、阻止光生电子流的复合、防止光腐蚀的作用。图1展示了该系统的基本组成。表1统计了近10年来国内外部分研究者所构建的“半导体-酶”光驱动杂化系统的构建策略及其相应功能。
1.1 半导体的选择
对半导体光催化性能的开发并不是一个新课题,早在20世纪80年代就已有对于半导体材料光催化性能的研究[18]。而利用半导体纳米材料有效捕获光并将其用于酶促反应则是该领域的最新应用。半导体纳米材料具有足够的光捕获效率,且它们易与各类还原酶配对。同时,半导体材料支持通过导电层进行较轻松的电荷转移,从而最大限度地减少微生物代谢过程中的能量损失[20]。其中,纳米半导体材料以其廉价、吸收光谱宽且连续、电子传递效率高等优点在杂化体系的构成中占据了重要地位[4]。热力学研究表明,半导体光吸收剂的能带位置需连接两个半反应,即析氢反应(HER)和氧化反应(OER)[15],以水分解为例(图2)。且半导体光吸收剂的带隙不应太宽,带隙过宽将导致无法利用可见光(400~800 nm,带隙:1.53~3.10 eV)。部分常用半导体带隙图与部分常见反应氧化还原电势图如图3所示[21-22]。

Fig. 1 Construction strategy of semiconductor-enzyme hybrid system图1 “半导体-酶”杂化体系的构建策略
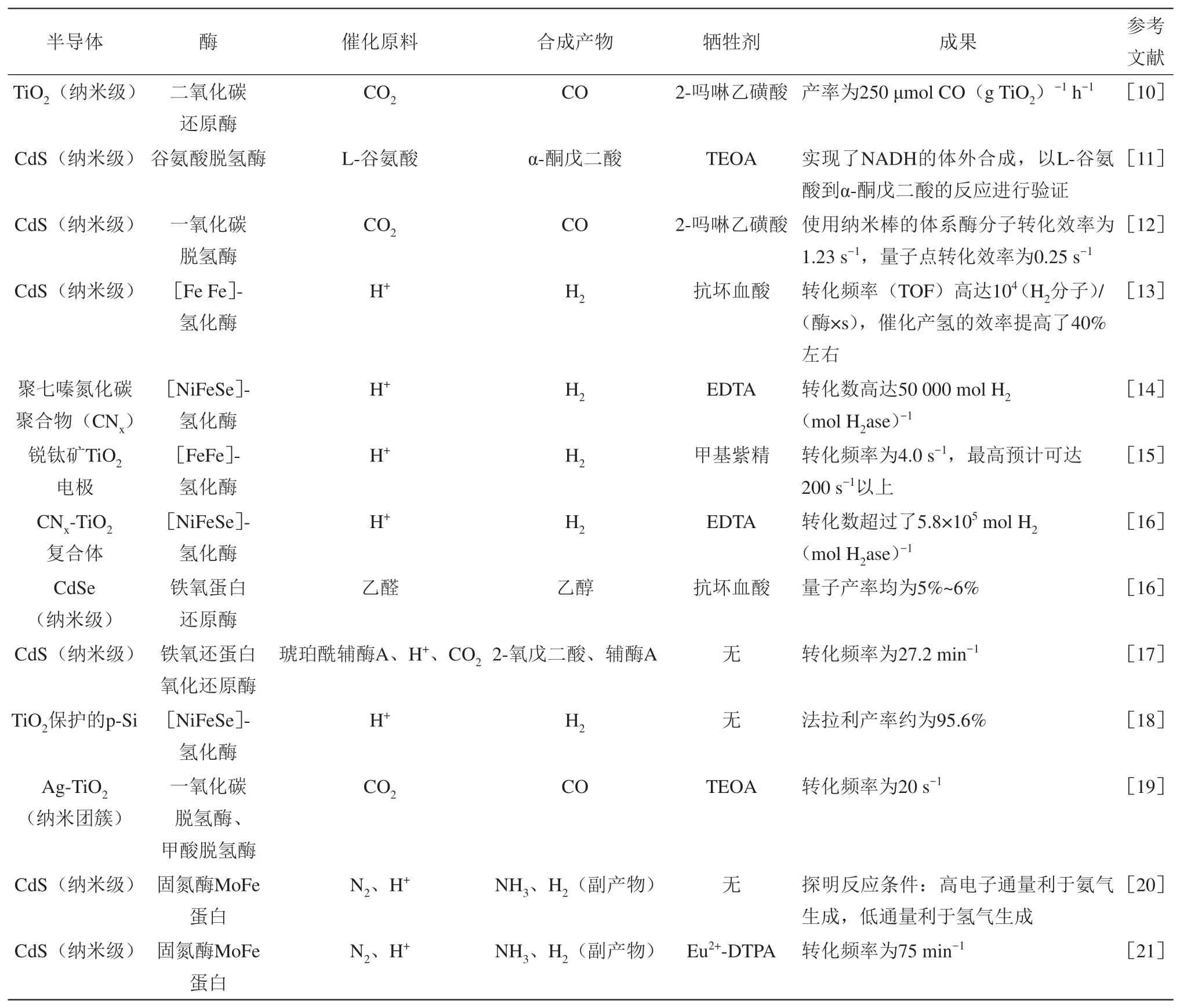
Table 1 Types and functions of semiconductor-enzyme hybrid systems表1 “半导体-酶”杂化系统的种类及功能
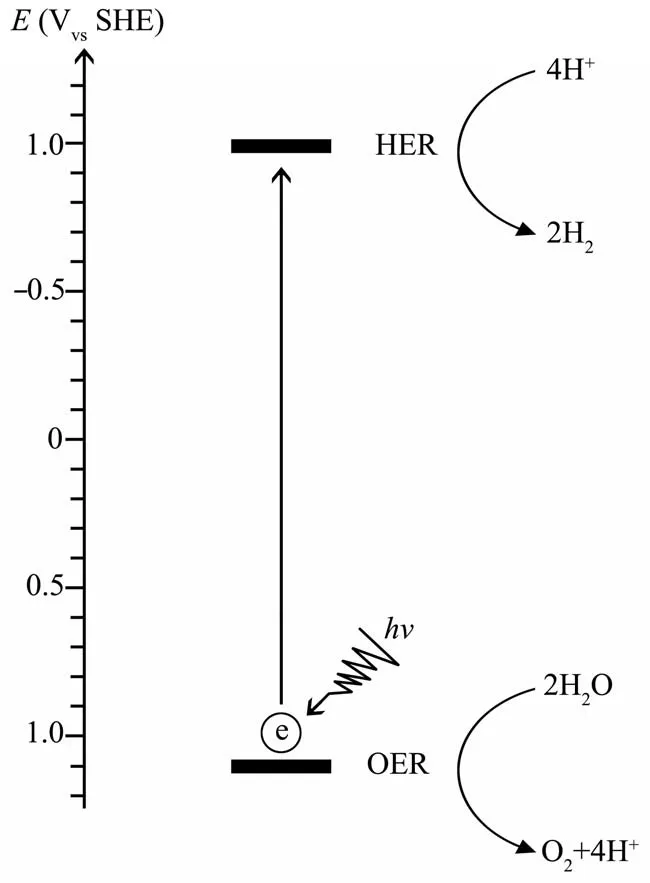
Fig. 2 Energy level diagram of water decomposition at pH 7.0(the illustration was drawn according to Fang et al.[23]’s work)图2 pH 7.0下驱动水分解的能级图(据Fang等[23]的论文仿画)
已有研究表明,杂化系统中半导体部分的电子反应分为3个步骤:光收集、电荷分离和表面反应。电子反应效率则与半导体材料带隙、跃迁模型、内建电场等性质以及半导体的形状、厚薄、结晶度等形态特性相关[4]。应用于杂化系统的半导体一般是半导体纳米粒子。纳米粒子具有较宽且连续的吸收光谱,克服了窄光谱吸收的缺点。且纳米粒子有较为稳定的化学结构,可以反复激发循环,具有抗氧化能力[18]。
研究发现,天然半导体矿物带中一些细菌可以利用矿物经太阳光照产生的光电子支撑自身生长代谢。受此启发,人们建立了早期的“半导体-微生物”杂化系统,开始了以生物方式利用半导体光激发电子的探索[31]。国内外研究者聚焦于半导体矿物金红石、赤铁矿、闪锌矿等与氧化亚铁硫杆菌、铜绿假单胞菌等的协同电子转移作用,对其进行了大量的研究[32]。Liu等[33]研究表明,半导体与细菌的接触面积是影响二者电子传递效率的最直接因素之一。以上结论同样适用于由“半导体-微生物”系统进一步简化发展而来的“半导体-酶”杂化系统。因此,纳米材料有比表面积大、光电特性优良的优点,具有更高的电子传递效率,有效解决了普通半导体材料与酶组成的系统中电子传递效率低的问题而广受研究者的青睐。
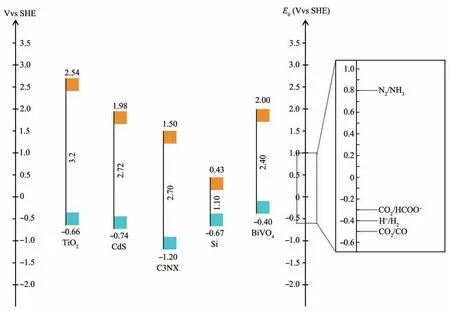
Fig. 3 The comparison of energy level diagrams of some semiconductors and some gibbs free energy diagrams for common REDOX reactions[4,8,17,22,24-30]图3 部分半导体能级图与部分常见氧化还原反应吉布斯自由能比较图[4,8,17,22,24-30]
在杂化系统中,纳米半导体材料一般被制成量子点 (纳米粒子)或纳米棒的形式[8-9,14-15,19-20,34-35]。量子点形式半导体材料尺寸大小对自身的电子结构具有一定的决定作用,这使其光电特性在一定程度上变得可控[36]。因此,量子点形式半导体材料得到了广泛的应用[14]。如Brown等[19]聚焦于将CdS量子点与MoFe蛋白固氮酶相结合,实现了将N2还原为NH3的生物催化反应。而纳米棒在系统中可以起到骨架作用,支撑系统并为酶提供附着位点[35-36],同时,相较于零散的纳米点形式,纳米棒可以更好地进行封装与修饰,这有利于半导体材料本身的稳定性[37],例如Brown等[35]将酶通过配体附着在CdS纳米棒上,再集体封装制成杂化系统用于H2的制取。
为了进一步提高系统的催化效率,部分研究者采用了复合型半导体,其主要目的是将前文所述电子传递的3个步骤分区进行,以进一步提升半导体的电子传递效率[25]。如采用溶胶-凝胶法制备的TiO2-硅藻土光催化剂,使负载在硅藻土载体上的锐钛矿相转变温度显著提高,达到近900℃,光催化活性增强[38]。Caputo等[14]将1∶1的CNx聚合物与TiO2纳米晶在尿素中共加热,制成CNx-TiO2复合半导体量子点(图4)。这种结构实际上构成了一种半导体电池,TiO2与酶核心金属离子的结合、CNx激发和CNx-TiO2电荷转移极大地改善了可见光的吸收效率,从而拓宽了可利用光的范围,提高了光激发电子的效率,在光驱动制氢的系统中拥有良好的应用[34,38-39]。同样以类似方法形成半导体电池的还有Zhang等[34]以纳米Ag颗粒与纳米TiO2颗粒复合成纳米团簇构建的CO2还原系统。采用复合型半导体还可以提高自身的稳定性,这种复合型半导体一般采用包被式结构,由外层材料保护内部,通过增强抗氧化或抗光腐蚀作用达到提高稳定性的效果[15,20,34,38,40-51]。

Fig. 4 A schematic diagram of the composition of a hybrid system(the illustration was drawn according to Caputo et al.[14]’s work)图4 一种杂化系统组成示意图(据Caputo等[14]的论文仿画)
1.2 应用各类酶的杂化系统
众多研究表明,“半导体-酶”杂化体系能够极大提高生物氧化还原酶的催化效率,其生产效率仅受到酶自身催化效率的影响[13]。根据Brown等[35]的研究,在“CdS-氢化酶”体系中,在最适条件下,“半导体-酶”杂化系统可使氢化酶催化产氢效率提高约40%;在Brown等[29]的另一项研究中,杂化体系在光照下产率相较于黑暗条件下提高近50%。
现有研究基本实现了对H2、NH3等简单化合物的制取,如以“CdS-固氮酶”体系生产NH3、以“CdS-氢化酶”体系制氢。还有少量的研究以该类型体系制取了较复杂的有机产物,如Hamby等[15]构建的CdS-海洋磁球菌MC-1铁氧还蛋白氧化还原酶体系,成功制取了2-氧戊二酸。还有研究者将杂化体系与生物的经典代谢途径相结合,用于制取有机产物,如Brown等[16]将CdSe-铁氧蛋白还原酶体系与无氧呼吸部分路径结合,用于制取乙醇。下文介绍几种具有代表性的杂化系统应用实例。
1.2.1 “半导体-固氮酶”杂化系统
氮气的裂解和氨的还原是一个过程复杂且具有挑战性的多步反应。传统化学固氮需要严格的高温高压条件,而通过固氮酶进行生物催化则可以在较为温和的条件下完成该反应[4]。Brown等[29]以CdS纳米晶光敏化固氮酶钼铁(MoFe)蛋白,以光能代替ATP水解的化学能来驱动N2被酶还原为NH3。他们将纳米级CdS与MoFe固氮酶蛋白通过互补嵌合和表面静电力结合起来,同时以4-羟基乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid, HEPES)为牺牲剂提供电子,并加入固氮酶抑制剂(如乙炔、一氧化碳和氢气)抑制氮气还原,形成了高效催化N2还原为NH3的固氮体系。在最佳条件下,该体系的量子产率为75 min-1,是“固氮酶-ATP”偶联反应速率的63%。
1.2.2 “半导体-氢化酶”杂化系统
氢能作为优秀的清洁能源载体,具有单位质量热值高、零碳、无污染等优点,被认为是最具应用前景的清洁能源[51]。传统制氢的方法效率低、产氢品质差。Caputo等[14]开发了一种由[NiFeSe]-氢化酶接合到CNx修饰的TiO2纳米粒子表面的体系。他们以尿素为介质加热TiO2纳米颗粒,并将其与CNx连接,通过构建耦合电子轨道扩展了能够利用的光波长范围,显著改善了太阳能的收集效率,节省了约0.2 V的电子用于反应。最终在以甲基紫精(MV2+)为电子牺牲剂的上述杂化体系将量子产率提高至35 s-1,72 h内,每摩尔氢化酶转化量可达3.8×106mol H2。
1.2.3 “半导体-CO2还原酶CO脱氢酶”杂化系统
随着全球气候变暖,如何处理大气中大量以CO2为代表的温室气体成为了全世界面临的挑战[52]。而以CO2为原料制取高价值化学品则对这一挑战提供了一种行之有效的解决方案。Woolerton等[8]通过TiO2-一氧化碳脱氢酶杂化系统构建了高效将CO2还原为CO的途径。他们在厌氧条件下将钌光敏剂改性的TiO2纳米颗粒和酶置于水体系中,并缓缓搅拌使二者互相吸附,最后添加缓冲液和吸附染料并密封整个体系,成功实现了在可见光下使CO2转化为更高价值化学品的反应,为温室气体处理提供了新思路。“半导体-酶”杂化系统不仅在碳中和方面有良好的应用,更为合成较为复杂的有机物提供了可能。Hamby等[15]开发了一种胶体CdS纳米棒与2-氧戊二酸∶海洋磁球菌MC-1铁氧还蛋白氧化还原酶杂化的体系,成功地以琥珀酰辅酶A和CO2为原料合成了2-氧戊二酸。他们使用3-巯基丙酸酯(MPA)配体包覆CdS纳米管,使其带上负电与2-氧酸氧化还原酶产生吸附作用,并整体封装形成完整体系。在405 nm激光照射下,该体系的量子产率约为1%。该研究不仅为有机产物的工业合成提出更加绿色的新途径,也展示了碳中和的新思路,同时对生物体新的能量代谢途径的发现和构建有启发意义。
1.3 牺牲剂
牺牲电子供体用于猝灭半导体因光激发而产生的光生空穴。当光电子被激发离开半导体时,会在原位留下带着正电的“空穴”。空穴有着极高的氧化活性,既会导致酶被氧化而失活,又会缩短半导体材料的使用寿命。而电子牺牲剂则可以提供电子填补空穴以维持系统的稳定,防止光腐蚀,同时阻止光电子流复合。电子牺牲剂一般是易被氧化的还原性物质,具有较为容易解离的电子。然而,光催化制氢反应对牺牲剂的能带位置和抗光腐蚀能力有着非常严格的要求,这极大限制了牺牲剂的种类。在早期的系统中,有研究者曾使用Na2S、Na2SO3、H2S作为光催化制氢反应的牺牲剂。然而这些物质具有较强的毒性,无法运用于“半导体-酶”体系这种杂化系统。而有机牺牲剂结构多样、种类繁多,其中有相当一部分具有优秀的生物学适应性,因此,在“半导体-酶”杂化体系中,研究者常用抗坏血酸、半胱氨酸、甲酸、三乙醇胺等有机电子牺牲剂[53]。其中,抗坏血酸是优秀的天然抗氧化剂,可以在中性、酸性条件下使用,具有十分优良的性能;半胱氨酸作为一种天然氨基酸,在自然环境中广泛存在,大大降低了“半导体-酶”杂化系统在自然环境中的应用难度;甲酸价格低廉,在酸性环境中也具有非常良好的性能,为“半导体-酶”杂化体系的大规模应用提供了条件;三乙醇胺则在碱性环境下表现良好。表2对这几种常用的牺牲剂做了比较。

Table 2 Comparison of solubility,redox potential,pH and toxicity of common sacrificial agents表2 常用牺牲剂的溶解性、氧化还原电位、pH、毒性对比
2 杂化体系的作用机理与电子传递途径
2.1 直接途径(无介体途径)
“半导体-酶”生物催化体系的功能本质上是通过电子的传递促使反应的发生,因此解析其电子传递路径十分必要。在无介质的情况下,最初的光激发电子由半导体产生,激发出的光电子转移到酶的活性中心,用于催化底物还原;而半导体上由于电子转移而留下了带有高氧化活性、带正电的空穴。半导体空穴氧化电子牺牲剂获得电子从而被填补,随后再次被光激发,进入下一个循环[10,15]。在光电子离开半导体到达酶活性中心的过程中,会有大量电子猝灭而得不到有效利用。为避免电子浪费,研究者采用了多种方式使酶与半导体紧密结合以缩短电子传递途径,例如利用配体连接酶与半导体[40],对“酶-半导体”界面在拓扑和表面化学等方面进行合理设计,或提高酶的电活性,使电子更高效快速的进入酶的活性中心参与反应[23,53]。
2.2 间接途径(有介体途径)
有介质的构建方式常见于人工光合体系等通过改造生物经典代谢途径合成较复杂化学产物的体系中,如Wilker等[11]构建的生产α-酮戊二酸的体系、Brown等[16]构建的还原乙醛生产乙醇的体系等。而现有研究中所使用的介体多为NAD+/NADH、NADP+/NADPH等辅酶以及多种高活性催化剂如镍、银等金属[54]。这些物质一般较容易结合和解离电子,是良好的电子传递载体。在这类体系中,半导体的光激发电子先结合到介体上,形成还原态介体。而后电子从介体转移到酶的活性中心进行反应,而介体转为氧化态进入下一个循环。直接途径相较间接途径增加了电子通过半导体-介质-酶的传递过程[55-56]。
3 局限与不足
3.1 半导体材料对酶的毒性
光驱动杂化系统虽然有着光明的前景,但仍有着许多局限性。现有研究表明,传统的半导体材料具有一定的毒性,这会对酶的活性和反应的正常进行产生危害。其毒性主要来源于3方面:a. 半导体材料中含有重金属离子,具有重金属毒性,会导致酶逐渐变性失活[57];b. 纳米级材料使半导体本身更加活跃,更易于发生反应,以CdS为例,研究发现镉纳米粒子的毒性可能来自自身的理化性质,由于其具有较高的比表面积,在生物系统中具有了更高的毒性[58-59];c. 半导体材料在光激发条件下还会产生具有强氧化性的空穴,产生大量活性氧(ROS)[60],这同样会导致酶的变性失活,这种毒性与其本身的光吸收强度及光生载流子产生效率呈正相关[60-61]。尽管杂化系统中有牺牲剂的存在,但氧化空穴的氧化压力仍然不可避免地会对酶产生慢性损伤[62]。因此,在较短时间内,杂化系统极大提高了酶的催化效率,但在长时间尺度内,酶也会因为长期面对较高的氧化压力而导致活性下降、半衰期缩短,最终失活。此种情况下,在酶的一生中杂化系统最终对酶的催化功能是否真正的起到了促进作用?“半导体-酶”杂化体系的应用成本是否会因此产生无法预料的大幅增长?这些问题仍然需要进一步的研究探索。
3.2 系统对光能利用效率
半导体-酶杂化系统对光能的利用率低,是目前制约该领域发展的另一掣肘。以制氢为例,从技术经济角度来看,杂化系统的光能转化效率需要达到5%~10%方能产生一定的市场竞争力,达到25%才能与传统化石燃料相媲美[63-64]。基于粒子系统的最高光能利用效率约为1%[65],而基于电极的系统通常可以达到10%左右[54]。其中,光电子在从半导体到酶活性中心的传递过程中,损失率一般高达80%以上[11,66]。因此需要设法提高系统的光利用率,进一步压缩杂化系统的成本。
4 总结与展望
生物催化是一项被广泛应用于化工和制药行业的绿色技术。文中所述的许多成功研究表明,生物催化提高了化学反应过程的可持续性。通过利用光能来驱动化学转化,将氧化还原生物催化和光催化相结合,实现更绿色环保的化学反应。因此,在过去的几年里,利用光作为酶催化反应驱动力的概念提出就不足为奇了。“半导体-酶”杂化系统可显著提升酶的催化效率。随着更多光酶的发现、如表1中所述的光酶及其牺牲剂,以及新型半导体的应用与在杂化系统的装配,“半导体-酶”杂化系统必将会突显出自身的巨大优势。目前,不仅有利用此系统进行重要化学物质的合成,更有许多基于“光-酶”系统所开发出的各类新型实验成果。例如,已有通过“光-酶”系统来开发癌症治疗方案、绿色化学、节能减污等方面的应用[67];根据研究,光酶催化研究在仿生叶绿体等拥有光酶系统的仿生细胞器中有着巨大的前景[68-69]。这也指明了新的研究方向——能否将半导体-光酶杂化系统引入这些单纯只有“光-酶”偶联的系统,从而使其可以完成更复杂的反应链,达到更高标准的目标?当然,除了光酶以外,不断出现的新型半导体亦值得发掘深究其与光酶和牺牲剂的联系。未来将继续致力于研究这类杂化高效光生物反应器以及其装配方法的改良,有望获得更深层次的成果[70]。