Box-Benhnken响应曲面法优化大花紫薇中科罗索酸的提取工艺
2023-02-16林艾和朱培芳夏宗霄龙小妹
林艾和 朱培芳 李 蓉 夏宗霄 龙小妹 郭 爽 范 源,2*
1.云南中医药大学,云南 昆明 650500;2.云南中医药大学第二附属医院,云南 昆明 650216
大花紫薇(LagerstroemiaspeciousL.),又名大叶紫薇(Lagerstroemiaflos-reginaeRetz),是千屈菜科(Lythraceae)紫薇属(Lagerstroemia)的落叶乔木[1]。其原产于亚洲热带,分布于斯里兰卡、印度、马来西亚、菲律宾等地区[2],在我国广东、广西地区有较丰富的资源。
上世纪90年代起,日本、美国以及菲律宾学者开始系统研究大花紫薇化学成分及功能[3],其广泛用于治疗糖尿病及肾病[4],在多个国家已经被开发为茶饮料,广泛用于治疗和预防糖尿病,被誉为“天然植物胰岛素”[5],此外,其还具有减脂、抗氧化、抗菌和抗肿瘤等作用[6]。近年来,随着对大花紫薇的研究深入,发现其降血糖的活性成分主要是鞣质类[5,7-8]和三萜类成分[9-10],其中三萜类主要活性成为科罗索酸[11],其具有胰岛素样作用且可抑制α-淀粉酶和α-糖苷酶活性[12-14]。
科罗索酸(corosolic acid,CA),又名 2α-羟基熊果酸[15],具有降血糖、改善糖尿病性肾损伤、抗肿瘤、抗炎、降血压、抗菌等药理作用[16-19]。其主要存在于大花紫薇、枇杷、北五味子等植物中[20],现关于在大花紫薇中提取CA相关报道较少,本实验研究建立大花紫薇中CA HPLC 定量分析方法,同时采用响应曲面法优化其提取工艺,为在大花紫薇中提取CA的工艺研究和对大花紫薇的后续开发利用提供科学依据。
1 仪器与试药
1.1 仪器 YL-040S 语路超声波清洗机,深圳市即洁超声科技有限公司;Agilent 1200 高效液相色谱仪,DAD检测器,AcclaimC30色谱柱(2.1 mm×150 mm,3 μm),美国 Agilent 公司;DFY-600 摇摆式高速万能粉碎机,永康式速锋工贸有限公司;D2KW-D 电热恒温水浴锅,上海量壹科学仪器有限公司;T-1000 型电子天平,上海浦春计量仪器有限公司;AB265-S 十万分之一分析天平,Mettler-Tolido International Trade(Shanghai)Co.LTD;旋转蒸发仪,上海爱朗仪器有限公司。
试剂:科罗索酸(CA 批号:wkq20042404,纯度≥98%,四川省维克奇生物科技有限公司)。甲醇、乙腈为色谱纯,其余试剂为分析纯。
药材:大花紫薇LagerstroemiaspeciousL.(批号:P20200819,安国市旭芳中药材经营有限公司)经云南中医药大学李国栋副教授鉴定为千屈菜科Lythraceae紫薇属Lagerstroemia植物大花紫薇的干燥全草。
2 方法与结果
2.1 样品测定方法
2.1.1 色谱条件 色谱柱:AcclaimC30色谱柱(2.1 mm×150 mm,3 μm);流动相:甲醇(B)-乙腈(C)-0.1%磷酸水溶液(D);梯度洗脱:0 ~10 min 75% B,12.5% C,12.5% D;10~20 min 70% B,15% C,15% D;流速:0.1 mL/min;检测波长:210 nm;柱温:20 ℃;进样量:10 μL。理论塔板数按科罗索酸计算应不低于 5000,分离度大于1.5。色谱图如图1所示。

A
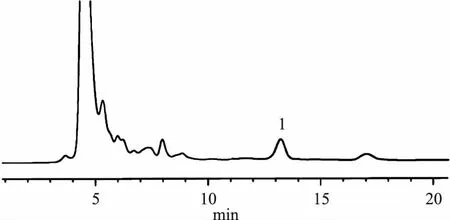
BA.对照品溶液;B.供试品溶液;1.科罗索酸图1 高效液相色谱图
2.1.2 混合对照品溶液制备 分别精密称取CA对照品2.40 mg,置 10 mL 量瓶中,用甲醇配制成CA浓度分别为0.240 mg/mL 的混合对照品溶液,低温避光保存。
2.1.3 供试品溶液制备 取干燥的大花紫薇,粉碎,过 40 目筛,精密称定约 2.0 g,置于圆底烧瓶中,加热回流,提取温度90℃,设置不同料液比、加热回流时间、回流次数及乙醇体积分数,合并提取液,过滤。滤液于 60 ℃减压回收溶剂至干,残渣加甲醇溶解后移至 10 mL 量瓶中,加甲醇稀释至刻度,摇匀,用 0.45 μm 微孔滤膜过滤,取续滤液,即得。
2.1.4 线性关系考察 取“2.1.2”项下混合对照品溶液,0.45 μm 微孔滤膜膜过滤,依次精密吸取2 μL、4 μL、6 μL、8 μL、10 μL、12 μL, 按“2.1.1”项下色谱条件进样,记录色谱图。以对照品进样量(μg)为横坐标,峰面积为纵坐标,进行线性回归。 CA的回归方程为y=604.24x+1.1333(R2=0.9999),线性范围为 0.480~2.880 μg。
2.1.5 精密度考察 精密吸取同一混合对照品溶液 10 μL,按“2.1.1”项下色谱条件连续进样 6 次,结果CA的峰面积RSD 为1.13% ,表明仪器精密度良好。
2.1.6 稳定性试验 按“2.1.3”项下方法制备供试品溶液,于室温放置 0 h、2 h、4 h、6 h、8 h、10 h,按“2.1.1”项下色谱条件,以峰面积为指标进样分析,结果CA面积 RSD 为1.44%,表明供试品溶液在10 h 内稳定。
2.1.7 重复性试验 取同一批样品 6 份,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样分析,结果显示CA平均含量为2.3246 mg/g, RSD 为 1.28%,表明该方法重复性良好。
2.1.8 加样回收率试验 精密称取已知含量的同一批样品(每 1.0 g 大花紫薇含CA 2.3246mg)粉末 6份,每份精密称取 1.0 g,按“2.1.3”项下方法制备供试品溶液,加入CA对照品适量(约相当于 1.0 g 样品中所含CA的量),再按“2.1.1”项下色谱条件进样测定,计算平均回收率。结果见表 1。
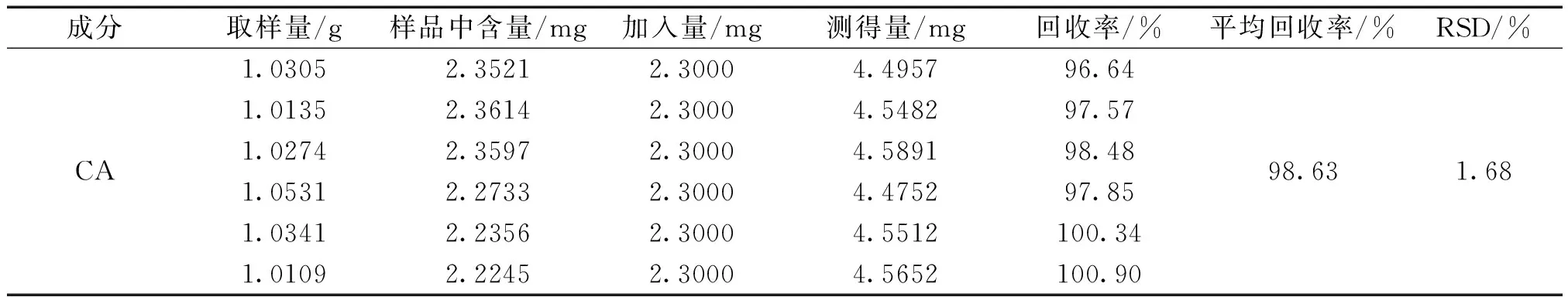
表1 大花紫薇中CA加样回收率试验表
2.2 单因素实验 采用加热回流法提取大花紫薇中的科罗索酸,将料液比、加热回流时间、回流次数及乙醇体积分数作为影响因素,固定其中3个因素,以提取率为评价指标,对另一个因素进行单一因素实验。固定提取时间为60 min,提取次数为1次,料液比为1∶10 g/mL,考察乙醇体积分数(75%、80%、85%、95%、100%)对提取率的影响,优选最佳乙醇体积分数,按所优选条件依次向下考察料液比(1∶10 g/mL、1∶15g/mL、1∶20 g/mL、1∶25 g/mL),提取时间(40 min、60 min、80 min、100 min、120 min),提取次数(1次、2次、3次)对醇提的影响。
结果图2表明,CA含量随乙醇体积分数升高而增加,由于CA是脂溶性物质,不溶于水,随着乙醇体积分数的增加其含量增加,当乙醇体积分数为95%和100%时,CA含量相差不明显,考虑实验成本,故选择乙醇体积分数为 95%[21];CA含量随料液比从1∶10 g/mL到1∶25 g/mL先增加后减少,可能因为为溶剂体积过小,CA无法彻底溶解,但溶剂体积过大,更易溶出其他的杂质达到饱和[22],继续增大料液比不会增加溶出率,故选择料液比 1∶20 g/mL;CA含量随提取时间从40~120 min先增加后减少,CA溶出率一定时间内随着提取时间增加增加,但提取时间过长,料液长时间处于受热状态,更容易造成CA损失,固选择提取时间60 min[23];CA含量在提取次数2次时最大,故选择提取次数两次。最佳条件为乙醇体积分数95%,料液比1∶20 g/mL,提取时间60 min,提取次数2次。

图2 醇提单因素试验结果图
活性物质含量(mg/g)计算公式:
含量=M供×C标/M对
式中M供为供试品峰面积;
C标为标准品的浓度(mg/mL)
M对为标准品峰面积
2.3 Box-Behnken响应面法优化醇提工艺
2.3.1 响应曲面试验设计及结果 依据Box-Behnken响应面试验设计原理,结合上述醇提单因素试验结果,进行因素水平设计与试验。因素水平见表2,结果见表3。
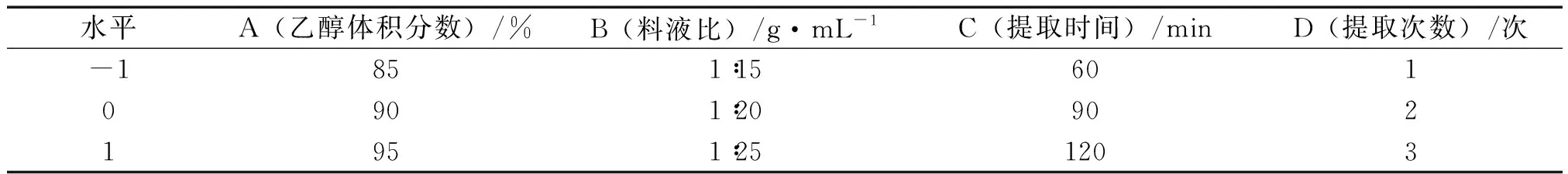
表2 醇提因素水平表

表3 醇提Box-Behnken设计与结果表

表3(续)
2.3.2 醇提模型拟合及方差分析 采用Design-expert 8.0.6软件对表2中的试验结果进行分析,得到回归方程为
Y=-51.15554+0.94402A+0.40383B+0.13185C+0.72244D-6.7×10-4AB-1.17133×10-3AC+4×10-3AD-3.17333×10-4BC-0.0197BD+2.25917×10-4CD-4.58348×10-3A2-6.60648×10-3B2-1.2384×10-4C2-0.15528D2R2=0.9158。由表3可知,模型F=10.87(P<0.0001),表明回归模型极显著,失拟项F=2.03,P=0.2584>0.05,表明模型失拟项不显著,可用于分析试验数据。以Y为响应值时,模型的一次项影响顺序是D>B>C>A,和二次项B2、D2有极显著影响(P<0.001),一次项D和二次项A2、C2有高度显著影响(P<0.01),一次项B、C有显著影响(P<0.05)表明所得回归方程能较好地预测Y随各影响因子的变化。见表4。
2.3.3 醇提响应面优化及预测 经Design-expert 8.0.6软件分析得响应面图(如图3所示),由图可见提取次数对Y值影响较大,交互项对Y值无显著影响,忽略交互作用,以Y值的回归模型的极值分析得到最优提取条件为:乙醇体积分数94.77%,提取时间60 min,提取次数2.27次,料液比1∶20.93 g/mL,Y预测值为2.5783 μg/g,综合实际情况考虑,调整最优提取条件为乙醇体积分数95%,提取时间60 min,提取次数2次,料液比1∶20 g/mL。如图3所示。

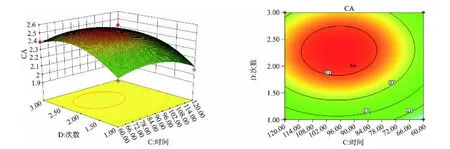
图3 4种因素对Y的响应面图
2.4 醇提优化工艺验证试验 平行称取大花紫薇3份,每份2.0 g,按所优化条件进行验证试验。结果显示Y平均值为2.5613 mg/g(RSD=1.33%,n=3),与预测值2.5783 mg/g相比较,相对误差为1.20%,说明该模型预测性拟合度良好,所得数据有效可靠。见表5。

表5 验证试验 (n=3)
3 讨论
3.1 色谱条件 本实验经反复试验,调整甲醇-乙腈-0.1%磷酸水溶液三者的比例,最终选用流动相甲醇(B)-乙腈(C)-0.1%磷酸水溶液(D),梯度洗脱,分离度>1.5,达到了检测要求。大花紫薇中科罗索酸的加热回流提取最佳提取工艺为:乙醇体积分数95%,提取时间60 min,提取次数2次,料液比1∶20 g/mL。实验结果表明,最佳提取方法所得科罗索酸含量为2.5613 mg/g,拟合的模型能较为准确地预测总含量,同时也说明响应面分析法精确度高、模型预测性好。
3.2 结果分析 本试验以科罗索酸为指标成分,用Box-Benhnken响应曲面法优化大花紫薇中CA的提取工艺,经工艺验证实验证明,该提取工艺操作简单,CA的提取率高,节省溶剂且稳定性好,是应用前景较好的提取方法之一,可为后续CA的应用提供参考。
3.2 展望 科罗索酸具有显著的降血糖作用,且对身体毒副作用较小,是一种较为理想的降糖化合物,数据表明大花紫薇是一种科罗索酸的含量较高的天然药用植物,寻找在其中有效提取CA的方法是很有必要的,后续的研究可以在此文章的基础上,从药效、作用机制的角度来探讨中药资源的合理开发。
