Ⅰ型神经纤维瘤合并胃癌、乙状结肠癌和胃肠间质瘤1例报道
2023-02-14王舟陈康汪文杰李金洲陈晓
王舟,陈康,汪文杰,李金洲,陈晓
0 引言
神经纤维瘤病(neurofibromatosis,NF)是一种常染色体显性遗传病。Ⅰ型神经纤维瘤(NFⅠ)是NF中最常见的一种,NFⅠ主要影响中枢和外周神经系统,皮肤、心血管、胃肠道和骨骼等系统也常受累,此外NFⅠ也可合并腹腔肿瘤。兰州大学第二医院收治了1例NFⅠ型合并胃癌、乙状结肠癌、胃肠间质瘤(gastrointestinal stromal tumor,GIST)患者,现报告如下。
1 病例资料
患者男,65岁,因“确诊胃恶性肿瘤2月余”于2022年2月23日就诊于兰州大学第二医院普外科。患者2个月前因间断便血,就诊于武威市凉州医院,行相关检查示:胃恶性肿瘤、乙状结肠恶性肿瘤、结肠息肉。无明显腹痛、腹胀、恶心、呕吐、反酸、嗳气、纳差等不适,无脊柱侧弯。近1年体重减轻约10.0 kg。既往病史:50年前全身皮肤逐渐出现浅褐色斑块,皮下多发大小不等的结节,分布于头面部、躯干及四肢,不伴疼痛、破溃,未行相关治疗。2021年12月于武威市凉州医院确诊为乙状结肠恶性肿瘤,后于2022年2月16日在武威市人民医院行乙状结肠内窥镜下黏膜切除术(endoscopic mucosal resection,EMR),术后恢复可。无肿瘤家族史及遗传病史。
2022年2月23日兰州大学第二医院体格检查:胸腹及腋下可见广泛分布的咖啡斑,最大直径2.5 cm,头面部、躯干和四肢皮肤可见多发大小不等结节状肿物,其中腹部结节最大可达2.0 cm×2.0 cm,质软,无触痛、渗液或流脓。腹壁柔软,无压痛,无反跳痛。叩诊呈鼓音,肠鸣音正常。
术前检查:外院电子结肠镜检查示:(1)结肠多发息肉;(2)乙状结肠隆起病变,见图1。行EMR术。病理诊断:(1)结肠息肉病理诊断结果为黏膜高级别上皮内瘤变;(2)乙状结肠隆起病变病理诊断结果为中分化腺癌,见图2A。胸腹部增强CT示:贲门部胃壁不均匀增厚,未见明显增大淋巴结影;直肠见多发结节状致密影;胸腹壁及腰背皮下见多发结节影,边界清晰。CT诊断:(1)贲门部胃壁不均匀增厚,多考虑为胃癌,分期为T3N0MX;(2)直肠见多发结节状致密影,结合病史考虑术后改变;(3)胸腹壁及腰背部皮下多发结节。胃十二指肠超声造影示:胃贲门胃壁弥漫性、不均匀增厚,最厚处约0.7 cm,累及贲门一周,其层次紊乱不清,浆膜层连续性尚可,病灶表面可见多处黏膜破溃,最大处约0.5 cm×0.4 cm,其内可见点灶状强回声附着,该处胃壁僵硬,蠕动消失。诊断:多考虑为贲门癌。胃镜检查示:贲门可见黏膜粗糙,略凹陷,覆少量白苔,可见黏膜纠集。活检结果:贲门黏膜病变;慢性萎缩性胃炎(C3)。病理检查结果:镜下:腺体异型增生,排列紊乱,呈乳头样、不典型腺样。病理诊断:(贲门)高级别上皮内瘤变,部分区域癌变为高分化腺癌,见图2B。免疫组织化学染色:异型细胞示CK8/18(+)、CKp(+)、CD20(-)、Syn(-)、CD56(-)、CgA(-)、C-erbB-2(1+)、Ki67阳性细胞数40%。皮肤及皮下结节镜下病理检查结果示:肿瘤由束状或编织状排列的梭形细胞组成,细胞边界不清,胞浆嗜酸,核深染、扭曲,部分区域见绳索样胶原纤维。病理诊断:(皮下)NF,见图2C。免疫组织化学染色:瘤细胞示S-100(+)、CKp(-)、CD34(+)、SMA(-)、CD68(-)、SOX-10(+)、Ki67阳性细胞数1%。
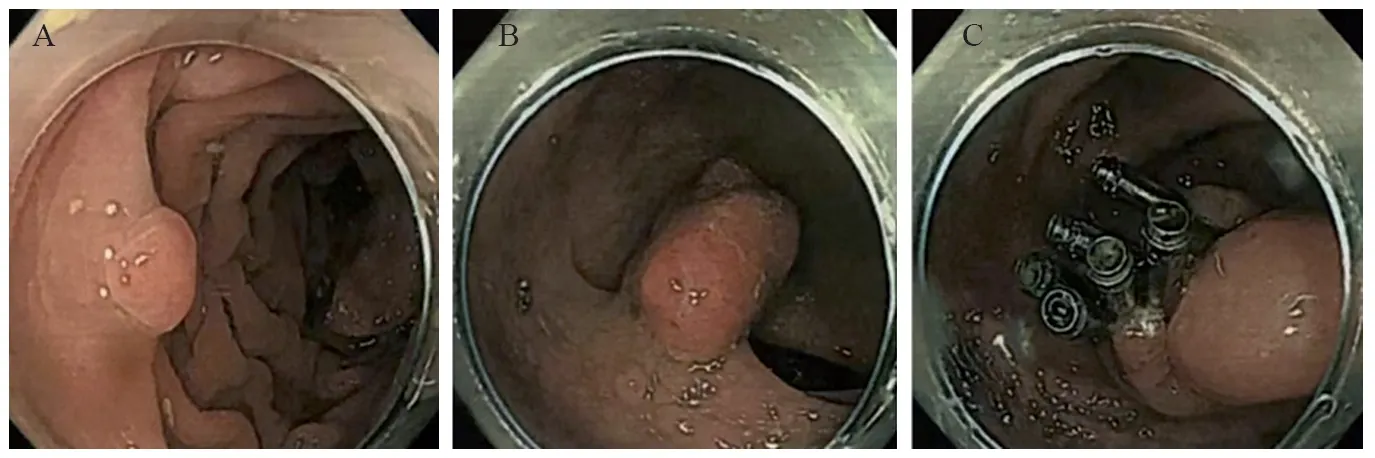
图1 NFⅠ患者电子结肠镜下结肠多发息肉和乙状结肠病变内窥镜下黏膜切除术Figure 1 Endoscopic mucosal resection for multiple polyps and sigmoid colon protuberant lesions in NFⅠ patients under electronic colonoscopy

图2 NFⅠ患者电子结肠镜、胃镜及皮下活检的病理学结果 (HE ×40)Figure 2 Pathological results of electronic colonoscopy,gastroscopy,and subcutaneous biopsy in NFⅠ patients (HE ×40)
手术治疗:患者完善术前检查,经全科讨论无明显禁忌证后行腹腔镜下探查,见少量腹水,未见肿瘤转移结节,肿瘤位于贲门,约4 cm×3 cm,未侵犯浆膜层,胃小弯侧可见多发肿大淋巴结,遂行根治性近端胃切除术+D2淋巴结清扫术。术中出血约100 ml,切除标本送病理检查。
术后病理检查结果:大体标本肉眼所见:近端胃,小弯长5 cm,大弯长8 cm,上切缘周径3 cm,下切缘周径9 cm,距上切缘0.8 cm、下切缘3.0 cm于贲门近小弯侧可见一个1.6 cm×1.5 cm×0.8 cm的凹陷型肿物,切面灰白质中,附带大、小弯网膜等组织,10 cm×6 cm×1 cm。病理诊断:(1)胃食管结合部凹陷型高-中分化腺癌,Lauren分型:肠型,肿瘤大小1.6 cm×1.5 cm×0.8 cm,肿瘤侵犯固有肌层,脉管和神经受累,见图3;(2)微小GIST,肿瘤直径0.4 cm,复发危险度:极低危,核分裂相<5/50 HPF;(3)上、下切缘未见癌及GIST侵犯;(4)淋巴结(0/22)未见癌及肿瘤转移(小弯网膜淋巴结(0/17)、大弯网膜淋巴结(0/4)、1组淋巴结(0/1))。

图3 NF1患者胃癌根治术后病理学检查示高-中分化腺癌侵犯脉管 (HE ×40)Figure 3 Pathological examination of patients with NF1 after radical gastrectomy showed well-moderately differentiated adenocarcinoma and vascular invasion (HE ×40)
免疫组织化学染色:癌细胞示CK8/18(+)、HER2(0)、p53(+)、SALL4(-)、Glypican3(-)、AFP(-)、Syn(-)、CgA(-)、Ki67(40%+)、MLH-1(+)、PMS-2(+)、MSH-2(+)、MSH-6(+)、EBER阴性。瘤细胞示:CD117(+)、Dog-1(+)、CD34(+)、Vimentin灶(+)、S-100(-)、SMA(-)、Desmin散在(+)、bcl-2(-)、CKp(-)、STAT6(-)、TLE1(-)、Ki67<3%+。
2 讨论
NF是一组三种异质性疾病,包括NFⅠ、Ⅱ型神经纤维瘤和神经鞘瘤病。NFⅠ是这三种疾病中最常见的一种,NFⅠ为常染色体显性遗传性疾病,发病率约为1/3 500,其中约有一半患者具有家族遗传史[1]。NFⅠ由位于染色体17q11.2上的NFⅠ基因突变引起。NFⅠ基因是整个人类基因组中自发突变率最高的基因之一,导致NFⅠ表型的突变类型包括基因缺失、插入、停止和剪接突变,除此之外还包括氨基酸取代和染色体重排[2]。NFⅠ基因的作用是编码一种具有肿瘤抑制作用的神经纤维蛋白。它的缺失会降低RasGTP酶活性,增加活性GTP结合的Ras和Ras/MAPK通路的信号转导[3],导致NFⅠ患者更易发生各种良性及恶性肿瘤,如NF、视神经胶质瘤、恶性外周神经鞘瘤、胶质母细胞瘤、GIST、生长抑素瘤、嗜铬细胞瘤、横纹肌肉瘤及乳腺癌等[4]。也有研究发现,NFⅠ基因是错配修复基因(MMR)缺陷细胞的重要突变靶点,可能与癌症发生、发展过程有关[5],而在结直肠癌、胃癌中MMR常常作为预后良好的指标。因此,早期筛查对于提高NFⅠ合并胃肠道肿瘤患者的生存率是必要的。目前没有正式的NFⅠ患者胃肠道癌筛查指南,因此需要更多的临床研究来确定开始筛查的年龄[6]。
NFⅠ的诊断标准[7]:(1)皮肤有6个或以上牛奶咖啡斑,在青春期前最大直径>5 mm,青春期后最大直径>15 mm;(2)两个及以上任一类型NF或一个丛状NF;(3)腋窝或腹股沟雀斑;(4)视神经胶质瘤;(5)两个或以上Lisch结节(虹膜粟粒状、棕黄色小结节);(6)明显特征性骨损害;(7)一级亲属中有确诊的NFⅠ患者;凡符合上述两条或以上者可诊断该病。本例患者皮肤散在牛奶咖啡样斑、多发NF,满足NFⅠ诊断标准,且入院后检查皮肤及皮下结节病检结果示神经纤维瘤,NFⅠ诊断明确。然而,患者其父母子女和兄弟姐妹没有表现出NFⅠ的证据,但其一表亲具有牛奶咖啡斑,多考虑NFⅠ,因患者家庭经济因素未行基因检测,所以不能确诊是什么突变导致的NFⅠ。
NFⅠ主要影响中枢和外周神经系统,但皮肤、心血管、胃肠道和骨骼等系统也常受累[8]。5%~25%的NFⅠ患者会出现腹腔内(胃肠道或腹膜后)肿瘤,GIST、胰腺和十二指肠神经内分泌肿瘤是NF患者最常见的肿瘤,其中约23%的NFⅠ患者会发展成腺癌[9-11]。NFⅠ合并胃肠道腺癌在食管、胃、十二指肠、小肠、结肠、胆囊、胆道和胰腺等部位都有报道。然而,在NFⅠ患者中观察到GIST、胃腺癌和结肠腺癌同时存在的情况很少见[10,12-16]。该患者最早因便血就诊,于当地医院确诊乙状结肠恶性肿瘤后行EMR术,就诊期间行胃镜确诊胃恶性肿瘤,来我院进一步诊治。患者为65岁男性,入院后查肺最大自主通气量(MVV)为65.7%,提示肺功能减退。为保证手术耐受性及术后恢复,入院后给予肺功能锻炼,术前复查肺功能MVV为80.4%,术前准备完善后行近端胃癌根治术,术程顺利。术后病理证实高-中分化腺癌,同时发现微小GIST,患者术后恢复可。因NFⅠ疾病本身可有消化系统受累的临床表现,10%~25%的NFⅠ患者会出现消化道出血、穿孔等症状[17]。因此,当NFⅠ患者合并胃肠道肿瘤,且出现不明原因黑便、体重减轻、贫血等临床表现时,应尽早完善全腹增强CT、胃镜、结肠镜等检查。对于如何鉴别消化道肿瘤是原发肿瘤还是NFⅠ所引起,最终确诊仍需手术获取病理组织,进行免疫组织化学检测,再进一步行基因检测来确诊[16]。
目前,NFⅠ尚无根治手段。GIST是与NFⅠ相关的胃肠道肿瘤中最常见的,其病变主要位于胃和空肠,常见的临床表现为梗阻、出血、肠套叠、肠扭转或穿孔[18]。手术是GIST患者最主要的治疗手段,大约60%的局限性GIST患者可通过手术治愈,成人一般不行淋巴结清扫术[19]。KIT的激活突变是散发性GIST最常见的原因,但相关研究发现NF1相关的GIST中没有KIT突变。NFⅠ相关GIST与散发性GIST相比,KIT的表达水平相似,但KIT磷酸化水平较低。因此,酪氨酸酶抑制剂伊马替尼对NFⅠ相关GIST的治疗效果可能不如散发性GIST,而另一种酪氨酸激酶受体抑制剂舒尼替尼对NFⅠ相关GIST的转移有一定疗效[4,20]。对于NFⅠ合并胃肠道恶性肿瘤的患者,手术治疗仍是首要的治疗方式,但术前须充分评估肿瘤本身以及全身情况,决定是否需要术前新辅助放化疗。由于NFⅠ合并胃肠道恶性肿瘤的病例报道较少[10,21],因此尚无相关的指南,未来需进一步积累治疗经验。
综上所述,NFⅠ合并胃恶性肿瘤、结肠恶性肿瘤和GIST十分罕见,该例患者已在外院行乙状结肠EMR术,此次于我院行胃癌根治术,手术治疗效果较为满意,术后还需要定期行化疗,对于患者的预后还需要定期进行随访观察。
