RBM8A基因对子宫内膜癌HEC-1A细胞增殖、迁移和凋亡的作用及其机制
2023-02-14谭冬梅张静静师一民韩赛耿炜孙建一王雅玉张秀荣
谭冬梅,张静静,师一民,韩赛,耿炜,孙建一,王雅玉,张秀荣
0 引言
子宫内膜癌是女性生殖道三大恶性肿瘤之一,占女性生殖道恶性肿瘤的25%左右,近20年全球范围内的发病率逐年上升且呈现年轻化趋势。据中国癌症流行病学统计显示,我国子宫内膜癌每年新发病率为634/105,死亡率为21.8/105[1]。子宫内膜癌目前以手术治疗为主,但中晚期及复发患者常常因转移等失去手术机会,且化、放疗效果不理想,使其5年生存率仅维持在20%~57%[2-5]。因此,子宫内膜癌的早期发现及治疗至关重要,寻找子宫内膜癌生物学功能相关基因,用于早期诊断和治疗内膜癌的有效分子治疗靶点已经成为亟待解决的科学问题。RNA结合基序蛋白8A(RBM8A)是外显子连接复合体(EJC)的核心因子。EJC在真核生物中充当转录后调控网络中的节点[6-7]。RBM8A基因位于染色体1q21.1,在细胞中大量表达,在细胞质和细胞核之间穿梭[8-9]。有文献报道,RBM8A促进脑恶性胶质瘤的生长及迁移[10-11],且在肝癌中高表达并促进肿瘤进展[12-13]。但其在子宫内膜癌发生发展中的作用机制仍不明确。本研究拟探讨RBM8A对子宫内膜癌细胞HEC-1A增殖、凋亡、迁移、侵袭等生物学行为的影响,探索RBM8A在子宫内膜癌中发挥作用的通路,从而明确其在子宫内膜癌发生发展中的作用,为开发子宫内膜癌新的治疗靶点提供理论基础。
1 材料与方法
1.1 细胞系和细胞培养
人子宫内膜HEC-1A细胞株购自中国科学院细胞库(中国上海),在RPMI1640(Hyclone Laboratories,Logan,UT,美国)培养基中培养。培养基中添加10%胎牛血清(澳大利亚悉尼Gibco公司)和1%青霉素-链霉素,并在37℃、5%CO2二氧化碳培养箱中孵育。
1.2 抗体与试剂
RBM8A抗体购自美国Proteintech公司,E-cadherin 抗体、Vimentin抗体、cleaved-caspase9、cleaved-caspase3抗体及GAPDH内参均购自美国CST有限公司。RBM8A敲低质粒及空载质粒构建由上海吉凯基因化学技术有限公司完成。反转录试剂盒及2×SYBR Green qPCR Mix试剂盒均购自上海翊圣生物科技有限公司。CCK-8试剂盒购自上海碧云天生物技术有限公司。1×Bradford蛋白定量试剂盒购自美国Bio-Rad公司。Transwell小室购自美国Corning公司。RBM8A引物及GAPDH内参引物由北京擎科生物科技有限公司合成。RBM8A引物:正义:5’-GATGGGGACGAGAGCATTCAC-3’,反义:5’-CGCTGTCATAATCCTCACGCA-3’;GAPDH内参引物:正义:5’-CTGGCCAAGGTCATCCATGAC-3’,反义:5’-CTTGCCCACAGCCTTGGCAG-3’。
1.3 方法
1.3.1 实时定量PCR法检测RBM8A mRNA表达水平 取对数生长期HEC-1A细胞,胰酶消化,离心收集细胞,TRIzol法提取总RNA,反转录合成cDNA。以cDNA为模板,RT-qPCR法检测细胞中RBM8A mRNA水平。以GAPDH为内参,计算RBM8A相对表达量,绘制溶解曲线,最终数据以2-△△Ct方法进行分析。实验重复3次。
1.3.2 慢病毒感染 将对数生长期HEC-1A细胞按3×105个/孔接种于6孔板,培养24 h待细胞贴壁,融合至50%左右时,根据预实验结果,加入等量病毒上清液(其中无意义序列shControl为对照组,shRBM8A为实验组)感染细胞6 h后换液,48 h后荧光显微镜观察感染效率,待感染效率达80%时,用嘌呤霉素筛选感染成功的HEC-1A细胞并获得稳转细胞株用于后续实验。RT-qPCR及Western blot法鉴定慢病毒过表达效果。
1.3.3 细胞增殖实验 CCK-8法检测细胞增殖。取实验组及对照组处对数生长期的HEC-1A细胞,胰酶消化计数,使细胞密度为2×104个/毫升,按每孔200 μl接种于96孔板,每组均设置5个复孔,于37℃、5%CO2培养箱中培养。分别在培养1、2、3、4、5 d时每孔加20 μl CCK-8检测试剂继续培养45 min,酶标仪检测各孔在波长450 nm处的OD值,并绘制细胞生长曲线,OD值越大表示活细胞数越多,细胞增殖越快。实验重复3次。
1.3.4 Transwell实验 取Transwell小室置于24孔板,将shControl、shRBM8A组HEC-1A细胞,胰蛋白酶消化,完全培养基终止消化,离心后弃上清液,用无血清的培养基重悬,使其细胞密度为5×105个/毫升。迁移试验:取上述重悬细胞,上室加入200 μl细胞悬液,下室加入700 μl含10%胎牛血清的培养基。培养48 h后,取出小室,PBS清洗3次,棉签轻轻擦拭上室细胞,4%多聚甲醛固定15 min,0.4%结晶紫染色5 min,PBS清洗干净并晾干,显微镜下随机取5个视野细胞计数并取平均值。侵袭试验:将基质胶与无血清培养基按1:8稀释后,均匀铺在Transwell小室底部膜的上室面(50 μl),室温干燥后待用。上室加入上述细胞悬液100 μl,下室内加入700 μl含10%胎牛血清的培养基。后续操作同迁移试验,所有实验重复3次。
1.3.5 流式凋亡检测 取对数生长期细胞,制成单细胞悬液,按1×106细胞/孔接种于6孔板。次日,细胞贴壁后,加入等量病毒上清液(其中无意义序列shControl为对照组,shRBM8A为实验组),继续培养72 h,细胞用不含EDTA的胰酶消化至皿底呈花斑状,用完全培养基终止消化后转移至15 ml离心管,转速300g,4℃离心5 min,弃上清液。用预冷的PBS 300g离心力,4℃离心5 min,洗涤细胞两次,吸去PBS,加入100 μl 1×Binding Buffer重悬细胞。加入5 μl Annexin V-FITC和10 μl PI染液,轻轻混匀。避光、室温反应10~15 min。样品在1 h内用流式细胞仪检测,结果用FlowJo_V10软件分析。实验重复3次。
1.3.6 Western blot检测蛋白水平 收集各组细胞,加入MCLB细胞裂解液,提取总蛋白,Bradford法检测蛋白浓度。根据各组蛋白浓度上样总量25 mg,以80~120 V电压进行SDS-PAGE电泳,分离后360 mA转膜90 min,封闭1 h后加入相应一抗,4℃孵育过夜。次日,将膜取出,TBST缓冲液清洗3次,加入二抗室温孵育40 min;TBST缓冲液洗涤3次,每次10 min。在凝胶成像系统利用超敏ECL化学发光底物曝光显影并保存数据。以GAPDH为内参,分析目的蛋白相对表达量。实验重复3次。
1.4 统计学方法
所有数据采用GraphPad Prism 8.0版本用于统计分析和绘图。计量资料以()表示,连续变量组间比较用Student’st检验,所有检验均为双边检验,P<0.05为差异有统计学意义。
2 结果
2.1 RBM8A在子宫内膜癌中高表达
TCGA数据库分析,RBM8A在子宫内膜癌中表达量高于正常子宫内膜组织(P<0.05),差异有统计学意义,见图1。

图1 TCGA示RBM8A在正常子宫内膜和子宫内膜癌组织中的差异表达Figure 1 TCGA showed that the expression of RBM8A was different in normal endometrial and eddometrial cancer tissues
2.2 慢病毒敲低RBM8A对HEC-1A细胞的效率
细胞转染对照组及敲低RBM8A病毒后,收取细胞沉淀,提取细胞RNA,并反转录成CDNA,RT-qPCR法证明其RBM8A基因被敲低。实验组HEC-1A细胞中RBM8A mRNA相对表达量明显低于对照组,差异有统计学意义(P<0.001),见图2A。此外,收取另一部分细胞沉淀,提取细胞蛋白。Western blot法证明在HEC-1A shRBM8A细胞中RBM8A蛋白表达降低,见图2B。提示携带重组慢病毒感染HEC-1A细胞成功。
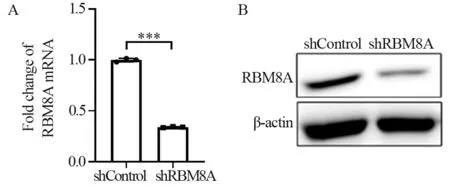
图2 敲低RBM8A效率验证Figure 2 Efficiency verification of RBM8A knockdown
2.3 RBM8A对HEC-1A细胞增殖的影响
细胞消化计数后种入96孔板后,每天同一时间测细胞OD值,持续5天,两组细胞的OD值均逐渐升高,与对照组相比,实验组2~4天OD值均较低,且差异有统计学意义。提示敲低RBM8A能抑制 HEC-1A细胞的增殖,见图3。

图3 敲低RBM8A对HEC-1A细胞增殖的影响Figure 3 Effect of knockdown of RBM8A on the proliferation of HEC-1A cells
2.4 RBM8A对HEC-1A细胞凋亡的影响
通过测定Annexin V染色细胞的数量,观察细胞凋亡程度。我们发现当RBM8A被敲低后,HEC-1A细胞凋亡明显增加(22.97%vs.7.51%,P=0.0010),见图4。

图4 敲低RBM8A对HEC-1A细胞凋亡的影响Figure 4 Effect of RBM8A knockdown on apoptosis of HEC-1A cells
2.5 RBM8A对HEC-1A细胞迁移和侵袭的影响
与对照组相比,实验组细胞的迁移及侵袭数量明显减少,见图5。提示降低RBM8A表达能抑制子宫内膜癌细胞HEC-1A的迁移(P=0.0001)和侵袭(P=0.0013),差异有统计学意义。
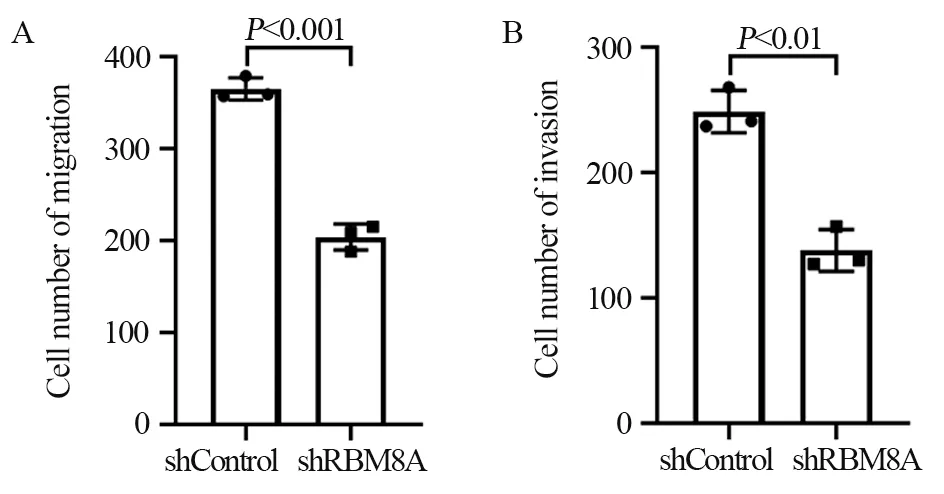
图5 敲低RBM8A对HEC-1A细胞迁移和侵袭的影响Figure 5 Effect of RBM8A knockdown on migration and invasion of HEC-1A cells
2.6 RBM8A对凋亡相关蛋白表达的影响
敲低RBM8A后,HEC-1A细胞中cleaved-caspase9及cleaved-caspase3表达明显升高,见图6。说明敲低RBM8A激活了细胞内源性凋亡通路。
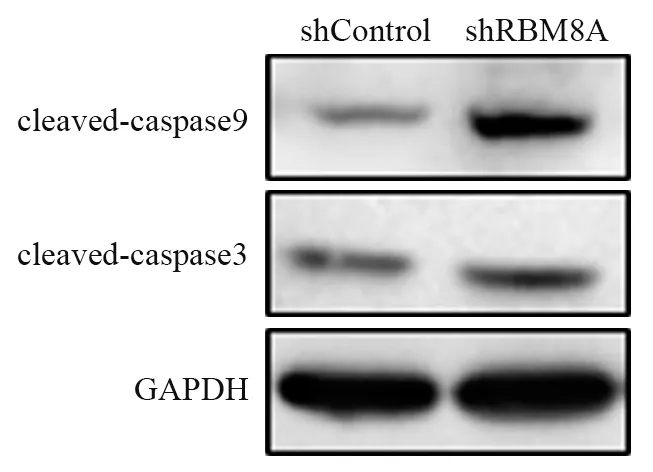
图6 敲低RBM8A对相关凋亡蛋白的影响Figure 6 Effect of RBM8A knockdown on related apoptotic proteins expression
2.7 RBM8A对EMT通路相关蛋白表达的影响
相比对照组,实验组E-cadherin蛋白表达升高,Vimentin表达降低,见图7。提示敲低RBM8A可抑制 HEC-1A细胞的EMT过程。

图7 敲低RBM8A对EMT蛋白的影响Figure 7 Effect of RBM8A knockdown on EMT protein expression
3 讨论
据最新流行病学数据统计,子宫内膜癌的发病率和相关死亡率每年都在上升[14]。近年来,子宫内膜癌的手术治疗已不断完善。来自癌症的数据基因组图谱(TCGA)项目提高了我们对子宫内膜癌异质性的认识[15-17]。这种新知识已经更加开放了针对复发性疾病的靶向治疗选择。随着肥胖率继续上升,子宫内膜癌预防和治疗都需要新的方法,来解决不断增加的子宫内膜癌病例和相关死亡。
无意义介导的mRNA衰减(nonsense-mediated RNA decay,NMD)通路中关键因子的异常表达与各种类型的癌症有关[18]。NMD通路通过消除终止密码子mRNA的转录,以及降解编码细胞生长、迁移和细胞存活的蛋白质,帮助调节细胞功能[19-20]。有文献报道NMD功能的丧失会促进肿瘤的生长和侵袭[21],这表明靶向NMD通路的关键因子可能对癌症治疗有效[22-24]。
其中一个NMD因子是RBM8A,它是外显子连接复合体的核心因子,有助于调节RNA转录、翻译、细胞周期调节和凋亡[8,25-27]。RBM8A在多种类型的肿瘤中异常表达,包括宫颈癌、非小细胞肺癌、骨髓瘤和肝细胞癌[28-30]。文献报道,它与转录因子STAT3结合,促进其DNA结合,从而上调靶基因[31]。然而RBM8A在子宫内膜癌中的作用尚未见报道。本研究中,我们发现RBM8A在子宫内膜癌组织中高表达,因此我们探讨了RBM8A表达水平对子宫内膜癌细胞生物学行为的影响。我们发现,与正常子宫内膜组织比较,子宫内膜癌组织中RBM8A表达升高,抑制RBM8A的表达会抑制细胞生长和侵袭能力,促进细胞的凋亡。然而导致这一现象的具体作用机制尚不清楚,需要进一步探讨。
凋亡是一种严格受控的细胞死亡模式,以核固缩、细胞皱缩、细胞膜起泡和DNA片段化为特征。凋亡的核心调控分子是caspase。我们观察到,敲低RBM8A后细胞凋亡增加。为了验证这一现象,我们通过Western blot检测有活性的caspase蛋白。结果发现敲低RBM8A后,cleaved-caspase9及cleaved-caspase3表达增加,这提示与凋亡信号和活动紧密相联系的“启动型”caspase-9通过剪切和活化激活下游的“执行型”caspase-3,从而引起最终细胞程序性死亡。
上皮细胞-间充质转化(EMT),是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。EMT在胚胎发育、慢性炎性反应、组织重建、癌症转移和多种纤维化疾病中发挥了重要作用[32],其主要的特征有细胞黏附分子(如E-钙黏蛋白)表达减少、细胞角蛋白细胞骨架转化为波形蛋白(Vimentin)为主的细胞骨架及形态上具有间充质细胞的特征等。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型。阐明调控恶性肿瘤细胞发生EMT过程的分子机制,明确其在恶性肿瘤的发生、发展、转移中的病理意义,并探索基于EMT关键分子的诊断方法及靶向EMT关键分子的治疗手段是肿瘤转移中EMT机制研究的关键科学问题。本研究结果显示,敲低RBM8A后HEC-1A 细胞E-cadherin蛋白表达水平显著升高,而Vimentin蛋白表达水平显著降低,表明 HEC-1A细胞EMT过程受到抑制,提示降低RBM8A后是通过抑制EMT过程导致子宫内膜癌细胞增殖、迁移和侵袭受到抑制。
综上所述,本研究通过体外实验证实沉默RBM8A基因可致子宫内膜癌细胞的增殖、迁移、侵袭并促进细胞凋亡,抑制EMT信号转导通路可能是其作用机制。由于本课题组条件有限,未进行动物实验验证其作用。未来可继续通过人体组织表达验证及动物皮下成瘤验证RBM8A在子宫内膜癌中的作用及机制。RBM8A有望成为子宫内膜癌的分子靶向治疗新的靶点。
