靶向超声微泡介导VEGF基因转染对薄型子宫ER的影响研究*
2023-02-14孙泉杨洁许松胡碧娟刘敏黄志平
孙泉 杨洁 许松 胡碧娟 刘敏 黄志平
子宫内膜容受性(endometrial receptivity,ER)主要是指子宫内膜处于一种允许胚泡黏附直至完成胚胎着床的状态,薄型子宫内膜是指子宫内膜厚度低于可以妊娠的最低厚度,本质是黄体中期子宫内膜厚度<7 mm[1-3]。有研究发现,子宫内膜血流量的减少会抑制子宫腺上皮的生长,从而引起血管内皮生长因子(vascular endothelial growth factor,VEGF)表达的降低,引发内膜血管系统损伤,子宫内膜生长受限继而导致薄型子宫内膜[4-6]。由此推测,通过相关医疗技术将外源性VEGF 基因靶向转染至子宫内膜损伤部位,可能有助于内膜修复。而寻找一种安全有效、经济实惠、易于控制的针对薄型子宫内膜的基因转染治疗技术具有重要意义。鉴于此,本文研究了靶向超声微泡介导VEGF 基因转染对薄型ER 的效果,现报道如下。
1 资料与方法
1.1 一般资料 选择40 只性成熟但未交配的具有动情周期的雌性SD 大鼠进行研究。将其随机分为四组,包括对照组10 只,模型组10 只,阴性对照组10 只,治疗组10 例。均购自空军军医大学动物实验中心[许可证编号SCXK(陕)2019-001],10 周龄,体重220~240 g,实验大鼠饲养于SPF 级动物房,自由饮食,自然光照,环境相对湿度为50%~55%,温度为22~26 ℃,明暗周期为12 h/12 h,适应性饲养1 周。实验全过程符合动物伦理学标准。
1.2 方法
1.2.1 仪器及试剂 仪器:彩色多普勒超声诊断仪(PhilipsiU22)、Malvern 激光粒径测量仪、荧光定量PCR 仪、荧光显微镜、流式细胞分析仪、扫描电子显微镜。试剂:大鼠VEGF 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒及大鼠白血病抑制因子(leukaemia inhibitory factor,LIF)ELISA 试剂盒均购自深圳子科生物科技有限公司,苏木精-伊红(hematoxylin-eosin,HE)染色液购自南昌雨露实验器材有限公司。
1.2.2 干预方式 模型组、阴性对照组及治疗组大鼠均自宫角处注入95%无水乙醇贮留5 min。经过两个动情周期后,取处于动情周期的大鼠,测量其内膜厚度。若子宫内膜变薄即造模成功。薄型子宫内膜大鼠造模成功后,通过鼠尾静脉注入制备好的造影剂,初始剂量为1.0 mL,注射后每4 min 给药0.5 mL,间隔给药8 次,累计5.0 mL。采用超声监测微泡运动,每次待微泡运动到子宫内膜部位时破裂微泡予以治疗,即用彩色多普勒超声诊断仪,探头S5-1,启用二次谐波模式,并将发射频率和接收频率分别调整为1.5 MHz、3.0 MHz,将机械指数调至最大。间隔1 d 实施1 次上述治疗,共5 次,注射5 次后间隔10 d 再注射一次。模型组予以0.9%生理盐水注射治疗,阴性对照组则予以超声微泡+抗体(不含VEGF165 基因和穿膜肽)治疗,治疗组则予以靶向超声微泡介导VEGF 基因转染治疗。
1.3 观察指标 干预4 个动情周期之后,比较四组大鼠子宫内膜厚度及腺体数量,子宫内膜血流灌注,子宫内膜VEGF 以及LIF 水平。(1)子宫内膜厚度及腺体数量。采集大鼠子宫组织,以4%多聚甲醛固定,做厚度为10 μm 的连续切片。每个子宫随机选择2 个切片,HE 染色之后观察子宫内膜形态,同时完成子宫内膜厚度的测量。此外,将HE 染色后切片放置在高倍镜下拍照并统计切片腺体数目。(2)内膜血流灌注检测。用彩色多普勒超声诊断仪,探头频率5.0 MHz,选择子宫内膜或/和内膜下区域彩色血流最显著部位,以脉冲多普勒显示其频谱。并由超声仪内置软件自动生成数据,获得血流阻力指数(RI)、搏动指数(PI)、脐动脉收缩压与舒张压比值(S/D)数据,所有数据均进行2 次测量,以平均值作为最终结果。(3)VEGF 及LIF 水平检测。采集大鼠子宫内膜组织,制备组织匀浆,酶标仪于450 nm 波长下检测吸光度,并通过标准曲线计算样本浓度。
1.4 统计学处理 数据处理由SPSS 22.0 软件完成,计量资料表示为(x-±s),分析开展独立样本t检验。多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 四组大鼠子宫内膜形态变化 正常组大鼠子宫内膜组织结构完整,呈波浪状,且间质无水肿,血管及腺体数量较多,见图1;模型组大鼠子宫内膜厚度相较于正常组织显著变薄,且内膜结构不完整,血管、腺体稀疏,见图2;阴性对照组相较于正常组织显著变薄,血管、腺体稀疏,见图3;治疗组子宫内膜表面存在一定波浪形,部分区域新生腺体和毛细血管增加,子宫内膜厚度相较模型组及阴性对照组明显增加,见图4。
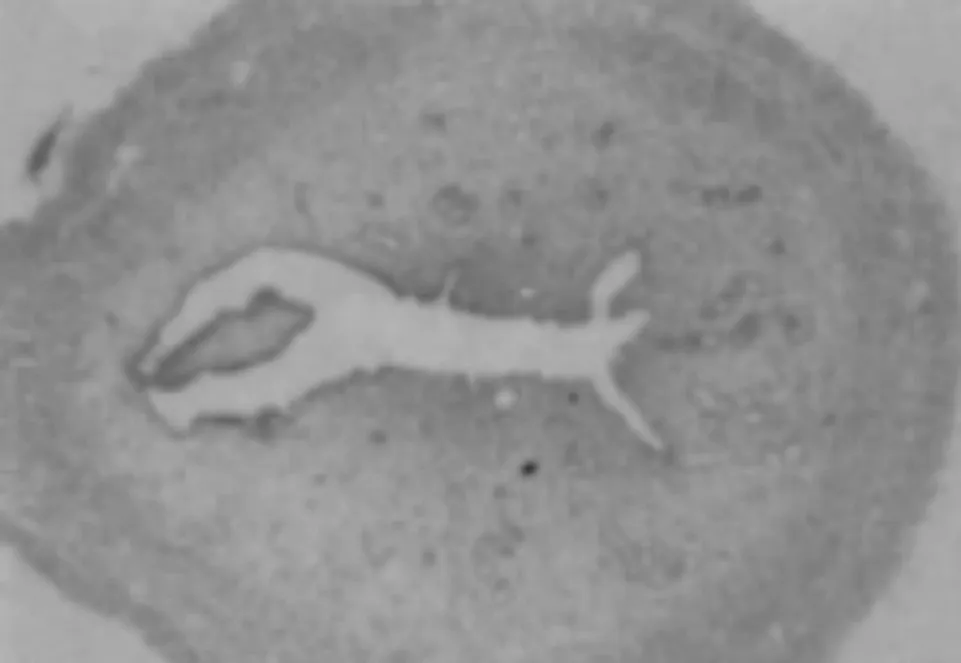
图1 正常组(HE染色,×400)
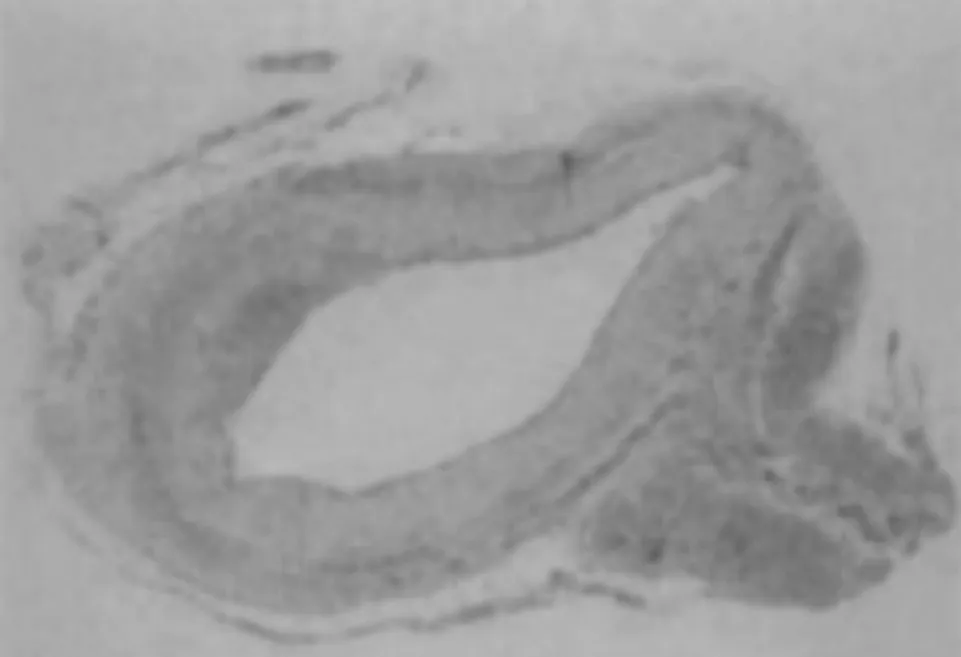
图2 模型组(HE染色,×400)
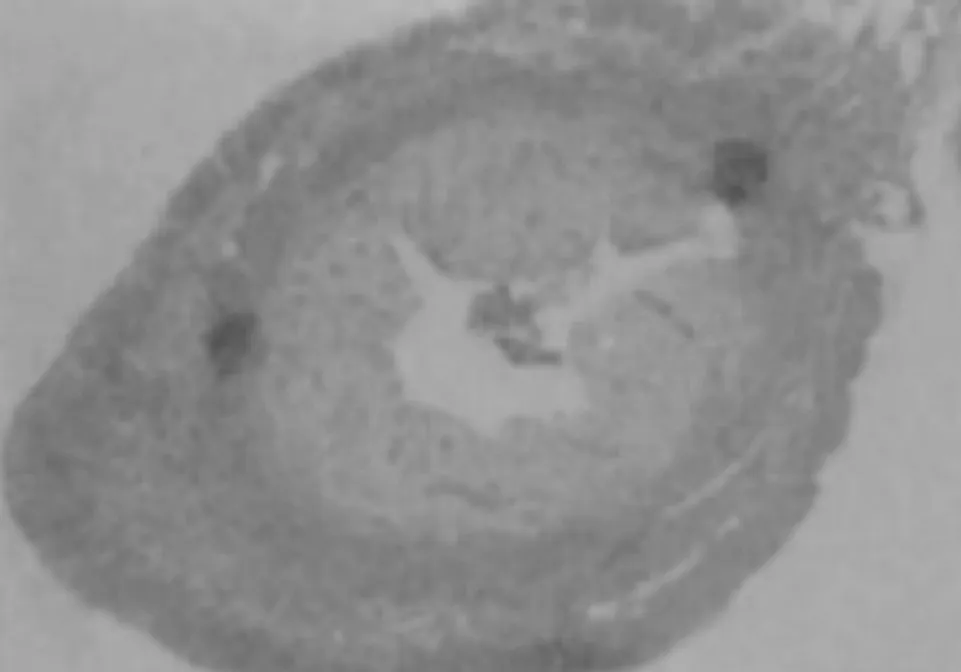
图3 阴性对照组(HE染色,×400)
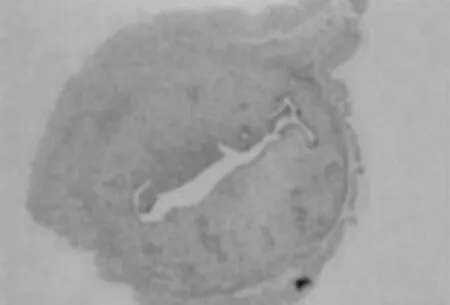
图4 治疗组(HE染色,×400)
2.2 四组大鼠子宫内膜厚度及腺体数量对比 正常组子宫内膜厚度及腺体数量均高于模型组、阴性对照组及治疗组,治疗组子宫内膜厚度及腺体数量均高于模型组、阴性对照组(P<0.05)。见表1。
表1 四组大鼠子宫内膜厚度及腺体数量对比()
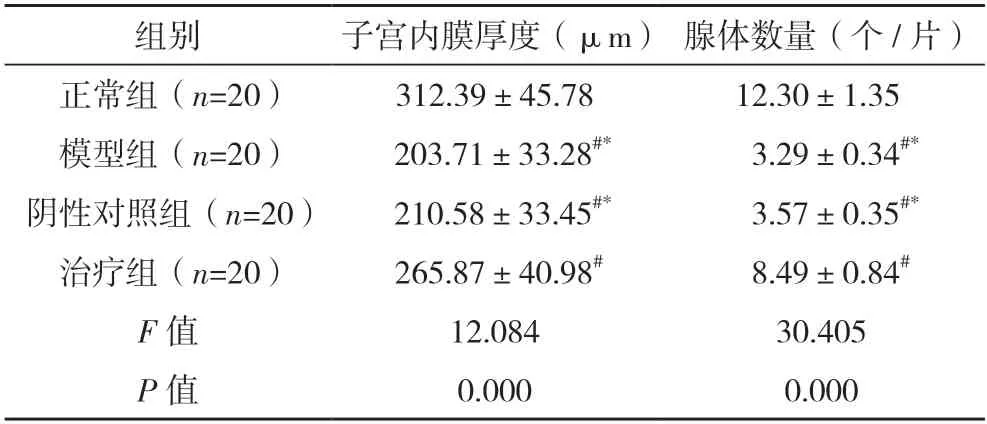
表1 四组大鼠子宫内膜厚度及腺体数量对比()
#与正常组相比,P<0.05;*与治疗组相比,P<0.05。
2.3 四组大鼠子宫内膜血流灌注对比 正常组RI、PI、S/D 均低于模型组、阴性对照组及治疗组,治疗组RI、PI、S/D 均低于模型组、阴性对照组(P<0.05)。见表2。
表2 四组大鼠子宫内膜血流灌注对比()
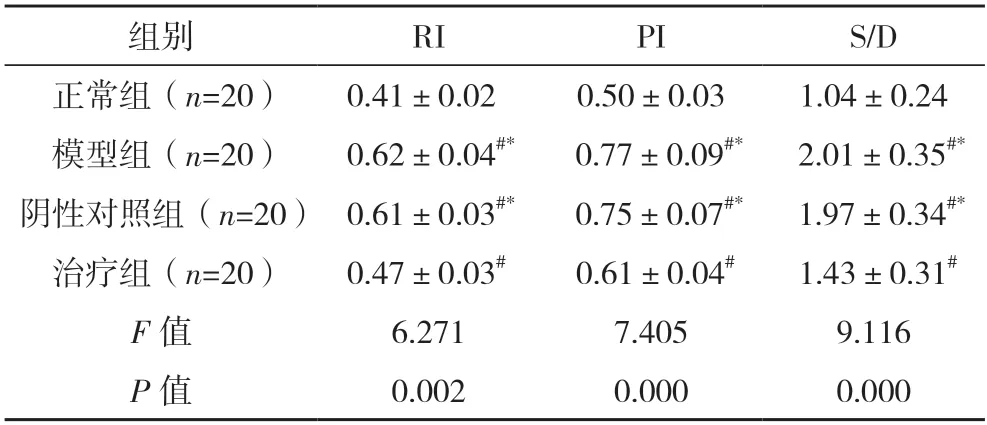
表2 四组大鼠子宫内膜血流灌注对比()
#与正常组相比,P<0.05;*与治疗组相比,P<0.05。
2.4 四组大鼠子宫内膜VEGF 以及LIF 水平对比 正常组子宫内膜VEGF、LIF 水平均高于模型组、阴性对照组及治疗组,治疗组子宫内膜VEGF、LIF水平均高于模型组、阴性对照组(P<0.05)。见表3。
表3 四组大鼠子宫内膜VEGF以及LIF水平对比()
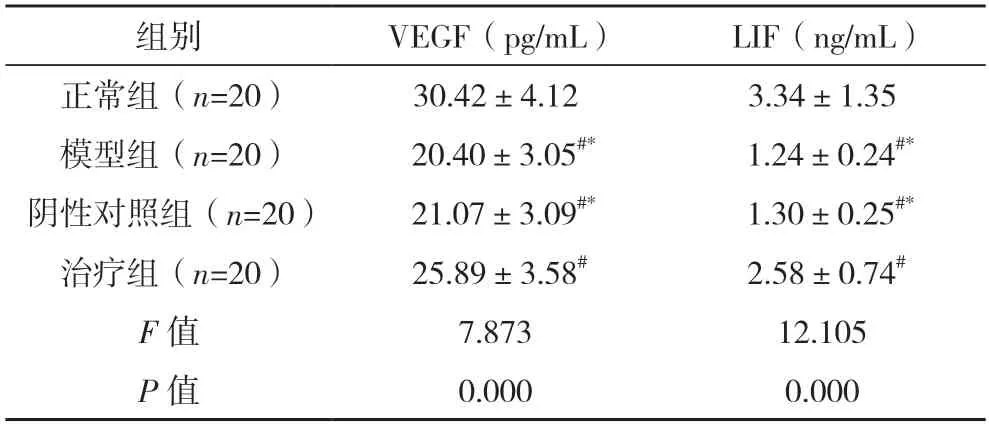
表3 四组大鼠子宫内膜VEGF以及LIF水平对比()
#与正常组相比,P<0.05;*与治疗组相比,P<0.05。
3 讨论
携抗ICAM-1 单克隆抗体的造影剂微泡可能通过特异性结合在受损的内膜血管,从而发挥靶向作用[7-9]。VEGF 属于子宫血管发育关键性调节因子之一,子宫内膜处于种植窗期时会出现VEGF 的明显上调,且表达部位自子宫内膜普遍表达至着床位点局部,反映了VEGF 可作为植入胚胎与接受状态子宫内膜血管结构间的局部信号分子[10-11]。
本文结果发现,正常组子宫内膜厚度及腺体数量均高于模型组、阴性对照组及治疗组,治疗组子宫内膜厚度及腺体数量均高于模型组、阴性对照组(P<0.05),这提示了靶向超声微泡介导VEGF 基因转染可有效修复子宫内膜。分析原因,种植窗期子宫内膜VEGF 及其受体flk-1/KDR 表达均显著增加,VEGF 与受体flk-1/KDR 结合后发挥多种生物学功能,如血管内皮细胞增殖、血管生成、增加血管通透性、介导信号转导、改变内皮细胞基因的表达、调节子宫内膜生长等[12-14]。而靶向超声微泡转染主要是通过抗ICAM-1 可特异性的与损伤血管内皮结合的特点制备靶向造影剂,加入穿膜肽Tat 增加其结合能力,将VEGF 基因转染至受损内膜血管并发挥作用,最终实现子宫内膜修复作用[15]。此外,正常组RI、PI、S/D 均低于模型组、阴性对照组及治疗组,治疗组RI、PI、S/D 均低于模型组、阴性对照组(P<0.05),这反映了靶向超声微泡介导VEGF基因转染有助于患者子宫内膜血流灌注的改善。究其原因,VEGF 具有诱导血管生成、增加血管通透性及维持血管功能等作用,是迄今为止人类所发现的最强效促血管生成因子[15-17]。而靶向超声微泡技术主要是通过靶向转染外源性VEGF 基因至子宫内膜损伤部位,从而促进子宫内膜血管的生成,为受损内膜的修复起到积极促进作用,进一步恢复其增殖能力。另外,正常组子宫内膜VEGF、LIF 水平均高于模型组、阴性对照组及治疗组,治疗组子宫内膜VEGF、LIF 水平均高于模型组、阴性对照组(P<0.05)。其中VEGF 是介导调控子宫内膜血管生成的关键性蛋白,不但有利于诱导血管新生,同时可增加血管通透性。LIF 则是多功能细胞因子之一,可通过对胚胎干细胞分化进行抑制,继而维持其增殖能力,对胚泡植入具有极其重要的作用。这充分说明了治疗组可有效修复子宫内膜损伤,促进ER的恢复[18-20]。
综上所述,靶向超声微泡介导VEGF 基因转染治疗薄型子宫内膜效果显著,可促进ER 的改善。
