淫羊藿苷对人肝癌HepG2细胞的作用及其机制研究
2023-02-13徐佳伟尤雯雯
徐佳伟 尤雯雯
浙江省丽水市中心医院药学部 (浙江 丽水, 323000)
肝细胞癌(HCC)是最常见的恶性肿瘤之一,5年存活率为18%,是仅次于胰腺癌的第二大致命性肿瘤[1]。肝癌的发生是一个多步骤的过程,由外界刺激引起肝细胞或干细胞的基因改变,导致增殖、凋亡抑制、发育异常和肿瘤形成[1]。目前,晚期肝癌的预后和治疗效果仍然很差。寻找有效的药物并了解其作用机制非常重要。
淫羊藿苷(ICA)是从淫羊藿属植物中提取的一种黄烷醇糖苷,具有抗氧化、神经保护、骨保护、抗炎和抗肿瘤等多种药理作用[2]。近年来,淫羊藿苷已被证明在各种类型的人类癌细胞中具有抗癌作用,包括结肠癌[3]、胃癌[4]、卵巢癌[5]和非小细胞肺癌等[6]。早期体外研究表明,淫羊藿苷抑制肝癌细胞增殖并诱导其凋亡[7],但ICA对肝癌细胞的抑制作用机制尚不明确。因此,本文旨在探讨淫羊藿苷对人肝癌HepG2细胞的影响及 其机制。
1 材料与方法
1.1 主要试剂 ICA(纯度>98%)购自中国药品生物制品检定所,以20 mM的浓度溶解在二甲基亚砜(DMSO)中作为储备溶液,储存于-20℃,并在使用前用培养基稀释。Dulbecco改良的Eagle培养基(DMEM)、胎牛血清(FBS)购自Gibco,细胞计数试剂盒(CCK-8)购自广州益源生物科技有限公司。膜联蛋白V(Annexin V)-FITC/PI凋亡检测试剂盒、细胞周期检测试剂盒购自KeyGEN生物技术公司。CH-223191(AHR拮抗剂)购自Selleckchem,用DMSO溶解。抗体Bcl-2、Bax、CyclinD1、CDK4、芳烃受体(AHR,#83200)和β-actin (#3700)购自Cell Signaling Technology。BCA 蛋白定量试剂盒、 细胞裂解液购自碧云天生物技术研究所。
1.2 人肝癌细胞培养 人肝癌HepG2细胞购自中国科学院细胞库,细胞在37℃、5% CO2条件下培养于含有10%胎牛血清的DMEM中。
1.3 CCK-8法测定细胞增殖 用细胞计数试剂盒-8(CCK-8)测定细胞活力。每孔100 μl的培养基在96孔板中接种的5 000个细胞,施加不同浓度的ICA(0-40 μM)或DMSO分别培养24 h、48 h和72 h,每孔细胞用10 μl CCK-8溶液在37℃的5% CO2培养箱中孵育2 h,最后用酶标仪在450 nm处测定吸光度。为了确定AHR在ICA处理的HepG2细胞中的作用,在有或没有ICA(20 μM)培养的细胞中施用不同浓度的AHR拮抗剂CH223191(0-20 μM),如上测定吸光度。
1.4 集落形成试验 HepG2细胞以1×103个/孔的密度接种于6孔板中,有或没有ICA(20 μM )培养,当平板上形成可见的克隆时,用PBS洗涤菌落,用甲醇(0.5 ml/孔)室温固定20 min,然后用PBS洗涤3次,室温下用0.5%结晶紫染色30 min。染色细胞用PBS清洗5次,在室温下风干2 h。在显微镜(奥林巴斯MTV-3)下计数含有>50个细胞的集落。
1.5 流式细胞术检测细胞周期和细胞凋亡 细胞接种在6孔板中过夜培养,施加不同浓度的ICA或DMSO孵育48 h,孵育结束后,用细胞周期染色试剂盒进行细胞周期分析。先用70%冰冷乙醇固定细胞,在4℃孵育过夜,冷PBS洗涤,100 μl RNase处理30 min,再悬浮在400 μl碘化丙啶(PI)培养基中,在黑暗室温下孵育30 min。用BD LSR Ⅱ流式细胞仪软件分析细胞周期分布。细胞凋亡按Annexin V-FITC凋亡检测试剂盒说明书进行检测。处理后的细胞用胰蛋白酶消化,离心制粒,然后用PBS洗涤两次。然后用5 μl AnnexinV-FITC和5 μl PI溶液在20℃黑暗中染色15 min,最后用400 μl的Annexin V结合缓冲液对细胞进行染色,BD LSR Ⅱ流式细胞仪对各组细胞凋亡率进行分析。
1.6 蛋白免疫印迹检测相关蛋白表达水平 细胞用裂解缓冲液在冰上裂解20 min,然后在4℃下16 000 g离心15 min。BCA试剂盒检测上清液中的蛋白质浓度。用SDS-PAGE(12%)分离每个泳道40 μg上清液蛋白的样品,并转移到聚偏二氟乙烯膜上,封闭1 h后,将膜与一抗(1∶1 000)在4℃孵育过夜,然后将膜与含有辣根过氧化物酶偶联的二抗(1∶3 000)在25℃孵育1 h。采用增强型化学发光仪(ECL)检测免疫反应条带,并用图像采集系统拍摄。
1.7 统计学方法 所有结果都表示为至少3个独立实验的平均值±标准差。采用SPSS 20.0统计软件进行统计分析,使用单因素方差分析(ANOVA)和Tukey多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 ICA抑制肝癌细胞增殖 与DMSO组相比,ICA以剂量和时间依赖的方式抑制肝癌细胞增殖(图1A~C)。同样,ICA(20 μM )处理的肝癌HepG2细胞的集落形成能力显著低于DMSO组(P<0.001,图1D~E)。

图1 ICA对肝癌细胞增殖能力的影响 A~C:CCK8测定不同浓度的ICA处理肝癌HepG2细胞24、48和72 h后的细胞增殖抑制率;D~E:ICA(20 μM)处理肝癌HepG2细胞的集落形成能力;与DMSO(ICA 0 μM)组比较,*P<0.05,***P<0.001
2.2 ICA诱导肝癌细胞周期阻滞 ICA增加了HepG2细胞的G0/G1细胞周期阶段的细胞数量百分比(P<0.001,图2A),通过蛋白印迹分析评估参与细胞周期过程的蛋白表达,结果提示ICA以剂量依赖性方式降低CDK4和cyclinD1蛋白表达(P<0.001,图2B),这些结果证实了ICA诱导肝癌细胞的细胞周期停滞。

图2 ICA对肝癌细胞细胞周期的影响 A:流式细胞测定不同浓度的ICA处理肝癌HepG2细胞的细胞周期;B:通过蛋白印迹分析CDK4和cyclinD1蛋白的表达。与DMSO(ICA 0 μM)组比较,*P<0.05,**P<0.01,***P<0.001
2.3 ICA促进肝癌细胞凋亡 ICA显著提高了HepG2细胞早期凋亡细胞的百分比,并呈剂量依赖性方式诱导了细胞凋亡(P<0.05,图3A)。同时分析细胞凋亡相关蛋白Bcl-2和Bax表达,发现在ICA增加了Bax和降低了Bcl-2蛋白表达(P<0.001,图3B)。

图3 ICA对肝癌细胞细胞凋亡的影响 A:流式细胞测定不同浓度的ICA处理肝癌HepG2细胞的细胞凋亡;B:通过蛋白印迹分析Bcl-2和Bax蛋白的表达。与DMSO(ICA 0 μM)组比较, *P<0.05,***P<0.001
2.4 ICA通过激活AHR途径发挥其抗细胞增殖作用 ICA增加HepG2细胞AHR蛋白表达的水平(P<0.01,图4A)。接着,我们通过用AHR拮抗剂CH223191培养来确定ICA对HepG2细胞的作用是否减弱。用CH223191(1、10和20 μM)培养对体外HepG2细胞的增殖没有显著影响,而ICA(20 μM)对HepG2细胞增殖的影响被CH223191作用消除(P<0.05,图4B)。用CH223191培养后降低ICA (20μM)培养HepG2细胞中AHR水平(P<0.001,图4C)。这些结果表明ICA对细胞增殖的影响至少部分依赖于体外HepG2细胞中的AHR信号传导。
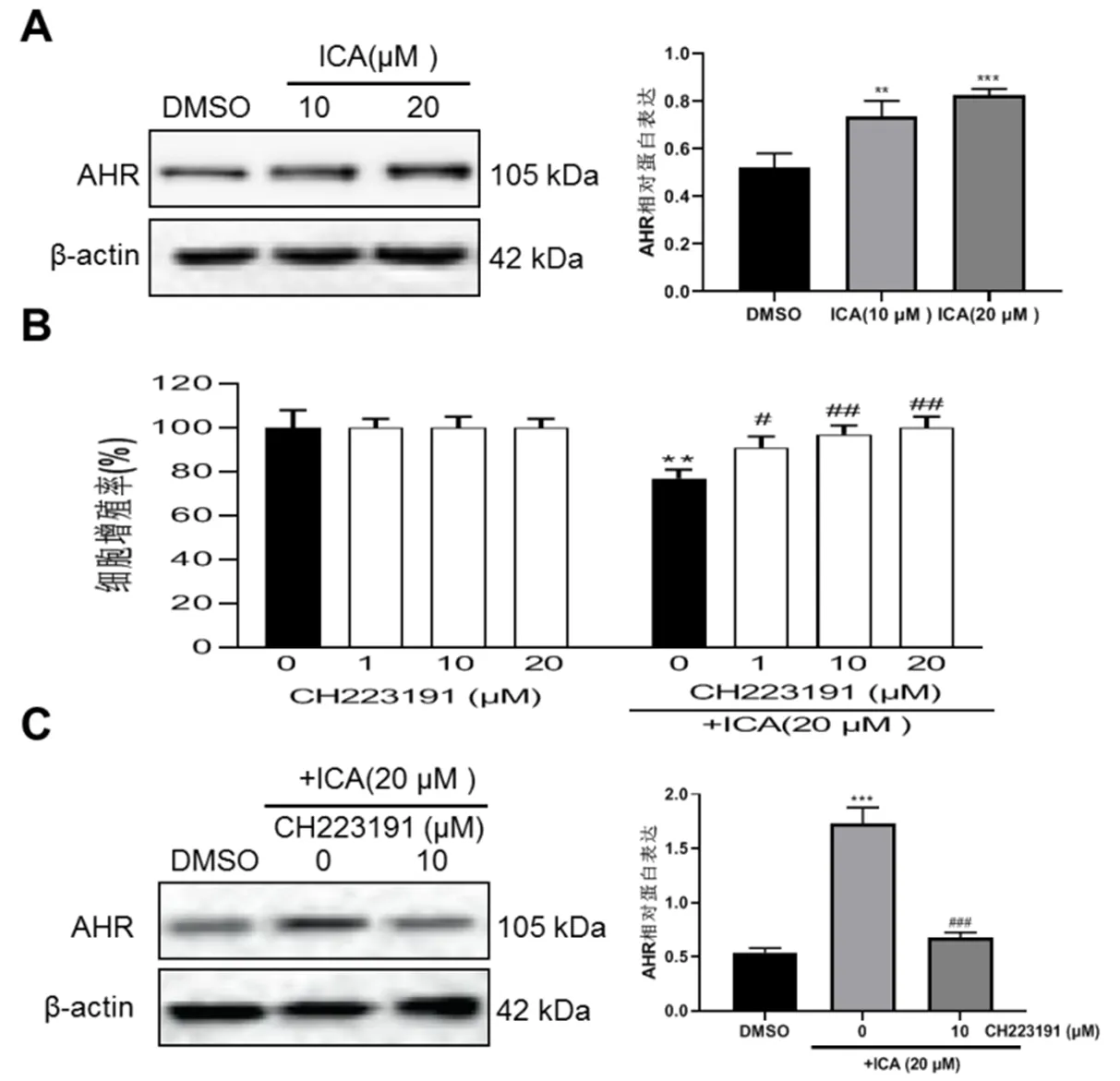
图4 ICA对肝癌细胞AHR途径的影响A:蛋白印迹分析ICA处理后AHR蛋白的表达;B:CCK8测定不同浓度CH223191处理对ICA存在的细胞增殖的影响;C:蛋白印迹分析CH223191对ICA处理后AHR蛋白表达的影响。与DMSO(ICA 0 μM)组比较,**P<0.01,***P<0.001,与ICA (20 μM)组比较, ##P<0.01,###P<0.001
3 讨论
肝癌是癌症相关死亡的常见原因,HCC占原发性肝癌的80%~90%[1]。尽管 HCC的治疗策略在不断进步,但其总体预后仍然很差。越来越多的文献研究中药在肝癌中的抗肿瘤活性[8]。淫羊藿苷的抗肿瘤活性在体外和体内的肿瘤中均得到了广泛的研究和报道,但其确切的抗肿瘤机制还有待揭示[9],我们的研究表明,ICA在体外对人肝癌HepG2细胞具有抗癌作用。ICA可抑制HepG2细胞的集落形成和增殖,诱导肝癌细胞周期阻滞和细胞凋亡,从机制上,我们通过AHR抗结剂评估了ICA可能通过激活AHR抑制细胞增殖。
据报道,ICA可抑制多种肿瘤细胞增殖,且没有明显的副作用[2,3,6]。先前的研究表明,细胞周期停滞在G0/G1期可以抑制HepG2细胞的增殖[10]。朱燕辉等报道,ICA能诱导肝癌细胞株SMMC-7721阻滞于G0/G1期并抑制其凋亡[11]。在本研究中,淫羊藿苷显著增加了G0/G1细胞的比例,并降低S期细胞比例,表明淫羊藿苷抑制肝细胞增殖,阻止细胞进入S期。此外,CDK4和cyclinD1作为细胞周期进程中的重要蛋白,可以诱导细胞从G1进展到S期[10]。我们观察到ICA显著降低细胞周期蛋白CDK4和cyclinD1的表达,这支持了细胞周期阻滞于G0/G1期。细胞凋亡失衡是肿瘤发生的主要机制之一。已经表明淫羊藿苷在体外可能通过降低Bcl-2、升高Bax蛋白的表达促进肝癌细胞的凋亡[11]。本研究的结果与之前的报道一致,提示ICA能诱导HepG2细胞凋亡,并激活凋亡标记蛋白Bax和抑制抗凋亡蛋白Bcl-2表达。
AHR在多种肿瘤中均高度表达并长期激活,其激活的生理作用在致癌作用中起关键作用[12]。Liu等结果提示AHR表达的增加与肝细胞癌的进展有关,并且可能在肝细胞癌的治疗中发挥潜在作用[13]。之前的研究的表明,抗AHR的内源性配体通过AHR激活显著抑制HCC细胞HCCLM3和SMMC-7721细胞的增殖,并通过改变相关蛋白的表达来诱导G0/G1期阻滞和凋亡[14]。因此,我们研究了AHR信号在肝细胞癌增殖和凋亡影响中的作用,结果显示ICA对HepG2细胞增殖的影响被AHR的一种特异性拮抗剂CH223191阻断。综上,ICA抑制人肝癌HepG2细胞的增殖和诱导细胞周期阻滞于G0~G1期,并诱导细胞凋亡,其机制可能与AHR信号的激活有关。
