干细胞动员对急性肺损伤幼鼠肺泡表面活性蛋白的影响
2023-02-13黄国日潘革莫锦丽杨兰黄忠向
黄国日,潘革,莫锦丽,杨兰,黄忠向
(1.广西医科大学第二附属医院儿科,广西南宁 530007;2.广西医科大学第三附属医院a.儿科,b.检验科,c.病理科,广西南宁 530031)
急性肺损伤(acute lung injury,ALI)以呼吸困难为主要表现,患者可在各个年龄段发病,是目前临床危重医学研究重点[1]。ALI的病理改变在于过度炎症反应使肺血管内皮细胞、肺泡上皮细胞遭受广泛性破坏,如肺泡表面活性物质(SP-A、SP-D、AQP5等)合成减少,因此改善肺泡表面活性物质水平逐渐成为ALI患者治疗靶点[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)为一类非造血细胞的多能干细胞,具有向多种组织细胞分化的能力[3]。近年来随着对干细胞多向分化潜能研究深入,发现干细胞可再生修复ALI的肺泡上皮细胞和内皮细胞,重建损伤的肺组织结构及功能,成为ALI治疗新靶点,并可能是未来治疗ALI患者的关键所在[4]。本实验通过对幼鼠自体骨髓干细胞进行动员,扩增入血,分析动员后肺泡表面活性蛋白水平变化,进而找到治疗ALI的新途径,为下一步临床开展儿童ALI的救治提供理论依据。
1 材料与方法
1.1 实验动物选取无特定病原体(specific pathogen free,SPF)级BALB/c品系健康幼鼠120只,体重174~230 g,平均(201.32±20.56) g,由广州四和生物科技有限公司提供,实验动物生产许可证号:44007200101674,使用许可证号:SCXK(粤)2016-0041,采用随机数字表将实验动物随机分为对照组和动员组,每组60只。 对照组雄性20只,雌性40只,平均体重(201.18±21.21) g;动员组雄性27只,雌性33只,平均体重 (202.76±22.05) g。两组性别、体重比较差异无统计学意义(P>0.05),具有可比性。实验开展前,幼鼠均饲养1周(饲养温度设置为21 ℃),自由进食和饮水。饲养观察1周无异常后进行实验,实验期间无幼鼠死亡。本实验获得广西医科大学动物实验中心伦理委员会批准。
1.2 实验主要仪器及试剂苏州安泰洁净工作台(SW-CJ-IFD),低速离心机(中佳,SC3614),倒置光学显微镜(OLYMPUS CKX41, U-CTR30-2),倒置荧光显微镜(生产商:Leica,型号:DMI6000B)、台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,TGL-16)、分光光度计(厂家:上海五久自动化设备有限公司,UV-2100PC型)、核酸蛋白测定仪(厂家:德国eppendorf,型号:22331 Hamburg)、ABI7500荧光PCR仪(厂家:美国爱普拜斯/ABI,型号:ABI PRISM7500 Sequence Detection System)、880型酶标仪(德国拜发仪器公司)等。试剂:精制大肠杆菌内毒素脂多糖(美国Sigma公司);重组人粒细胞刺激因子(rhG-CSF,中国医学科学院昆明医学生物研究所,150 μg/支);SP-A、SP-D、AQP5抗体(英国Abcam公司);反转录试剂盒、SYBR Green实时定量PCR试剂盒(美国Sigma公司)。
1.3 实验方法⑴急性肺损伤幼鼠模型[5]建立。予精制大肠杆菌内毒素脂多糖(LPS,美国Sigma公司)5 mg/kg溶于0.5 mL生理盐水后经腹腔注射至幼鼠体内,建立内毒素肺损伤幼鼠模型共120只,全部幼鼠24 h内出现呼吸窘迫、倦怠、蜷缩、对外界刺激敏感,并有泡沫状分泌物(带血性)由鼻腔溢出,不喜欢活动等症状,表明造模成功。随后幼鼠在造模成功24 h后同一时间内动员组给予皮下注射rhG-CSF 30 μg/(kg·d)动员自体骨髓干细胞,对照组注射等容积量生理盐水,均连续注射5天。⑵标本采集。每组幼鼠在干预后5 d、10 d、14 d,腹腔注射3%戊巴比妥钠(1 mg/kg)麻醉并断颈法各处死20只,取部分左肺组织在生理盐水中迅速漂洗干净后,立即放入液氮中冷冻,后转入-70 ℃冰箱中低温保存。⑶标本检测。①HE染色观察组织形态学变化:以IMS图像分析系统测定阳性表达强度,并检测肺组织干预后5 d、10 d、14 d 辐射状肺泡计数(RAC)值;HE染色方法:首先使用石蜡切片脱蜡脱水:依次将切片放入二甲苯Ⅰ20 min→二甲苯Ⅱ20 min→无水乙醇Ⅰ5 min→无水乙醇Ⅱ5 min→75%酒精5 min,自来水洗。然后进行苏木素染色:切片入苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。再以伊红染色:切片依次入85%、95%的梯度酒精脱水各5 min,入伊红染液中染色5 min。而后进行脱水封片:切片依次放入无水乙醇Ⅰ 5 min→无水乙醇Ⅱ 5 min→无水乙醇Ⅲ 5 min→二甲Ⅰ5 min→二甲苯Ⅱ5 min透明,中性树胶封片。最后使用显微镜镜检,图像采集分析,对肺组织损伤情况[6]进行半定量分析,其中1分、2分、3分及4分分别为肺组织正常、细支气管外周附近存在轻度淋巴细胞浸润、细支气管外周附近存在中度中性粒细胞浸润且肺泡内部存在散在浸润、大部分肺泡以及细支气管中均存在重度炎症细胞浸润,进行分析时每张切片均需要观察10个不同位置视野,最终结果为其均值。根据图片中RAC,用SPSS计算RAC均值与方差。②免疫组化法测定肺组织中SP-A、SP-D、AQP5特异性表面标志物水平:小鼠肺组织石蜡切片烤片后脱蜡、脱水后应用3%H2O2置于37 ℃环境下孵育10 min,磷酸缓冲溶液冲洗后进行内源性过氧化物酶灭活处理,添加枸橼酸缓冲液置于高压锅中予以抗原修复处理5 min,置于室温环境下冷却,应用10%山羊血清进行封闭,滴加多克隆抗体SP-A、SP-D、AQP5后置于4 ℃环境下孵育过夜处理,阴性对照则以磷酸缓冲液作为一抗。第2天添加辣根过氧化物酶标记链霉素置于37 ℃环境下孵育,孵育结束后进行DBA染色、苏木精复染、脱水、透明、干燥以及封片,最后置于显微镜下拍片观察,使用image J软件对阳性细胞比例(阳性细胞所占总数的比值)及染色强度(光密度值)进行处理,其结果判读为阳性细胞比例(0~4分)与染色强度(0~3分)乘积,满分0~12分。③逆转录聚合酶链反应(RT-PCR)检测肺组织匀浆SP-A、SP-D、AQP5 mRNA含量平均值变化:采用TRIzol法获得肺组织总RNA,总RNA浓度与纯度采用UV-2100PC型分光光度计测定,cDNA反转录采用反转录试剂盒测定,所有测定均严格按照试剂盒说明书进行操作。SP-A、SP-D、AQP5 mRNA含量采用RT-PCR测定,反应体系按照SYBR Green实时定量PCR试剂盒配置,反应条件为:94 ℃、52 ℃、72 ℃条件下分别变性处理30 s、退火处理30 s、延伸处理30 s,一共处理30个循环,最后在72 ℃条件下延伸处理5 min,最后依据2-(待测样品中目的基因△Ct-参照样品中目的基因△Ct))计算SP-A、SP-D、AQP5 mRNA水平,内参基因选择β-actin,各指标引物见表1。

表1 引物序列
1.4 观察指标干预后5 d、10 d、14 d比较两组小鼠肺部RAC值变化;肺组织中特异性表面标志物SP-A、SP-D、AQP5蛋白表达情况;肺组织匀浆SP-A、SP-D、AQP5 mRNA含量平均值变化。

2 结 果
2.1 HE染色结果模型制备后观察到对照组、动员组肺泡壁溶解,肺泡间隔断裂,对照组干预后5 d、10 d肺脏组织肺泡扩张不良,肺泡内中性粒细胞浸润,部分出现蛋白渗出,肺泡壁增厚,动员组病变与对照组相似,但其中炎症细胞、中性粒细胞较对照组少;干预后14 d,对照组仍存在炎性浸润,蛋白渗出明显,毛细血管扩张充血,肺泡腔仍存在,而动员组炎症细胞少,蛋白渗出程度减轻。半定量肺损伤评分结果显示,对照组评分逐渐增加(P<0.05),动员组干预后10 d与14 d评分均高于干预后5 d(P<0.05),而干预后10 d半定量肺损伤评分与14 d比较无统计学意义(P>0.05);干预后5 d动员组半定量肺损伤评分与对照组比较无差异,而干预后10 d、14 d,动员组半定量肺损伤评分均低于对照组,差异有统计学意义(P<0.05)。见表2与图1。
表2 各组HE染色半定量肺损伤评分结果比较(分,
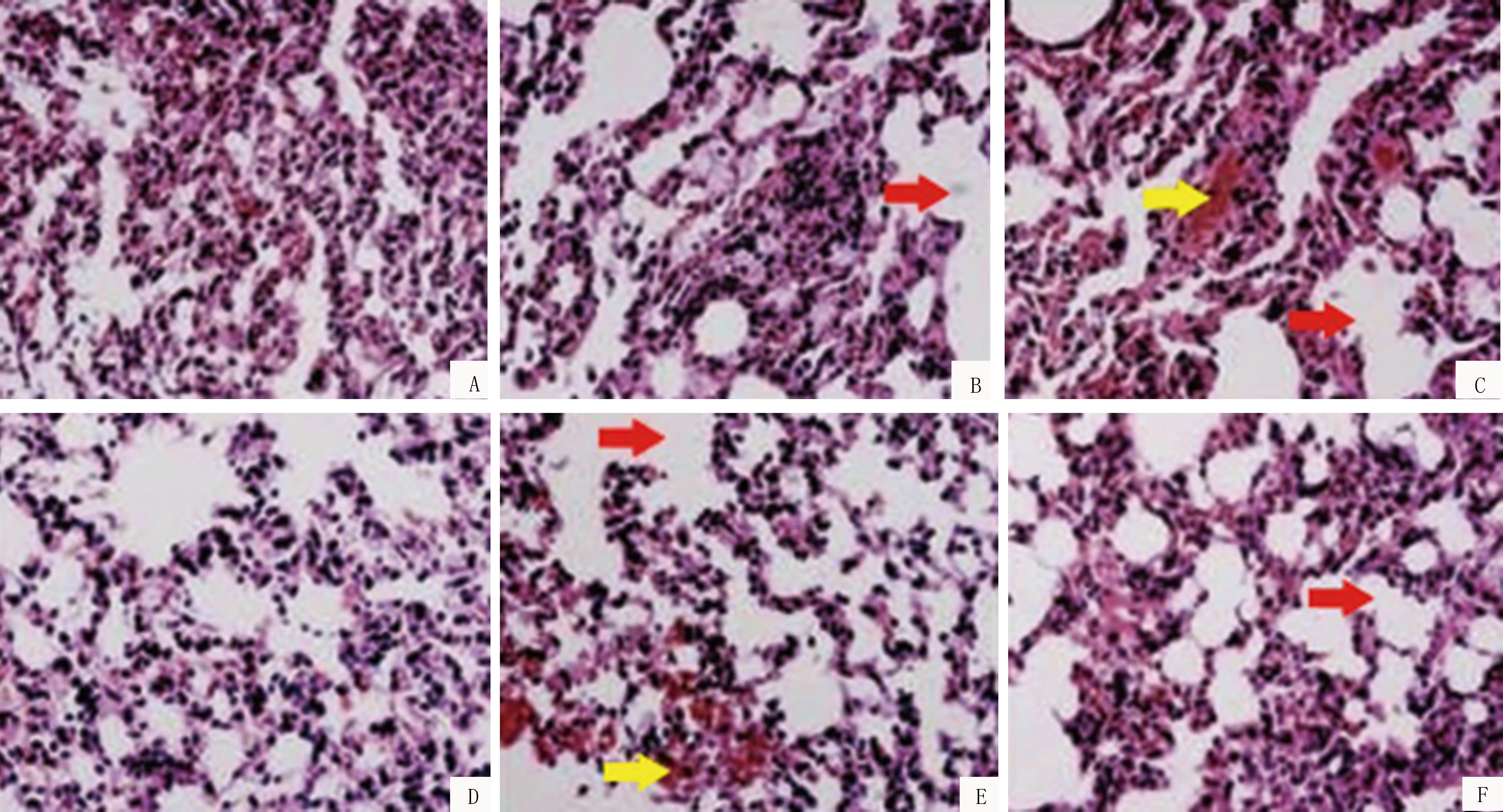
注:红色箭头示肺泡壁溶解,肺泡融合,形成不规则腔,黄色箭头示红细胞渗出及炎症细胞浸润。A、B、C分别为干预后5 d、10 d、14 d对照组HE染色结果(×200);D、E、F分别示干预后5 d、10 d、14 d动员组HE染色结果(×300)图1 两组HE染色病理图片
2.2 干预后RAC值比较干预后5 d、10 d、14 d 动员组RAC值高于对照组,动员组RAC值逐渐变大,差异有统计学意义(P<0.05)。见表3。
表3 干预后RAC值比较(个,
2.3 干预后SP-A、SP-D、AQP5蛋白表达结果免疫组化检测干预后5 d、10 d、14 d肺组织中特异性表面标志物SP-A、SP-D、AQP5蛋白表达情况,对照组干预后5 d、10 d、14 d肺组织中SP-A、SP-D、AQP5蛋白表达无明显变化,动员组干预后5 d、10 d、14 d肺组织中SP-A、SP-D、AQP5蛋白表达逐渐增多,且高于对应时间点的对照组,比较差异有统计学意义(P<0.05)。见表4和图2-图7。
表4 干预后SP-A、SP-D、AQP5蛋白表达结果比较(分,

A:第5天;B:第10天;C:第14天图3 动员组肺组织中特异性表面标志物SP-A表达情况

A:第5天;B:第10天;C:第14天图5 动员组肺组织中特异性表面标志物SP-D表达情况
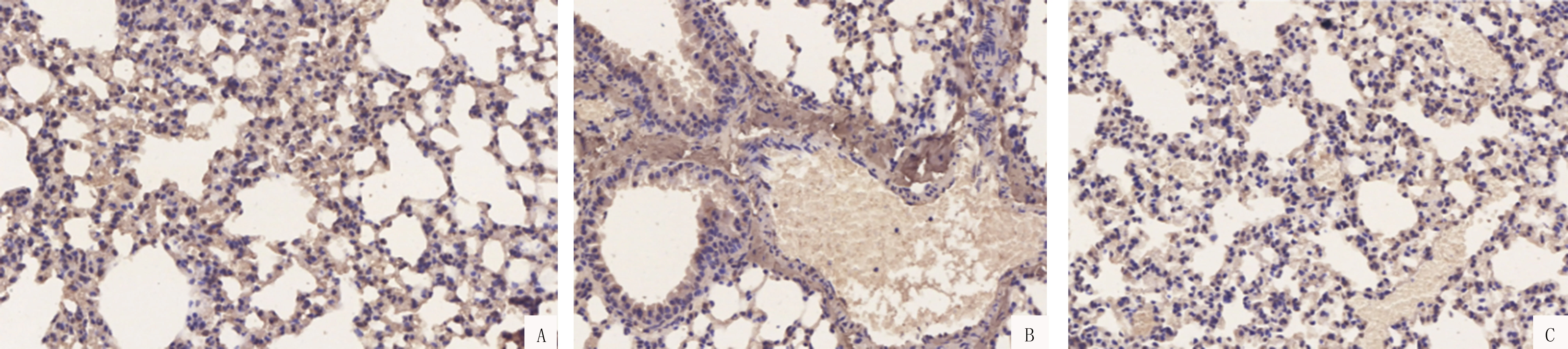
A:第5天;B:第10天;C:第14天图6 对照组肺组织中特异性表面标志物AQP5蛋白表达情况
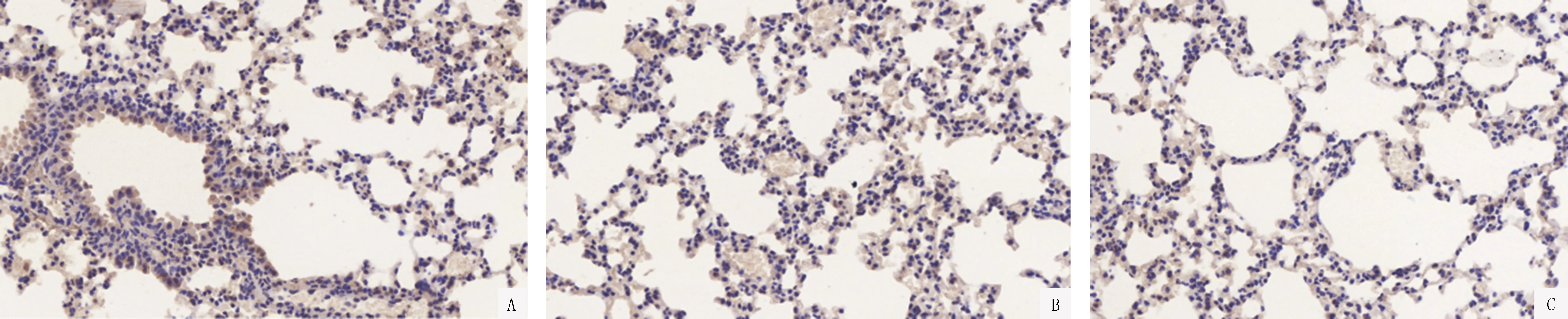
A:第5天;B:第10天;C:第14天图7 动员组肺组织中特异性表面标志物AQP5蛋白表达情况
2.4 干预后相关mRNA含量变化对照组干预后5 d、10 d、14 d SP-A、SP-D、AQP5 mRNA含量无明显变化(P>0.05),动员组干预后5 d、10 d、14 d SP-A、SP-D、AQP5 mRNA表达含量显著升高(P<0.05),且动员组干预后5 d、10 d、14 d SP-A、SP-D、AQP5 mRNA含量高于对照组(P<0.05)。见表5、图8-图10。
表5 干预后相关mRNA含量变化
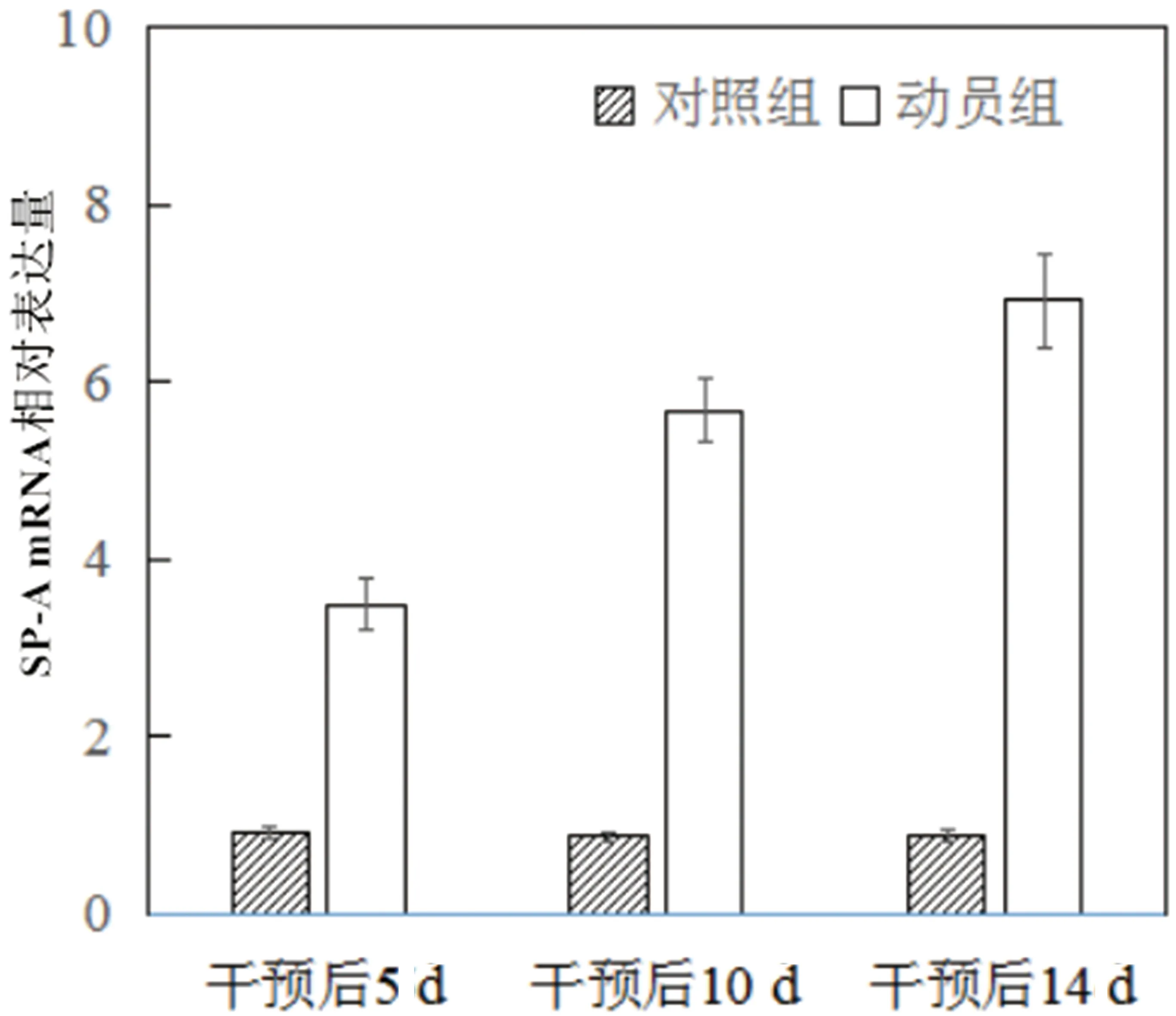
图8 干预后SP-A mRNA相对表达量
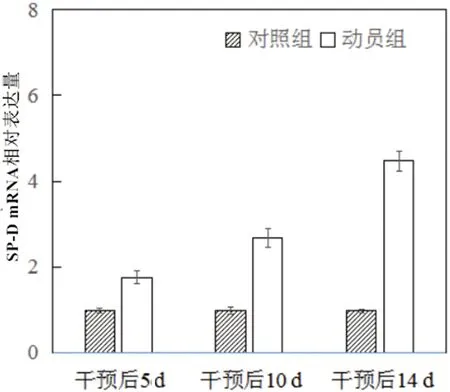
图9 干预后SP-D mRNA相对表达量
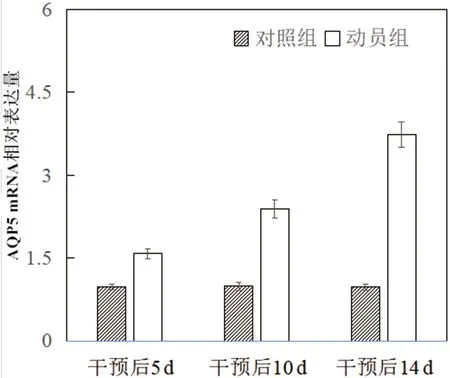
图10 干预后AQP5 mRNA相对表达量
3 讨 论
ALI是儿科常见和潜在的危害极大疾病之一,为由心源性以外的各种肺内外致病因素导致的肺部炎症,可损伤患儿毛细血管内皮,破坏肺泡毛细血管屏障,尽管目前已广泛采用重症监护、机械通气等手段对ALI患儿进行干预,但因ALI确切机制尚未完全阐明,更无有效的防治手段, 其死亡率仍较高[7]。ALI的病理特征主要是肺泡毛细血管壁破裂,随着肺泡中蛋白质渗出,引发肺水肿,最终气体交换障碍而发生呼吸衰竭[8],这种疾病的组织学特征是肺表面活性物质表达减少、肺部严重急性炎症反应、中性粒细胞性肺泡炎[9-10]。骨髓干细胞动员是新兴细胞移植方法,通过利用细胞因子使骨髓中干细胞进入外周血,经血液循环进入损伤组织继而达到细胞移植的目的,是目前ALI治疗的新靶点[11]。
本研究HE染色发现,在建立幼鼠ALI模型后肺泡壁溶解,肺泡间隔断裂,尤其是对照组在干预后5 d、10 d肺脏组织肺泡扩张不良,肺泡内中性粒细胞浸润,部分出现蛋白渗出,肺泡壁增厚,动员组病变与对照组相似,但其中炎症细胞、中性粒细胞较对照组少,至干预后14 d对照组仍有炎性浸润,蛋白渗出较明显,而动员组炎症细胞少,蛋白渗出程度轻。干预后5 d、10 d、14 d,动员组半定量肺损伤评分均低于对照组,动员组RAC值高于对照组,表明采用LPS成功建立ALI模型,而经皮下注射rhG-CSF进行骨髓干细胞动员后可较好改善幼鼠ALI症状,减少炎症细胞浸润,这与宋静等人[12]的研究结论相符。肺泡上皮细胞、血管内皮细胞损伤为ALI的主要特点,肺泡上皮仅有两种类型的上皮细胞,即肺泡Ⅰ型上皮细胞(AEC-Ⅰ)、肺泡Ⅱ型上皮细胞(AEC-Ⅱ),AEC-Ⅱ是肺泡上皮干细胞, 有合成并分泌磷脂及蛋白质组成的肺表面活性物质(pulmonary surfactant,PS)作用,而PS具有降低肺泡表面张力和维持气道内液体平衡等重要生理作用,维持着肺呼吸功能及非呼吸功能,其中SP-A、SP-D具备肺局部先天性免疫功能,可凝聚病原微生物,对免疫细胞有趋化作用及调理吞噬作用[13]。水通道蛋白5(AQP5)则主要分布在下呼吸道,可维持肺泡腔中相对干燥的环境,保证机体有效进行气体交换,相关研究证实APQ5表达下调会造成肺间质及肺泡内水转运障碍,继而加重肺泡腔、肺间质水肿[14]。本次免疫组化法显示动员组干预后5 d、10 d、14 d肺组织中SP-A、SP-D、AQP5蛋白表达增多,且高于对照组,而RT-PCR检测发现动员组干预后5 d、10 d、14 d SP-A、SP-D、AQP5 mRNA含量显著高于对照组,这与宋静等人[15]的研究基本一致,表明干细胞动员有助于促进ALI幼鼠肺表面活性蛋白SP-A、SP-D、AQP5的表达,骨髓充质间干细胞经血液循环在肺内定植,且易于迅速扩增,并向肺上皮细胞、内皮细胞分化,短期内便能得到治疗所需细胞量,从而参与急性肺损伤修复。rhG-CSF为近年来发现的有力动员剂,在一定条件下可使骨髓间充质干细胞转化为Ⅰ型和Ⅱ型肺泡上皮细胞、内皮细胞、成纤维细胞及支气管上皮细胞[16],此外rhG-CSF对新生大鼠肺组织巨噬细胞的终末分化起着关键作用,采用rhG-CSF持续治疗能有效保持巨噬细胞功能,减少炎症细胞因子浸润,使肺水肿、胶原沉积、肺纤维化减轻,并激发修复的生长因子生长,抑制肺泡壁细胞凋亡,从而对ALI起到较好的治疗作用[17]。本研究中干预后5 d、10 d、14 d动员组SP-A、SP-D、AQP5蛋白与mRNA水平持续上升,提示干细胞动员可发挥持续肺损伤修复作用,但研究亦发现动员组干预后10 d、14 d半定量肺损伤评分均高于干预后5 d,而干预后10 d肺损伤评分与14 d比较没有统计学意义。原因可能为造模成功后LPS对肺组织损伤明显,即使注射了rhG-CSF进行骨髓干细胞动员,因肺组织SP-A、SP-D、AQP5 mRNA含量及SP-A、SP-D、AQP5蛋白表达有限,但仍导致肺组织修复速度可能小于肺损伤速度。同时观察到动员组干预10 d之后,SP-A、SP-D、AQP5蛋白多量表达,使其对于肺组织损伤修复速度可能较对照组高。
综上所述,干细胞动员能较好促进ALI模型幼鼠肺泡表面活性蛋白(SP-A、SP-D、AQP5)再生,促进肺功能恢复,这为ALI患儿开展干细胞动员救治提供了理论依据。
