S1P与T淋巴细胞在主要免疫器官间迁移的关系
2023-02-12李怡珂张伟卫轩小燕张志坚雷宁静
李怡珂,张伟卫,王 鹏,轩小燕,杜 英,张志坚,雷宁静
1)郑州大学基础医学院微生物与免疫学系 郑州 450001 2)郑州大学附属郑州中心医院检验科 郑州450007 3)郑州大学第一附属医院心外科 郑州 450052
免疫应答由多种免疫细胞和免疫分子共同参与,受多种相关分子和细胞信号精确调控[1]。T细胞通过血液和淋巴循环在各个免疫器官之间迁移,在维持人体正常生理稳态及疾病发生发展过程中发挥重要作用[2]。T细胞在发育分化、成熟定居、活化和发挥效应等过程中,需要经历从骨髓到胸腺,从胸腺到淋巴结和脾脏等外周免疫器官,以及再循环等多次迁移。血管和淋巴管是T细胞迁移的通道[3-4],其中血管迁移机制已有较多的研究,但淋巴管运输的相关研究尚少。在过去几十年里,一些新兴技术如双光子显微技术和活体显微成像技术使我们对淋巴管内皮细胞的超微结构和淋巴细胞迁移有了新的认识[5]。Rodriguez等[6]研究发现淋巴管内皮细胞可以调节黏附分子和趋化因子的表达,以满足生理稳态和炎症状态下不同亚群细胞进入的要求。T细胞的迁移受到多种分子的调控,鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)及其受体鞘氨醇-1-磷酸受体(S1P receptor,S1PR)备受关注[7]。本文将讨论S1P参与T细胞进出主要免疫器官如淋巴结、胸腺、脾脏的机制,为相关疾病的研究提供参考。
1 S1P与T细胞迁移
S1P是一种脂质生物活性分子,主要来源于血液中的红细胞,其次是内皮细胞,如淋巴液中的S1P主要由淋巴管内皮细胞提供[8]。S1P在细胞内由鞘氨醇激酶1和2合成,可以被S1P裂解酶、S1P磷酸酶1和S1P磷酸酶2降解,也可由S1P转运蛋白2(spinster homolog 2,SPNS2)转运到细胞外;在细胞外,S1P由5个G蛋白偶联受体S1PR1~5识别,调节细胞生长、分化等多种生物学过程,可以被三种磷酸酶降解[7]。生理条件下,受这些酶的精密调节,S1P浓度在细胞内液和间质液中较低,而在血液和淋巴液中较高,从而产生陡峭的S1P梯度[9]。研究[10]表明,淋巴细胞表面的S1PR1可引导淋巴细胞从低浓度S1P环境(组织)进入到高浓度S1P环境(血液和淋巴液)。血液和淋巴液中高浓度的S1P可以帮助稳定脉管系统的稳定性,并招募淋巴细胞通过S1P浓度梯度差进行迁移,调控免疫反应。因此,抑制鞘氨醇激酶1/2或S1P裂解酶、破坏 S1P梯度,可影响淋巴细胞的组织迁出,影响疾病进展[11-12]。
S1P/S1PR信号轴不仅参与多种生理过程,包括细胞的增殖、存活、侵袭、黏附和迁移[13-14],也介导多种病理生理过程,在炎症和癌症进展中起着重要作用。例如,S1P结合其受体S1PR1可以激活STAT3磷酸化,促进慢性炎症的发生发展[15]。鞘氨醇激酶1和S1P可诱导慢性炎症细胞内环氧化酶2的产生,进而抑制抗肿瘤免疫反应,这可能是慢性炎症发展为肿瘤的关键因素[16]。在免疫应答期间,CCL21-CCR7可拮抗S1P介导的T细胞迁移,使T细胞滞留在外周直到炎症消退[17]。通过构建T细胞穿越小鼠淋巴管内皮细胞模型,研究者观察到S1P刺激可以增加淋巴管内皮细胞的通透性,上调T细胞与内皮细胞间黏附蛋白的表达,S1P/S1PR信号轴可调控CD4+T细胞向初始淋巴管的迁移[18]。因此,靶向S1P/S1PR信号轴可能是一种很有前途的疾病治疗方法。美国食品和药物管理局于2010年就已经批准靶向S1P的药物 Fingolimod应用于多发性硬化症的治疗,它作用于S1PR1,阻止淋巴细胞从淋巴结迁出,导致循环中自身反应性淋巴细胞减少,进而减缓疾病进展[19]。利用鞘氨醇激酶1的特异性抑制剂 SK1-I可以降低S1P水平,可以阻碍血管和淋巴管生成,减少T细胞迁移的通道,从而减少乳腺癌模型小鼠原位肿瘤的大小和淋巴转移[20]。S1PR依赖的自身反应性免疫细胞向靶器官转运是许多自身免疫性疾病的共同特征。靶向S1P/S1PR信号轴的药物也在其他自身免疫性疾病中显示出疗效,如银屑病、炎症性肠病、系统性红斑狼疮、类风湿关节炎等[21]。
2 S1P与T细胞在主要免疫器官中的迁移
2.1 S1P与T细胞的淋巴结迁移正常淋巴结中,输入淋巴管经被膜下淋巴窦进入淋巴结,分支于副皮质区、髓质区淋巴窦内,后于淋巴结门处汇集为输出淋巴管出淋巴结[22]。经典插管研究[23]表明,正常输入淋巴管中的主要细胞群是T细胞(80%~90%),且CD4+T细胞数量是CD8+T细胞的6倍,其次是树突状细胞和极少量的B细胞、粒细胞。其中,大多数T细胞是有过抗原提呈的CD4+CD45RO+效应记忆T细胞,被重新定义为循环记忆T细胞,参与同源抗原的免疫监视,并在淋巴结中调节免疫记忆反应[24]。
T细胞进入淋巴结有两种途径。一种是通过高内皮静脉(high endothelial venule,HEV)进入,该过程包含多个步骤,涉及多种细胞因子及整合素相互作用,精确调节T细胞的黏附、滚动、迁移[25-26]。 T细胞也可以通过输入淋巴管进入淋巴结。有研究[27]发现,将初始T细胞通过输入淋巴管注射到小鼠腘窝淋巴结后,这些细胞不仅出现在腘窝淋巴结的T细胞区,也在下游淋巴结如髂内侧淋巴结的T细胞区被发现;说明初始T细胞可以通过淋巴管从一个淋巴结迁移到另一个淋巴结。尽管大多数初始T细胞通过HEV进入淋巴结,但一些初始T细胞也可能通过输出淋巴管离开淋巴结,进入循环系统后通过输入淋巴管进入下游淋巴结。
S1P/S1PR信号轴参与调节T细胞穿越淋巴管内皮细胞,迁出淋巴结的过程[28]。该过程是通过影响T 细胞与淋巴管内皮细胞的相互作用,启动T细胞的跨淋巴管内皮细胞迁移(trans-lymphatic endothelial migration,TEM),而这种迁移并不能被S1PR 拮抗剂所逆转[29]。有报道[30],T细胞表面的S1PR1表达上调将促进CD4+T细胞的TEM,而S1PR1表达下调则抑制该过程。也有研究[31]表明,抑制S1PR2可调节VCAM-1和VE-cadherin的表达,以及内皮细胞间纽扣连接和拉链连接的密度和分布,进而影响CD4+T细胞的TEM。同时,淋巴管内皮细胞可以分泌S1P,激活T细胞表面的S1PR1,引起淋巴结中T细胞的迁出[17,28,32]。除此之外,细胞外基质成分tenascin-C可与淋巴管内皮细胞上的整合素α9β1结合介导S1P产生,说明整合素α9与S1P介导T细胞迁移之间存在直接联系[33]。使用抗体阻断整合素α9或tenascin-C缺陷均可导致T细胞从炎症淋巴结的迁出障碍。
T细胞在淋巴结中的滞留也受到S1P/S1PR信号轴的影响。例如G蛋白偶联受体(尤其是CCR7)可以促进T细胞的淋巴结滞留,但是S1P/S1PR信号轴可以拮抗该作用[34]。也有研究[35]表明,作为S1P重要的转运蛋白,当SPNS2缺失时,小鼠的T细胞将不能迁出淋巴结,导致炎症部位T细胞的减少甚至免疫反应的缺失。
图1显示了S1P影响T细胞淋巴结迁移的主要过程。局部炎症和损伤激活初始淋巴管的内皮细胞,上调黏附分子ICAM-1及趋化因子CCL21的表达。活化的树突状细胞通过上调CCR7受体与内环境中CCL21的相互作用进入输入淋巴管,在淋巴结中激活初始T细胞,激活免疫反应。淋巴管内皮细胞释放的CCL21和S1P调控T细胞的淋巴结迁移,使其到达炎症部位,参与免疫反应。
2.2 S1P与T细胞在胸腺的发育及迁移胸腺是T细胞发育成熟的场所,S1P/S1PR信号轴是影响T细胞胸腺迁移的最主要机制[12,36-37]。来自骨髓的前体细胞在胸腺皮质中经历CD4-CD8-阶段,包括DN1-DN4。经历TCR基因重组进一步发育为CD4+CD8+细胞,经过阳性选择和阴性选择发育为成熟T细胞。在皮髓交界处,成熟T细胞在S1P浓度梯度引导下进入血管,迁出胸腺[9,38](图2)。
研究[7]表明,胸腺微环境中S1P的生成、降解及去磷酸化,对维持胸腺内S1P浓度梯度至关重要。S1P主要由胸腺周细胞产生,胸腺周细胞表达鞘氨醇激酶1/2,催化ATP依赖的鞘氨醇磷酸化生成S1P。胸腺周细胞鞘氨醇激酶的条件性缺失将使S1P合成受阻,导致胸腺微环境中S1P浓度梯度被破坏,成熟胸腺细胞迁出受阻从而滞留于胸腺,同时外周T细胞减少[39]。其他胸腺基质细胞,例如胸腺内皮细胞,通过表达SPNS2调节S1P水平,SPNS2的缺失也将导致成熟T细胞迁出障碍[40]。内皮细胞也表达S1P裂解酶,以维持胸腺内较低水平的S1P[41]。S1P裂解酶的药理学抑制或遗传破坏将导致胸腺组织中S1P水平升高约1 000倍,破坏T细胞迁出胸腺部位S1P的浓度梯度,进而阻碍T细胞迁出胸腺[42]。胸腺上皮细胞表达3种磷酸酯酶(lipid phosphate phosphatases,LPP),可通过去磷酸化降解S1P,维持胸腺出口处低水平的S1P,从而促进T细胞的迁出[43],而编码LPP3的Ppa2b基因缺失会导致成熟T细胞胸腺迁出障碍[43]。其他影响S1P合成或分解的酶也会影响T细胞的胸腺迁出。神经酰胺合酶2[44]被报道可调节鞘氨醇表达水平,神经酰胺合酶2全身缺陷小鼠胸腺内成熟T细胞积聚,而血液和脾脏中CD4+和CD8+T细胞减少。
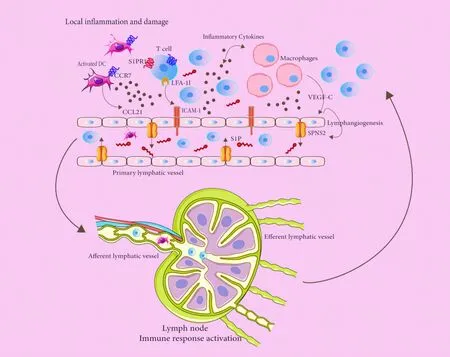
图1 炎症状态下S1P影响T细胞淋巴结迁移的主要过程
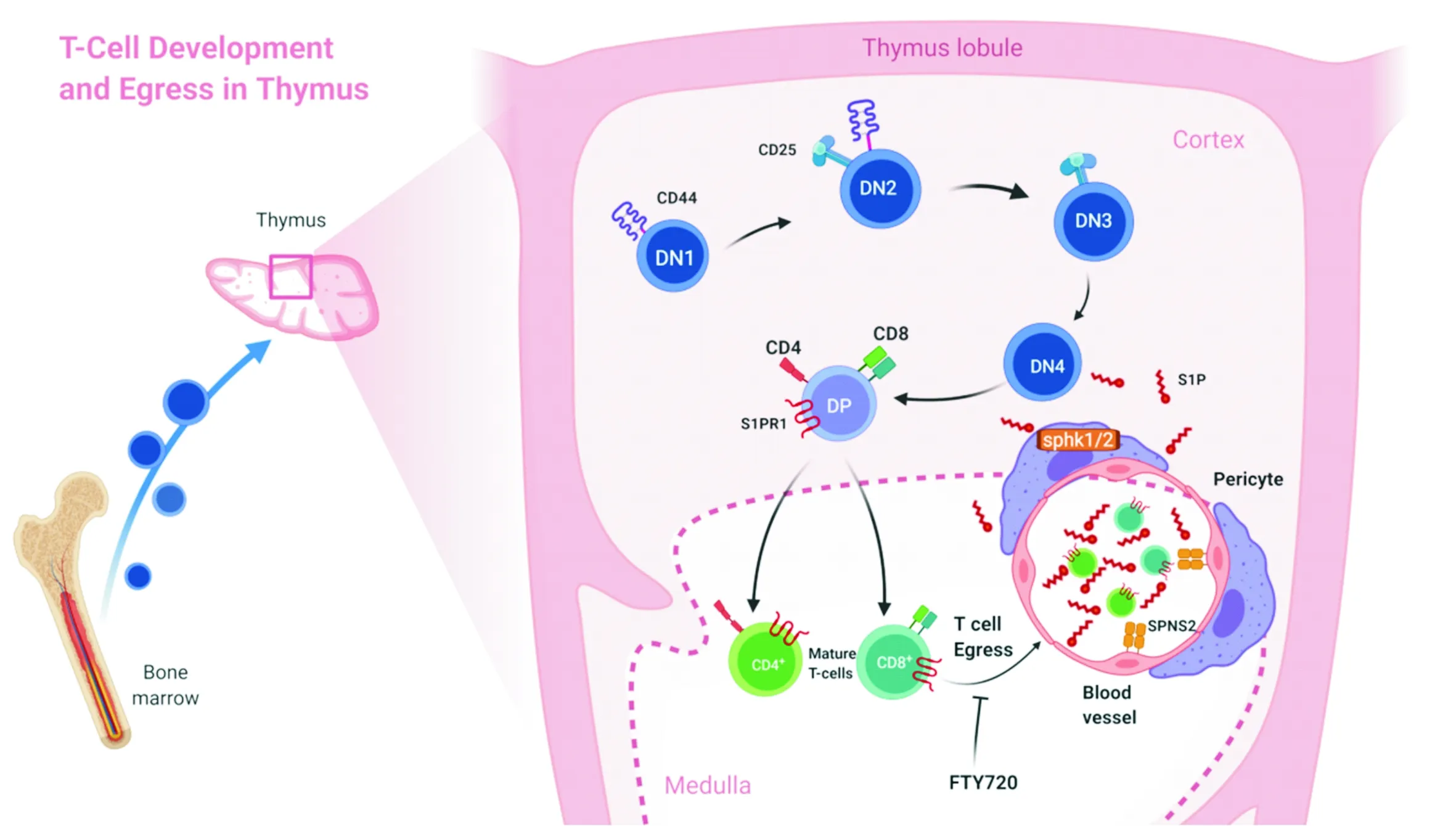
图2 S1P调控T细胞在胸腺的发育及迁出
2.3 S1P与T细胞经脾脏的迁移脾脏是人体最大的外周免疫器官,主要包含在小动脉周围形成的富含淋巴细胞的白髓,以及富含巨噬细胞和红细胞的红髓。脾脏白髓解剖结构与淋巴结相似,中央T区富含T细胞和树突状细胞,边缘滤泡富含B细胞。滤泡表面大部分被边缘窦的网状结构所覆盖,但也有T区在滤泡之间延伸,并与红髓直接接触,称为边缘区[45]。T细胞从末梢小动脉释放后,以G偶联蛋白受体依赖的方式迁移到脾白髓,在边缘窦释放后,通过富含CCL21的成纤维网状细胞进入T区[46]。脾脏的主要功能是净化血液,因此细胞进入和离开脾脏的主要通道是血流。尽管如此,S1P对于T细胞在脾脏中的迁移也具有重要作用,特别是其促进淋巴细胞从白髓到红髓的迁出及再循环已被广泛研究[47](图3)。T细胞在脾脏内的迁移受S1P/S1PR信号轴调控。脾脏内的初始T细胞高表达S1PR1,红髓和白髓中S1P浓度较边缘区更低。有研究[48]表明,在S1P及CXCL12的诱导趋化下,表达S1PR1及CXCR4的T细胞随血液向红髓迁移;而经过免疫调节剂FTY720治疗后,将抑制这一过程,使T细胞阻滞于脾脏白髓中,并导致脾脏T细胞迁出减少。同时,T细胞从脾脏迁出的过程也受S1P浓度梯度的影响。有研究[49]表明,给鞘氨醇激酶缺陷小鼠静脉注射野生型红细胞可以恢复血液中S1P水平,但淋巴液中仍缺乏S1P,这将导致脾脏中的T细胞数量低于淋巴结,可能由于T细胞受血液中S1P调控迁出脾脏,但淋巴液中S1P的缺乏会阻碍其从淋巴结的迁出过程。
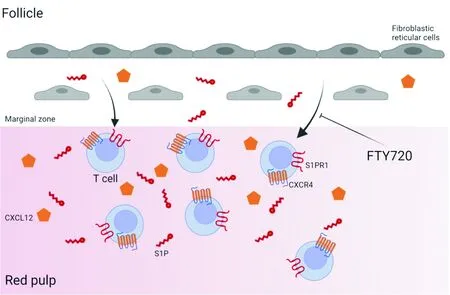
图3 S1P及CXCL12的诱导趋化影响脾脏T细胞向红髓的迁移
3 展望
T细胞在不同免疫器官中的迁移受到多种因子的调节,其中S1P的影响尤为重要。T细胞的迁移可能与某些疾病进展有关,对S1P合成分解关键酶的调控可能成为治疗的靶点。例如,S1PR4缺陷抑制CD8+T细胞的增殖和迁移,可以抑制乳腺癌和结肠癌患者肿瘤生长及化疗耐药[50];动物实验中,使用S1PR调节剂可以调节淋巴细胞迁移,改善溃疡性结肠炎[51]。研究炎症条件与肿瘤微环境中T细胞迁移及调控的机制具有重要意义,值得进一步探讨。