苏醒室入室低体温胸腔镜患者围术期特征的回顾性分析
2023-02-11陈罡覃梦洁徐文青刘尚昆郑华余遥杜丹丹
陈罡,覃梦洁,徐文青,刘尚昆,郑华,余遥,杜丹丹
(1.华中科技大学同济医学院附属同济医院 麻醉学教研室,湖北 武汉 430030;2.武汉轻工大学 医学技术与护理学院,湖北 武汉 430023)
低体温是指人体核心温度<36℃[1]。麻醉、手术、环境等因素,常导致患者体温调节变化,从而引起苏醒室入室低体温。它可延长麻醉药物作用时间,引发苏醒延迟、寒战、凝血功能障碍和心血管事件等[2]并发症,甚至导致不良结局。一项多中心研究[3]显示,有53.5%的患者在入苏醒室时出现低体温症状。随着围术期体温管理进一步规范以及手术技术进步,术后苏醒室入室低体温的发生率越来越受到重视,已纳入麻醉专业质量控制指标[4]。目前,研究多关注苏醒室低体温危险因素的调查,而关注苏醒室低体温预后特征的研究较少。有研究[5]显示,胸腔镜手术围术期低体温发生率高达72.7%,高于其他手术,具有很强的临床研究意义。因此,本研究通过回顾性研究,针对苏醒室入室低体温胸腔镜患者的术前及术中相关因素调查,并探讨其术后相关特征,以期制定相关管理措施提供参考。
1 对象与方法
1.1 研究对象 采取便利抽样法选择2019年11月至2021年5月某院实施胸腔镜肺叶手术患者为研究对象,回顾分析其临床资料。纳入标准:(1)美国麻醉医师协会 (American Society of Aneshesiologists,ASA)分级Ⅰ~Ⅲ级;(2)年龄18~80岁;(3)全身麻醉下手术后进入苏醒室的患者;(4)术前未服用调节体温药物;(5)术中患者使用核心温度监测;(6)接受主动保温措施,即静脉液体置入38℃恒温箱内,冲洗液加温37~40℃,术中使用温毯机进行保温。排除标准:(1)资料不完整;(2)术前出现感染;(3)患有甲状腺疾病或雷诺综合征。本研究经医院伦理委员会批准(TJ-IRB20210749)。基于文献[6]学习、专家共识[7],筛选预测因子(共15个)纳入研究,以发生苏醒室入室低体温的85例患者为病例组,未发生的115例患者为对照组。以二分类Logistic回归估算样本量,考虑到10%~20%的样本资料不完整不符合要求,根据样本量计算公式[8],本研究所需的最少样本量为185例,通过SPSS程序进行随机抽样,最终入组200例。
1.2 方法
1.2.1 调查内容 由研究人员调取麻醉临床信息系统及护理子系统、住院医生站电子病历系统,记录相关信息,包括一般人口学资料、围术期信息、术后信息3个部分。患者一般人口学资料包括年龄、体重、身高、性别。围术期信息包括麻醉类型、麻醉时长、ASA分级、入室核心体温、液体总入量、入苏醒室时间、准备时间、手术结束至苏醒室时间、术前血糖、血红蛋白、白蛋白等。术后信息包括住院总天数、苏醒室停留时间、肾功能(尿素氮、肌酐)、尿量、凝血功能等。
1.2.2 评价方法 入手术室后使用Pro4000耳温计(B.Braun公司,德国)测量核心体温。入苏醒室测量体温是麻醉临床信息系统每隔5 min收集1次鼻咽温度数据,确定入苏醒室5 min内所有记录均低于36℃定义为低体温,以排除设备问题或体温探头意外移位等因素引起“假”体温过低。准备时间:患者进入手术室到手术切口开始的时间。苏醒室停留时间:患者进出苏醒室所需的时间。入苏醒室时间:从8:00至15:59进入苏醒室为早班入苏醒室,从16:00点至22:00进入苏醒室为中班入苏醒室。手术结束至入苏醒室时间:患者手术结束到苏醒室所需时间。凝血功能包括参加凝血启动过程的凝血因子的综合作用的反应时间(R);血凝块形成的速率(K),其中以纤维蛋白的功能为主;血凝块的最大强度(MA),主要受血小板及纤维蛋白2个因素的影响,其中血小板的作用占80%。
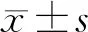
2 结果
2.1 两组患者的一般资料 200例患者中,85例(42.5%)发生苏醒室低体温,其中男36例、女49例;年龄25~72岁。对照组115例,男52例、女63例;年龄23~75岁。两组患者在年龄、体质量指数(body mass index,BMI)、麻醉类型、麻醉时长、入室核心体温、准备时间等项目上差异均有统计学意义(均P<0.05),见表1。
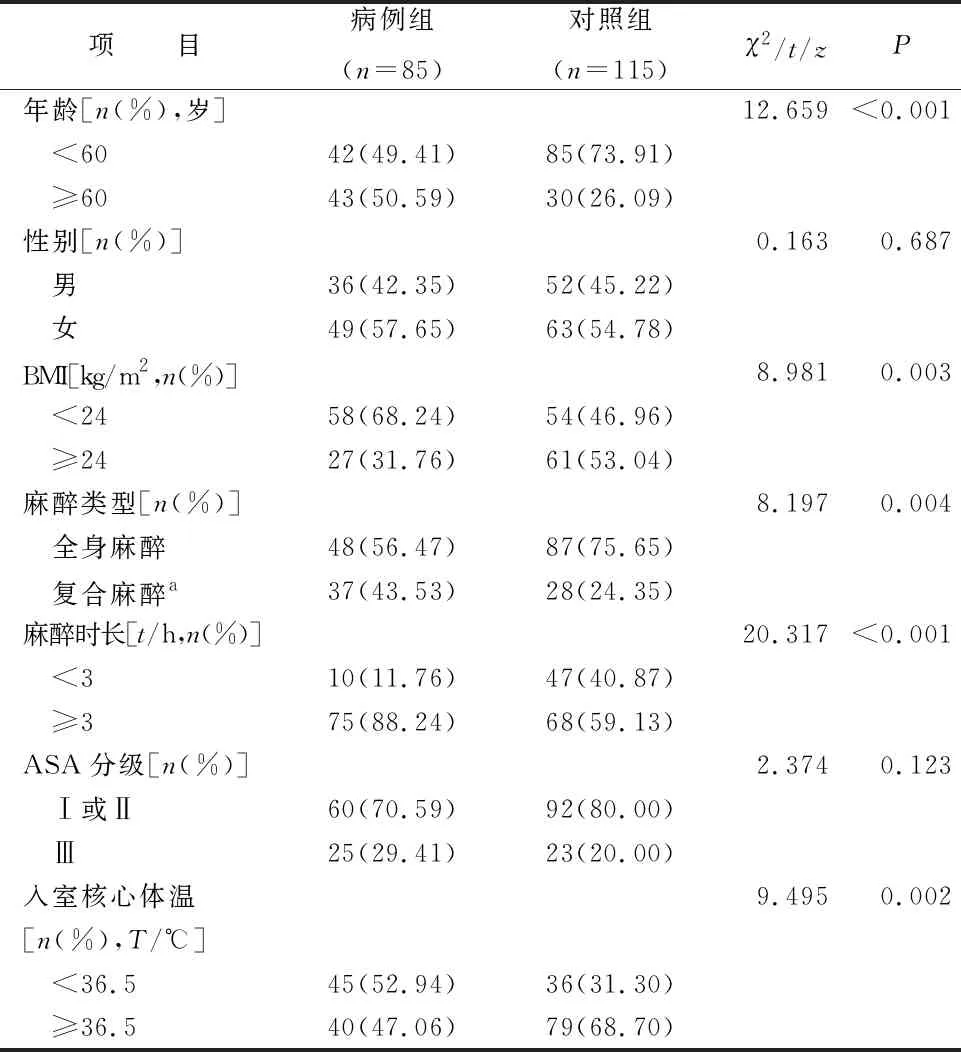
表1 两组患者的一般资料和临床特征比较(N=200)

续表1
2.2 苏醒室低体温患者术前及手术特征的多因素分析 以是否发生苏醒室低体温为因变量,将单因素分析有统计学意义的项目为自变量进行Logistic回归分析。结果显示,年龄、BMI、麻醉类型、麻醉时长、入室核心体温、准备时间、入苏醒室时间、手术结束至苏醒室时间是胸腔镜手术患者苏醒室低体温的独立影响因子,8个变量共解释了苏醒室低体温总变异的54.5%。年龄、中班入苏醒室、复合麻醉、麻醉时长、准备时间、手术结束至苏醒室时间是手术患者发生苏醒室低体温的危险因素;BMI、入室核心体温是其保护因素(均P<0.05),见表2。

表2 苏醒室低体温的多因素分析
2.3 两组患者术后相关指标的比较 病例组患者苏醒室停留时间、住院天数、尿量及凝血功能与对照组比较,差异均有统计学意义(均P<0.01),见表3。

表3 两组患者术后相关指标的比较[M(P25,P75)]
3 讨论
3.1 胸腔镜手术患者入苏醒室低体温的保护因素 本研究显示,BMI≥24 kg/m2是胸腔镜手术患者入苏醒室低体温的保护因素。在超重患者中,当核心温度降低时,体脂较多的患者更容易触发血管收缩,以减少热量向外周组织传导,从而保持机体热量平衡[9],故相对而言体脂较少的患者在术后更容易发生低体温。入手术室核心体温≥36.5℃亦是胸腔镜手术患者入苏醒室低体温的保护因素。术前核心体温较高的患者,其核心与外周的温差变小,减少了核心热量的传导,降低了低体温的发生率。有研究[3]显示,麻醉开始阶段,体温下降超过0.5℃会使进入苏醒室时体温<36℃的风险加倍。
3.2 胸腔镜手术患者入苏醒室低体温的危险因素 本研究显示,年龄≥60岁、麻醉时长≥3 h、准备时间≥1 h、复合麻醉、中班入苏醒室、手术结束至入苏醒室时间≥20 min是导致苏醒室低体温的独立危险因素。年龄较高的患者生理储备降低,对寒冷的承受能力较差,在全身麻醉下老年患者的体温调节血管收缩阈值降低,极易发生低体温[10]。麻醉状态下,麻醉药物会降低患者基础代谢率[11],抑制患者体温调节中枢[12],从而导致核心体温向外周传导,麻醉时间越长,患者入苏醒室低体温发生率越高[13]。面对陌生环境及术前的焦虑、恐惧心理,促使患者交感神经兴奋[14],收缩血管,术前体温会降低,所以手术前的准备时间越长,苏醒期低体温的发生率会越高。全身麻醉和神经阻滞均会损害体温调节[15],椎旁神经阻滞阻滞同侧交感神经,既干扰了温度感受器,也抑制了同侧交感神经支配区域的温度调节,造成了复合麻醉中麻醉苏醒室低体温的发生率是全身麻醉患者的3.8倍。中班入苏醒室的患者苏醒室低体温发生的风险是早班入苏醒室的4.9倍,可能与患者手术开始时间比较晚,禁饮、禁食时间比较长有关。手术结束后至入苏醒室的时间间隔越长,越容易发生苏醒室入室低体温,这意味着这段时间有使患者降温的风险,可能与手术结束后停止了主动加温,并且大多数患者在手术结束时给予了抑制体温调节作用的药物,如镇痛药。
3.3 胸腔镜手术患者入苏醒室低体温的术后特征 在单因素分析中,苏醒室入室低体温的胸腔镜患者苏醒室停留时间、住院时间均较苏醒室正常体温患者更长。这提示患者低体温会影响麻醉药品在机体内的代谢,对患者预后和治疗效果产生严重影响[16],与本研究结果相似,即住院时间和苏醒室停留时间均延长。有研究[17]显示,肾脏是储备代偿能力很强大的器官,其中肾小球损害低于60%时,肌酐、尿素氮都不会有明显变化,与本研究结果一致。本研究中,低体温组患者的尿量显著减少,这可能与低体温组中,患者肾小动脉收缩导致尿量减少有关。随着温度降低,检测参数R值、K 值逐渐变大,MA 值逐渐降低。究其原因是低体温会引起患者体内凝血因子活性的减弱,引起血小板功能受到抑制,纤维蛋白原作用减弱因而导致凝血酶生成不足,并导致其功能的减弱,使患者凝血功能下降[18]。
4 小结
年龄≥60岁、BMI≥24 kg/m2、复合麻醉、麻醉时长≥3 h、入室核心体温≥36.5℃、准备时间≥1 h、中班入苏醒室、手术结束至苏醒室时间≥20 min是胸腔镜患者苏醒室低体温发生的独立危险因素。在术后特征中,苏醒室低体温胸腔镜患者更容易发生苏醒室停留时间、住院天数的增加,并伴有术后尿量减少,凝血功能降低等病情变化。临床护理人员应识别患者危险因素,采取相应措施以预防胸腔镜肺叶手术患者苏醒室低体温的发生,同时关注苏醒室低体温胸腔镜肺叶手术患者术后病情变化的风险,积极观察患者病情,及时发现、有效处理病情变化,提高麻醉护理质量及患者的满意度。本研究纳入的样本量较小,研究病种比较单一且为单中心的回顾性调查,因此所得到的结论存在一定的局限性,有待进一步临床研究。
