积雪草苷调控基质金属蛋白酶-9减轻川崎病血管损伤的机制研究
2023-02-11杨劲威曹媛
杨劲威,曹媛
宝鸡市人民医院儿科1、药学部2,陕西 宝鸡 721000
川崎病常发生于婴幼儿时期,可继发成年后的心血管疾病。目前川崎病的发病机制尚未明确,血管内皮细胞呈现炎性细胞浸润、坏死等从而阻碍细胞功能进而促进促炎因子等分泌,这一系列反应在动脉粥样硬化发生及发展过程中可发挥重要作用[1-2]。中医药成分具有减缓川崎病发展进程的作用[3-4]。积雪草苷是积雪草的提取物,研究表明积雪草苷可抑制炎症因子分泌从而发挥抗肺纤维化作用[5]。但积雪草苷与川崎病相关性研究尚未见报道。基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)在川崎病中表达水平升高,并可能促进川崎病发生及发展[6]。因此,本研究采用肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导人冠状动脉血管内皮细胞建立川崎病血管损伤模型,探讨积雪草苷是否可通过调控MMP-9表达而影响川崎病血管损伤。
1 材料与方法
1.1 材料与试剂 南京广润生物制品有限公司提供积雪草苷(纯度≥98%);江苏普诺生生物科技有限公司提供人冠状动脉血管内皮细胞;美国Invitrogen公司提供Lipofectamine2000;美国Thermo Fisher公司提供Trizol试剂;北京天根生化科技有限公司提供反转录试剂盒、SYBR Green试剂盒;苏州派普泰克生物科技有限公司提供TNF-α;上海吉玛制药技术有限公司提供pcDNA、pcDNA-MMP-9;北京索莱宝提供CCK-8试剂、细胞凋亡检测试剂盒;上海酶联生物提供IL-6、IL-1检测试剂盒;美国Santa Cruz公司提供兔抗人Bax、Bcl-2、MMP-9抗体、内参GAPDH与HRP标记的山羊抗兔IgG二抗。
1.2 方法
1.2.1 实验处理及分组 血管内皮细胞放入含有10%胎牛血清的DMEM完全培养基中培养,将细胞接种于6孔板(1×104个/孔),加入含有浓度为40 ng/mL TNF-α的DMEM培养基培养12 h[7],记为TNF-α组。同时将正常培养的血管内皮细胞记为con组。分别加入含有浓度为40μg/mL、80μg/mL、160μg/mL的积雪草苷[8]和40 ng/mL TNF-α的DMEM培养基培养12 h,分别记为TNF-α+低积雪草苷组、TNF-α+中积雪草苷组、TNF-α+高积雪草苷组。细胞转染:用不含胎牛血清的细胞培养液与pcDNA、pcDNA-MMP-9混合后室温孵育5 min(A液),用不含胎牛血清的细胞培养液与Lipofectamine2000转染试剂充分混合(B液),A液与B液充分混匀后室温孵育20 min后加入血管内皮细胞,6 h弃上清液后更换正常培养液,并继续培养48 h。采用上述转染方法将pcDNA、pcDNA-MMP-9分别转染至血管内皮细胞,转染成功后加入含有浓度为160μg/mL的积雪草苷和40 ng/mLTNF-α的DMEM培养基培养12 h,分别记为TNF-α+积雪草苷+pcDNA组、TNF-α+积雪草苷+pcDNA-MMP-9组。
1.2.2 CCK-8实验检测细胞增殖 血管内皮细胞接种于96孔板(1×103个/孔),采用0 ng/mL、20 ng/mL、40 ng/mL、60 ng/mL、80 ng/mL的TNF-α作用血管内皮细胞24 h,每孔中加入CCK-8溶液10μL,继续培养2 h后应用酶标仪检测各孔光密度值(OD 450 nm)。选40 ng/mL TNF-α做后续实验,TNF-α对不同时间(0 h、4 h、8 h、12 h、16 h、20 h、24 h)下内皮细胞活性的影响,采用CCK-8法检测细胞活性。同时收集各组血管内皮细胞接种于96孔板(1×103个/孔)后置于培养箱内继续培养,采用CCK-8法检测细胞活性。
1.2.3 qRT-PCR检测MMP-9 mRNA的表达水平 Trizol法提取血管内皮细胞中总RNA,将总RNA反转录合成cDNA后进行qRT-PCR反应,采用2-ΔΔCt法计算MMP-9 mRNA相对表达量。
1.2.4 流式细胞术检测细胞凋亡率 收集各组血管内皮细胞后加入500μL Binding Buffer悬浮细胞,分别加入Annexin V-FITC与PI各5μL,室温避光孵育10 min,应用流式细胞仪检测细胞凋亡率。
1.2.5 ELISA法检测IL-6、IL-1的水平 收集各组血管内皮细胞培养上清液,采用ELISA法检测IL-6、IL-1的水平,严格按照试剂盒说明书进行操作。
1.2.6 Western blot检测Bax、Bcl-2、MMP-9蛋白表达量 收集各组血管内皮细胞加入400μL RIPA裂解液提取细胞总蛋白,采用BCA法测定蛋白浓度后进行SDS-PAGE,分离的蛋白凝胶转移至PVDF膜后用5%脱脂牛奶封闭2 h,分别加入Bax(1∶1 000)、Bcl-2(1∶1 000)、MMP-9(1∶1 000)一抗与内参GAPDH抗体(1∶2 000)稀释液,4℃孵育24 h,加入二抗稀释液(1∶3 000)后室温孵育1 h,滴加ECL显影,应用ImageJ软件分析各条带灰度值。
1.3 统计学方法 采用SPSS21.0统计学软件分析数据。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 TNF-α对内皮细胞活性的影响 不同浓度的TNF-α作用24 h后,随着TNF-α浓度的升高细胞活性降低,其中TNF-α浓度为40 ng/mL时细胞活性明显降低,差异有统计学意义(P<0.05),而60 ng/mL组、80 ng/mL组细胞活性比较差异无统计学意义(P>0.05),因而选用40 ng/mL TNF-α进行后续实验,见表1。在40 ng/mL TNF-α作用下,0~12 h时细胞活性无明显变化,而16 h、20 h、24 h时细胞活性降低且随着时间的延长而明显降低,差异均有统计学意义(P<0.05),因而选用12 h做后续实验,见表2。
表1 不同浓度的TNF-α作用24 h对内皮细胞活性的影响(±s)Table 1 Effect of TNF-αat different concentrations for 24 h on endothelial cell activity(±s)
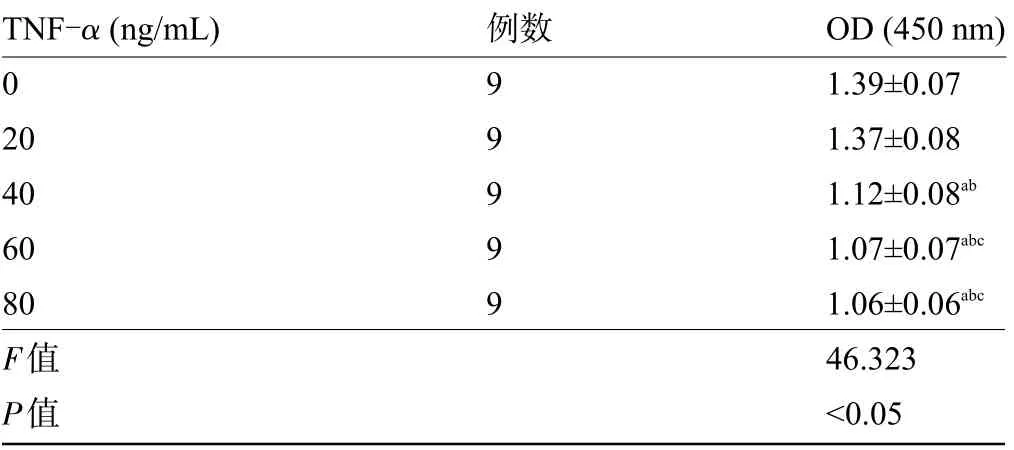
表1 不同浓度的TNF-α作用24 h对内皮细胞活性的影响(±s)Table 1 Effect of TNF-αat different concentrations for 24 h on endothelial cell activity(±s)
注:与0 ng/mL组比较,a P<0.05;与20 ng/mL组比较,b P<0.05;与40 ng/mL组比较,c P<0.05;与60 ng/mL组比较,d P<0.05。Note:Compared with 0 ng/mL group,a P<0.05;Compared with 20 ng/mL group,b P<0.05;Compared with 40 ng/mL group,c P<0.05;Compared with 60 ng/mL group,d P<0.05.
TNF-α(ng/mL)0 20 40 60 80 F值P值例数9 9 9 9 9 OD(450 nm)1.39±0.07 1.37±0.08 1.12±0.08ab 1.07±0.07abc 1.06±0.06abc 46.323<0.05
表2 TNF-α对不同时间下内皮细胞活性的影响(±s)Table 2 Effects of TNF-αon endothelial cell activity at different times(±s)
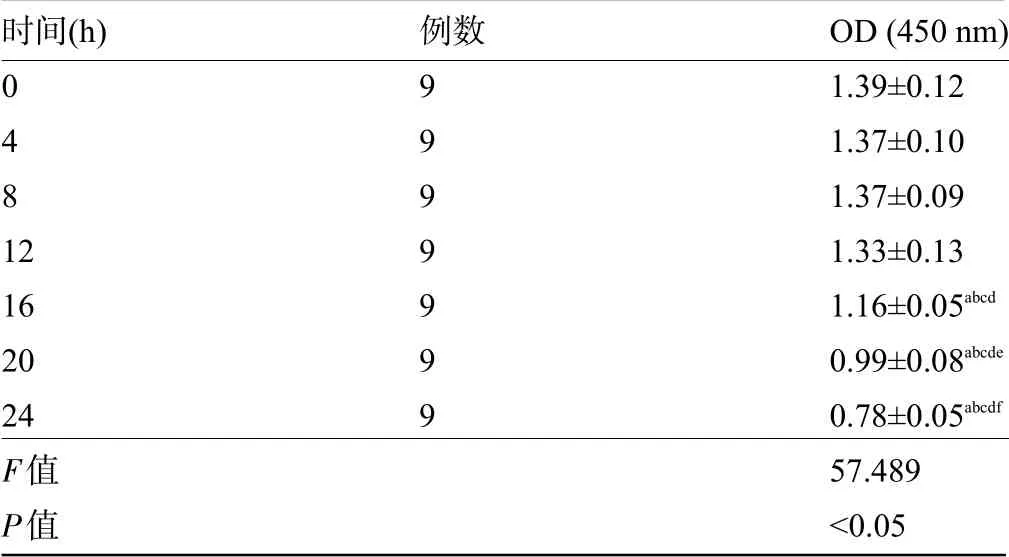
表2 TNF-α对不同时间下内皮细胞活性的影响(±s)Table 2 Effects of TNF-αon endothelial cell activity at different times(±s)
注:与0 h组比较,a P<0.05;与4 h组比较,b P<0.05;与8 h组比较,c P<0.05;与12 h组比较,d P<0.05;与16 h组比较,e P<0.05;与20 h组比较,f P<0.05。Note:Compared with 0 h group,a P<0.05;Compared with 4 h group,b P<0.05;Compared with 8 h group,c P<0.05;Compared with 12 h group,d P<0.05;Compared with 16 h group,e P<0.05;Compared with 20 h group,f P<0.05.
时间(h)0 4 8 12 16 20 24 F值P值例数9 9 9 9 9 9 9 OD(450 nm)1.39±0.12 1.37±0.10 1.37±0.09 1.33±0.13 1.16±0.05abcd 0.99±0.08abcde 0.78±0.05abcdf 57.489<0.05
2.2 积雪草苷对TNF-α处理的内皮细胞损伤及炎症因子的影响 与con组比较,TNF-α组细胞凋亡率和Bax蛋白水平升高,Bcl-2蛋白水平降低,IL-6、IL-1的水平升高,差异均有统计学意义(P<0.05);与TNF-α组比较,TNF-α+低积雪草苷组、TNF-α+中积雪草苷组、TNF-α+高积雪草苷组细胞凋亡率和Bax蛋白水平降低,Bcl-2蛋白水平升高,IL-6、IL-1的水平降低,差异均有统计学意义(P<0.05),且呈剂量依赖性,见图1、图2、表3。

图2 积雪草苷对内皮细胞凋亡蛋白表达的影响Figure 2 Effect of asiaticoside on expression of apoptotic protein in endothelial cells
表3 积雪草苷对内皮细胞损伤及炎症因子的影响(±s,n=9)Table3 Effectsof asiaticoside on endothelial cell injury and inflammatory factors(±s,n=9)

表3 积雪草苷对内皮细胞损伤及炎症因子的影响(±s,n=9)Table3 Effectsof asiaticoside on endothelial cell injury and inflammatory factors(±s,n=9)
注:与con组比较,a P<0.05;与TNF-α组比较,b P<0.05;与TNF-α+低积雪草苷组比较,c P<0.05;与TNF-α+中积雪草苷组比较,d P<0.05。Note:Compared with con group,a P<0.05;Compared with the TNF-αgroup,bP<0.05;Compared with TNF-α+low asiaticoside group,c P<0.05;Compared with TNF-α+asiaticosidegroup,d P<0.05.
组别Con组TNF-α组TNF-α+低积雪草苷组TNF-α+中积雪草苷组TNF-α+高积雪草苷组F值P值凋亡率(%)6.90±0.51 24.55±1.39a 21.60±0.81b 16.23±0.76bc 11.91±0.50bcd 623.634<0.05 Bax 0.21±0.02 0.85±0.06a 0.72±0.04b 0.50±0.03bc 0.27±0.03bcd 467.331<0.05 Bcl-2 0.75±0.04 0.15±0.02a 0.23±0.02b 0.39±0.03bc 0.60±0.04bcd 576.551<0.05 IL-6(pg/mL)72.78±8.56 426.96±25.28a 350.72±19.12b 255.21±24.37bc 144.85±12.18bcd 518.871<0.05 IL-1(pg/mL)44.53±5.46 307.93±14.23a 238.96±13.13b 167.18±12.66bc 98.92±7.93bcd 798.637<0.05

图1 积雪草苷对内皮细胞凋亡的影响Figure1 Effect of asiaticoside on endothelial cell apoptosis
2.3 积雪草苷对TNF-α处理的内皮细胞中基质金属蛋白酶-9表达的影响 与con组比较,TNF-α组MMP-9 mRNA及蛋白水平升高,差异均有统计学意义(P<0.05);与TNF-α组比较,TNF-α+低积雪草苷组、TNF-α+中积雪草苷组、TNF-α+高积雪草苷组MMP-9 mRNA及蛋白水平降低,差异均有统计学意义(P<0.05),且剂量依赖性,见图3、表4。
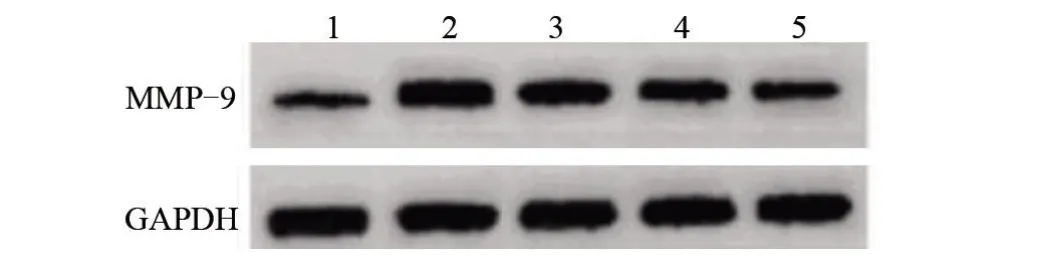
图3 MMP-9蛋白表达的检测Figure3 Detection of MMP-9 protein expression
表4 积雪草苷对内皮细胞中MMP-9表达的影响(±s,n=9)Table4 Effect of asiaticosideon the expression of MMP-9 in endothelial cells(±s,n=9)
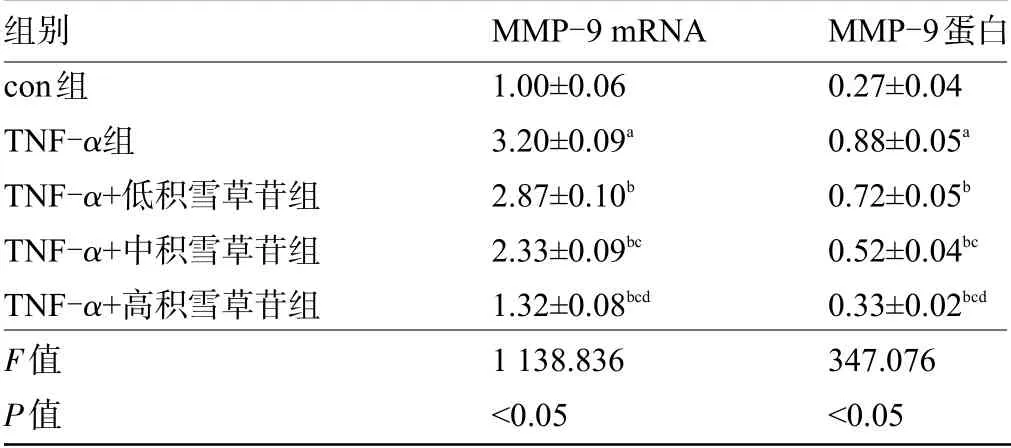
表4 积雪草苷对内皮细胞中MMP-9表达的影响(±s,n=9)Table4 Effect of asiaticosideon the expression of MMP-9 in endothelial cells(±s,n=9)
注:与con组比较,a P<0.05;与TNF-α组比较,b P<0.05;与TNF-α+低积雪草苷组比较,c P<0.05;与TNF-α+中积雪草苷组比较,d P<0.05。Note:Compared with con group,a P<0.05;Compared with the TNF-α group,b P<0.05;Compared with TNF-α+low asiaticoside group,c P<0.05;Compared with TNF-α+asiaticosidegroup,d P<0.05.
组别con组TNF-α组TNF-α+低积雪草苷组TNF-α+中积雪草苷组TNF-α+高积雪草苷组F值P值MMP-9 mRNA 1.00±0.06 3.20±0.09a 2.87±0.10b 2.33±0.09bc 1.32±0.08bcd 1 138.836<0.05 MMP-9蛋白0.27±0.04 0.88±0.05a 0.72±0.05b 0.52±0.04bc 0.33±0.02bcd 347.076<0.05
2.4 MMP-9过表达对积雪草苷作用的内皮细胞损伤及炎症因子的影响 与TNF-α+积雪草苷+pcDNA组比较,TNF-α+积雪草苷+pcDNA-MMP-9组MMP-9 mRNA及蛋白水平升高,细胞凋亡率和Bax蛋白水平升高,Bcl-2蛋白水平降低,IL-6、IL-1的水平升高,差异均有统计学意义(P<0.05),见图4、图5、表5。
表5 MMP-9过表达对积雪草苷作用的内皮细胞损伤及炎症因子的影响(±s,n=9)Table 5 Effect of MMP-9 overexpression on endothelial cell injury and inflammatory factorsinduced by asiaticoside(±s,n=9)
表5 MMP-9过表达对积雪草苷作用的内皮细胞损伤及炎症因子的影响(±s,n=9)Table 5 Effect of MMP-9 overexpression on endothelial cell injury and inflammatory factorsinduced by asiaticoside(±s,n=9)
注:与TNF-α+积雪草苷+pcDNA组比较,a P<0.05。Note:Compared with TNF-α+asiaticoside+pcDNA group,a P<0.05.
组别TNF-α+积雪草苷+pcDNA组TNF-α+积雪草苷+pcDNA-MMP-9组t值P值MMP-9 mRNA 1.28±0.07 2.55±0.13a 25.805<0.05 MMP-9蛋白0.29±0.03 0.58±0.04a 17.400<0.05凋亡率(%)11.86±0.76 19.98±0.95a 20.023<0.05 Bax 0.28±0.03 0.66±0.04a 22.800<0.05 Bcl-2 0.60±0.05 0.26±0.02a 18.941<0.05 IL-6(pg/mL)141.54±12.51 320.74±15.17a 27.341<0.05 IL-1(pg/mL)99.79±8.10 207.68±13.73a 20.304<0.05

图4 MMP-9过表达对积雪草苷作用的内皮细胞凋亡的影响Figure4 Effect of MMP-9 overexpression on endothelial cell apoptosis induced by asiaticoside
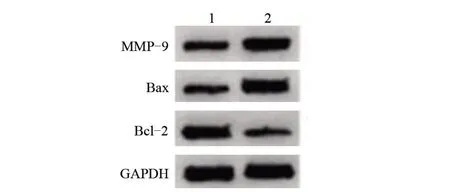
图5 MMP-9过表达对积雪草苷作用的内皮细胞MMP-9和凋亡蛋白表达的影响Figure5 Effect of MMP-9 overexpression on theexpression of MMP-9 and apoptotic protein in asiaticosideinduced endothelial cells
3 讨论
目前临床采用静脉输注丙种球蛋白与口服阿司匹林等治疗川崎病,但治疗效果不佳。川崎病是引起儿童心脏病的重要原因之一,受到越来越多的关注,而与川崎病相关的血管损伤并发症使其成为成人缺血性心脏病的重要危险因素[9]。遗憾的是,我们目前对川崎病血管损伤的确切发病机制的了解非常有限,仍然缺乏有效的治疗策略。因此,研究川崎病血管内皮损伤的机制和寻找治疗靶点对川崎病的研究和临床治疗至关重要。
积雪草苷可抑制细胞凋亡而减轻肾缺血再灌注损伤[10]。积雪草苷可能通过抑制MAPK信号通路而减轻大鼠心肌缺血再灌注损伤[11]。积雪草苷可促进血管新生从而减轻脑梗死大鼠脑损伤[12]。但积雪草苷对川崎病血管损伤的影响尚未可知。TNF-α作为最重要的炎症因子之一,被用来诱导炎症损伤。故本研究首先使用TNF-α诱导人冠状动脉血管内皮细胞,结果显示,TNF-α可抑制内皮细胞活性,提高IL-6、IL-1的水平,这与Wang等[13]的研究一致,提示川崎病血管损伤模型建立成功。此外,本研究还发现TNF-α诱导的血管内皮细胞凋亡率和Bax蛋白水平升高,Bcl-2蛋白水平降低,说明TNF-α诱导可通过调控相关蛋白表达促进细胞凋亡,这也证实了川崎病血管损伤模型的成功建立。Bcl-2、Bax主要定位于线粒体外膜上,细胞受到凋亡信号刺激后,Bax可增加线粒体膜通透性,其水平升高可促进细胞色素释放,引起细胞凋亡[14]。IL-6、IL-1属于促炎细胞因子,其水平升高可促进细胞损伤[15]。本研究结果显示,随着积雪草苷浓度的升高,IL-6、IL-1的水平降低,内皮细胞凋亡率下降,Bax蛋白表达下调,Bcl-2蛋白表达上调,提示积雪草苷可抑制TNF-α诱导的血管内皮细胞凋亡和炎症因子表达,进而减轻细胞损伤。这可能与积雪草苷抑制MAPK信号通路有关,但具体作用机制仍需进一步验证。
已有研究表明MMP-9等基因在川崎病发生及发展过程中可发挥重要调控作用[16-17]。抑制MMP-9表达表达可保护血脑屏障的完整性和通透性[18]。MMP-9表达下调可保护气道上皮细胞[19]。MMP-9表达上调可促进脂多糖诱导的急性肺损伤[20]。本研究结果显示,TNF-α诱导的血管内皮细胞中MMP-9 mRNA及蛋白水平升高,而积雪草苷能够以浓度依赖性方式降低MMP-9的表达,提示积雪草苷对川崎病血管损伤的改善作用可能与下调MMP-9表达相关。深入研究表明,MMP-9过表达可减弱积雪草苷对TNF-α诱导的血管内皮细胞凋亡及炎症反应的抑制作用,提示积雪草苷可通过抑制MMP-9表达而减轻川崎病血管损伤。
综上所述,TNF-α诱导的血管内皮细胞中MMP-9的表达量升高,积雪草苷可通过下调MMP-9表达而抑制TNF-α诱导的血管内皮细胞凋亡及炎症反应,MMP-9可能作为积雪草苷治疗川崎病的潜在靶点。
