载美洲大蠊提取物蛛丝蛋白膜的制备、表征及体外释药性和细胞毒性考察 Δ
2023-02-09曾惠娜卿晨薛楠楠杨自忠巫秀美李和伟赵昱李启艳大理大学云南省昆虫生物医药研发重点实验室云南大理671000大理大学药用特种昆虫开发国家地方联合工程研究中心云南大理671000大理大学中国西南药用昆虫及蛛形类资源开发利用协同创新中心云南大理671000南京中医药大学药学院南京21002云南省第一人民医院牙周科昆明6002
曾惠娜 ,卿晨 ,薛楠楠 ,杨自忠 ,巫秀美 ,李和伟 ,赵昱 ,李启艳 , (1.大理大学云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.大理大学药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000;.大理大学中国西南药用昆虫及蛛形类资源开发利用协同创新中心,云南 大理 671000;.南京中医药大学药学院,南京 21002;.云南省第一人民医院牙周科,昆明 6002)
放化疗性口腔黏膜炎是放化疗常见的并发症,其发病率已高达80%[1-2],严重影响患者的生活质量和对放化疗的耐受性。口腔黏膜炎导致患者主观上逃避或拖延放化疗,客观上无法保证疗效的正常发挥。康复新液是美洲大蠊Periplaneta americana Linn.乙醇提取物的现代制剂,具有养阴生肌、通利血脉的功效,内服可治疗胃、十二指肠等消化道黏膜溃疡,外用则可治疗各类金疮溃疡、褥疮[3]。有研究表明,康复新液用于防治、修复口腔溃疡的疗效确切,为临床上治疗放化疗性口腔黏膜炎的经验用药,一般采用含漱、涂抹、口服等方式给药,但在溃疡表面形成的药物层易伴随着吞咽动作被唾液逐渐冲刷带走,难以长时间在溃疡面停留[4-5]。因此,迫切需要将康复新液制备成可长期停留在溃疡部位、对放化疗性口腔黏膜炎疗效确切且具缓释性的口腔贴膜剂。
蜘蛛丝是由蜘蛛分泌的多种蛋白质水溶液经脱水后形成的固体纤维,其主要成分是蛋白质。与其他动物所产丝不同,蛛丝蛋白氨基酸序列具有特殊的保守性和同一性。有研究指出,蜘蛛丝具有生物界内最佳的人体生物相容性、低免疫原性、可调节性等,有望应用于药物传递领域[6-7]。基于此,本课题组选用天然蛛丝为原料,以美洲大蠊提取物为模型药物,尝试制备载美洲大蠊提取物的蛛丝蛋白膜,并对其进行表征和体外释药性考察。现报道如下。
1 仪器
1.1 主要仪器
本研究所用主要仪器有DF-101S型集热式恒温加热磁力搅拌器(上海仪昕科学仪器有限公司)、5700型傅里叶红外光谱仪(美国Thermo Nicolet公司)、SDC-200型水接触角实验仪(东莞市晟鼎精密仪器有限公司)、DX-2700BH型X射线衍射仪(丹东浩元仪器有限公司)、Tescan Mira Lms型扫描电子显微镜(捷克TESCAN公司)、1260 Infinity Ⅱ型高效液相色谱仪(美国Agilent公司)、Spectra Max M2型多功能酶标仪(美国Molecular Devices公司)、CKX41SF型倒置生物显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
美洲大蠊提取物(批号20190316)由大理大学昆虫生物医药研究院提供;肌苷(批号13J12C137495)购自上海源叶生物科技有限公司;敬钊缨毛蛛蛛丝(批号20200312)购自海南蛛王生物科技有限公司;六氟异丙醇(hexafluoroisopropanol,HFIP;批号20210325)购自上海钰康生物科技有限公司;胎牛血清(批号1618862)购自美国Gibco公司;MEM培养基(批号20200701)购自武汉普诺赛生命科技有限公司;甲醇(批号207899)购自美国Thermo Fisher Scientific公司;二甲基亚砜(批号D8371)、噻唑蓝(批号715S01)均购自北京索莱宝科技有限公司。
1.3 实验细胞
小鼠成纤维L-929细胞(批号20211109)购自美国菌种保存中心。
2 方法与结果
2.1 载药蛛丝蛋白膜的制备
称取800 mg新鲜洁净的敬钊缨毛蛛蛛丝,按质量体积比1∶1(mg/mL)量取HFIP,倒入圆底烧瓶中,加热回流使蛛丝充分溶解。将溶解后的蛛丝-HFIP溶液过滤,除去不溶性杂质后,加热浓缩得到25%原体积的蛛丝蛋白浓缩液。称取160 mg美洲大蠊提取物,以5 mL HFIP溶解后与上述制备得到的蛛丝蛋白浓缩液进行混合。将混合好的蛛丝蛋白-美洲大蠊提取物溶液倒入预先准备好的成膜模具中,采用溶剂浇铸法均匀成膜。在通风橱内室温条件下挥干剩余溶剂,回软揭膜,制备得到载美洲大蠊提取物的蛛丝蛋白膜(后文称“载药膜”)。同法制备不含美洲大蠊提取物的载药材料基质蛛丝蛋白膜(后文称“空白膜”)。
2.2 膜剂的表征
2.2.1 静态水接触角测试 参照标准《GB/T 30693-2014 塑料薄膜与水接触角的测量》测定样品的静态水接触角。取载药膜和空白膜各适量,将其裁剪成大小合适的受试样品,置于药品稳定实验箱(温度为45.0 ℃,相对湿度为50%)平衡48 h;采用水滴法测试受试样品的静态水接触角,水滴体积均为3 μL,在60 s内观察并测量受试样品的水接触角。每种样品重复测量3次。结果显示,空白膜与载药膜的水接触角均小于90°,且载药膜小于空白膜,表明受试样品具有一定的亲水性。结果见图1。

图1 空白膜和载药膜的静态水接触角图
2.2.2 药物负载分析 采用傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)法对样品进行分析。将空白膜、载药膜以及美洲大蠊提取物采用溴化钾压片法分别制备空白膜、载药膜、美洲大蠊提取物样品,设置扫描范围为4 000~400 cm-1、分辨率为4 cm-1,每个受试样品扫描32次,扫描结果见图2。由图2可知,载药膜样品与空白膜样品在1 237 cm-1处均出现归属于β-折叠构象的吸收峰[8-10];美洲大蠊提取物中富含多肽类化合物,在1 500~1 700 cm-1酰胺区间有吸收;与空白膜相比,载药膜和美洲大蠊提取物在1 406 cm-1均出现较明显的多肽特征吸收峰。由此推测,载药膜中含有美洲大蠊提取物,即药物已成功负载于蛛丝蛋白膜中。

图2 原料药与膜剂的FTIR图
2.2.3 膜剂晶型考察 采用X-射线衍射法(X-ray diffraction,XRD)分别对空白膜、载药膜、美洲大蠊提取物进行检测。将美洲大蠊提取物用载玻片压平,使其表面平整后置于载物台上进行测试;空白膜和载药膜则直接放于载物台上进行测试。设置管电压为40 kV,管电流为30 mA,扫描速度为4°/min,记录扫描角度2θ为5°~60°时的衍射强度曲线,并绘制样品的XRD图谱(图3)。由图3可知,空白膜在10.5°、21.8°处出现明显衍射峰;美洲大蠊提取物在22.2°、28.2°处出现衍射峰;载药膜出现的衍射峰位置和个数与空白膜的衍射峰相同,但载药膜在21°附近的衍射峰较空白膜强,应归于空白膜与美洲大蠊提取物特征峰叠加的综合体现。
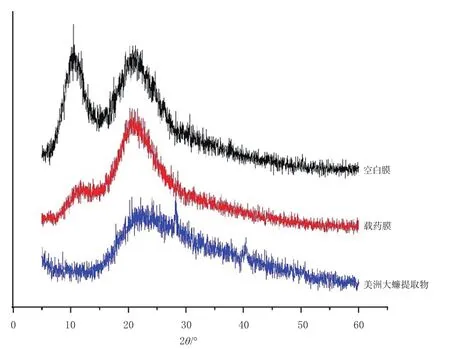
图3 原料药与膜剂的XRD图
2.2.4 外观形貌观察 使用扫描电镜(scanning electron microscopy,SEM)对空白膜、载药膜进行外观形貌观察。将空白膜和载药膜分别裁剪成0.5 cm×0.5 cm面积大小的试样,将试样用导电胶粘在试样台上喷金处理,设置电压为15 kV,调整图像清晰度,观察膜的微观表面形貌。通过SEM观察发现,空白膜和载药膜均具有三维多孔结构,各三维膜孔朝向不一。从图4可看出,载药膜膜孔表面出现均匀分散的白色物质,可能是在振摇干燥成膜时,部分药物分子随溶剂挥发凝结并富集于膜孔边缘;载药膜表面无大量成团块的药物分子簇沉积或析出,说明以该载药量制备得到的载药膜并未过载。
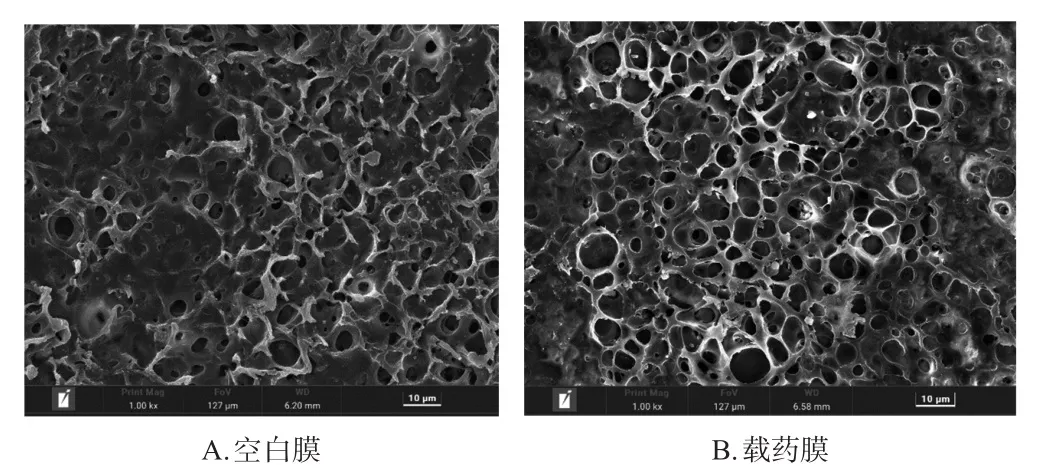
图4 空白膜和载药膜的SEM形貌图
2.3 载药膜的体外释药性考察
肌苷是美洲大蠊提取物中含量最高的指标性成分之一[6],故本文以其为标准物质,采用高效液相色谱外标法来确定美洲大蠊提取物高效液相色谱图中肌苷所对应的峰,并以肌苷峰面积对美洲大蠊提取物的含量进行定量考察。
2.3.1 色谱条件 以Sepax HP-C18(4.6 mm×250 mm,5 μm)为色谱柱;以0.1%三氟乙酸溶液(A)-甲醇(B)为流动相进行梯度洗脱(0~15 min,98%A→80%A;15~30 min,80%A→98%A);流速为 0.5 mL/min;柱温为30.0 ℃;检测波长为254 nm;进样体积为10 μL。
2.3.2 溶液的制备 (1)美洲大蠊提取物溶液:精密称量美洲大蠊提取物100.0 mg,用人工唾液配制成质量浓度为2.0 mg/mL的美洲大蠊提取物溶液[6,11-12]。(2)肌苷外标溶液:精密称取肌苷2.0 mg,用人工唾液配制成质量浓度为1.0 mg/mL的肌苷外标溶液。(3)供试溶液:取“2.1”项下载药膜5 mg,置于2 mL离心管中,加入1 mL人工唾液,超声(频率53 kHz,功率500 W,下同)30 min,即得供试溶液。(4)阴性对照溶液:取“2.1”项下空白膜5 mg,按“2.3.2(3)”项下方法制备阴性对照溶液。(5)空白对照溶液:取1 mL人工唾液,即得。
2.3.3 方法学考察 (1)专属性考察:分别取“2.3.2”项下制备的美洲大蠊提取物溶液、肌苷外标溶液、供试溶液、阴性对照溶液和空白对照溶液各适量,按照“2.3.1”项下色谱条件进样检测。结果显示,供试溶液和美洲大蠊提取物溶液在相同保留时间存在相同的色谱峰,且阴性对照溶液、空白对照溶液不干扰美洲大蠊提取物的检测(图5)。(2)线性关系考察:取“2.3.2(1)”项下美洲大蠊提取物溶液,用人工唾液稀释成质量浓度为0.2、0.4、0.5、0.6、0.8、1.0、1.2 mg/mL的美洲大蠊提取物系列溶液,按照“2.3.1”项下色谱条件进样检测。以美洲大蠊提取物的质量浓度为横坐标(x)、美洲大蠊提取物中肌苷对应的峰面积为纵坐标(y),绘制得标准曲线:y=67.502x-0.342 9(R2=0.993 5)。该结果说明,以肌苷为标志物绘制的美洲大蠊提取物在质量浓度为0.2~1.2 mg/mL的范围内有良好的线性关系。(3)精密度试验:取“2.3.2(1)”项下的美洲大蠊提取物溶液,按“2.3.1”项下色谱条件连续进样6次,得峰面积的RSD为0.14%(n=6),说明仪器精密度良好。(4)重复性试验:按“2.3.2(3)”项下方法平行制备6份供试溶液,按“2.3.1”项下色谱条件进样检测,代入回归方程计算得美洲大蠊提取物含量的RSD为0.37%(n=6),说明方法重复性良好。(5)稳定性试验:按“2.3.2(3)”项下方法制备供试溶液,分别于室温下放置0、24、48 h时按“2.3.1”项下色谱条件进样检测,得峰面积的RSD为0.85%(n=3),说明室温下供试溶液在48 h内稳定性良好。(6)加样回收率试验:称取已知含量的载药膜2.5 mg,共9份,分别按照处方原料量的150%、100%和50%加入美洲大蠊提取物,混合,各浓度平行制备3份,再按“2.3.2(3)”项下方法制备供试溶液,再按“2.3.1”项下色谱条件进样检测,计算加样回收率。结果显示,平均加样回收率分别为100.75%、99.53%、100.51%,RSD分别为0.82%、0.81%、0.32%(n=3),说明方法准确度良好。
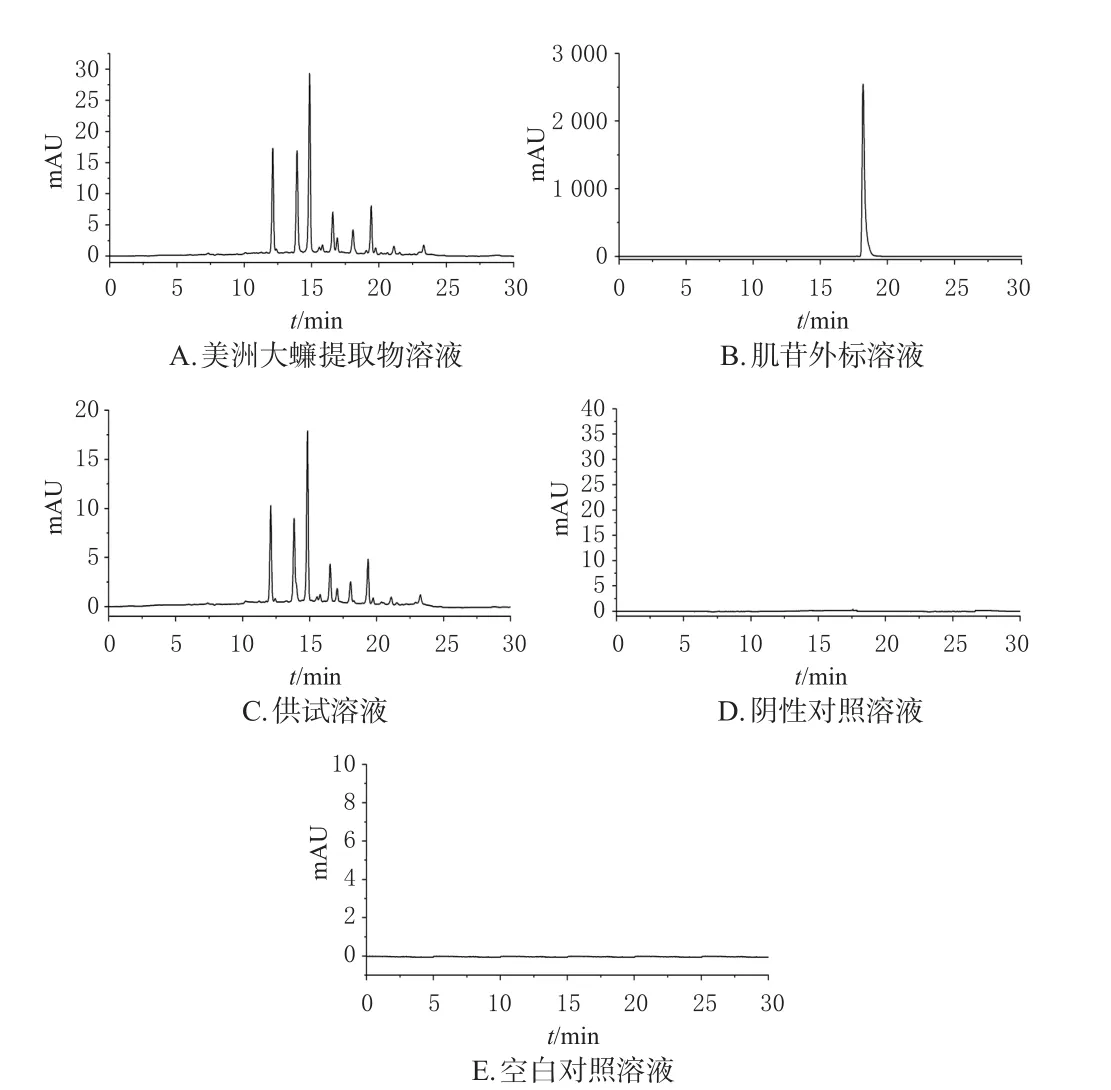
图5 各溶液专属性考察高效液相色谱图
2.3.4 膜剂载药量测定 取载药膜(1 cm×1 cm)在45 ℃条件下干燥至恒质量(M1);将其剪碎置于离心管中,并向管中添加10 mL的人工唾液,超声30 min后于4 ℃下以5 000 r/min离心4 min,取上清液,按“2.3.1”项下色谱条件进样检测并代入回归方程计算载药膜中美洲大蠊提取物的含量(M2);根据载药量公式计算得该膜剂的载药量:载药量(%)=M2/M1×100%。经计算,该膜剂载药量为15%。
2.3.5 载药膜体外释药实验 将载药膜裁剪成6张1 cm×1 cm大小的方形,分别放入6个形制相同的离心管中,各加入新鲜配制的(37.0±0.5)℃人工唾液1 mL,使得受试膜完全被人工唾液没过,在转速为50 r/min、温度为(37.0±0.5)℃的条件下进行释药实验。设置累积释药时间为0、1、5、15、30、50、70、100、150、200 min。在每个释药时间点进行释药液样本取样:将离心管中的释药液取尽后再向离心管内添加等温等体积的新鲜配制的人工唾液,继续进行释药实验直至达到预设的累积释药时间。每个累积释药时间点的取样操作均相同。按“2.3.1”项下色谱条件检测释药液中的美洲大蠊提取物含量,并以6组释药实验所得均值绘制释药曲线(图6)。如图6所示,载药膜在人工唾液中具有一定的缓释性能,可持续释药不低于200 min。在0~15 min时,药物从膜中大量释放,其释药百分率达到48%。结合“2.2.4”项下图4B分析此阶段可能是膜剂本身表面孔洞较大,溶剂易进入膜孔,加之膜剂表层吸附的药物大量溶解,药物顺浓度梯度扩散,引起药物大量释放;在15~70 min时,释药速率变缓,推测该阶段药物释放主要来源于膜剂内部;而70~200 min阶段的释药过程中,药物的释药百分率仅为11.6%,经前两个阶段的释药,此时膜中药物较少,浓度差较低是导致该阶段药物释放速率减缓的首要原因。

图6 载药膜在人工唾液中的释药曲线
2.4 载药膜的体外细胞毒性考察
按照《GB/T 16886.5-2017医疗器械生物学评价第5部分:体外细胞毒性试验》的要求以体外细胞毒性实验进行膜剂的生物安全性评价。选用小鼠成纤维细胞L-929细胞株,以MTT法检测空白膜和载药膜的体外细胞毒性。将1×105个/mL的细胞悬液以每孔100 μL接种于96孔板中,设置5个实验组,分别为受试组[样品1(空白膜浸提液)、样品2(载药膜浸提液)、阳性对照组(0.1%二乙基二硫代氨基甲酸锌溶液)、阴性对照组(高密度聚乙烯膜浸提液)]和空白对照组,每组设6个复孔。以含10%胎牛血清的MEM培养基为溶剂,按6 cm2∶1 mL的浸提比例分别制备空白膜浸提液、载药膜浸提液、高密度聚乙烯膜浸提液和0.1%二乙基二硫代氨基甲酸锌溶液,在细胞培养箱内(37.0 ℃,5%CO2,相对湿度大于90%)培养至细胞密度达70%。用对应组别的药物分别处理细胞24 h,培养4 h后观察各组细胞形态;继续培养至24 h后,再次观察细胞形态。完成观察后弃培养液,每孔加20 μL MTT(5 mg/mL),置于细胞培养箱中培养4 h后弃上清液,每孔加入100 μL二甲基亚砜,避光振荡30 min后,在570 nm波长下测定光密度(OD)值并计算细胞增殖率。细胞增殖率(%)=受试组OD值/空白对照组OD值×100%。以空白对照组的细胞活力为参比,若受试组的细胞活力<空白对照组细胞活力的70%,即认为受试样品具有潜在的细胞毒性。
结果由图7可见,L-929细胞在样品1、样品2中共孵育4 h后细胞密度可达到50%~60%;共孵育24 h后细胞密度可达到80%~90%,且各细胞生长状态良好。除阳性对照组细胞在共孵育4 h后已呈现皱缩圆形之外,其他受试组细胞在共孵育4 h和24 h后均呈放射状生长且轮廓清晰。MTT实验结果显示,样品1、样品2作用后的细胞增殖率分别为84.6%、79.4%(均大于70%)。可见,空白膜和载药膜的浸提液均对L-929细胞无显著的潜在细胞毒性,所制备的空白膜及载药膜均符合标准的相关要求。

图7 细胞在各样品浸提液中培养4 h、24 h时的显微图(×10)
3 讨论
市售治疗口腔溃疡的药物多以地塞米松等激素类药物为主,而康复新液是美洲大蠊乙醇提取物的现代化制剂。现代药理学研究证实,美洲大蠊提取物具有促进伤口愈合与组织修复、增强免疫、改善微循环等作用;其富含小分子活性肽,对各类表皮或黏膜损伤可起到抗感染及免疫调节作用,具有一定的修复能力,临床上常用于治疗各种原因引起的口腔溃疡,且疗效显著[13-14]。基于此,将美洲大蠊提取物制备成可以长期贴敷于溃疡面,并能持续给药的口腔膜剂是解决康复新现有剂型在口腔滞留时间短、药物流失快的有效方法。蛛丝蛋白链具有独特力学性能,不易发生形变,有良好的降解特性,降解缓慢,生物安全性高,因而蛛丝多孔支架被率先研究用于组织工程如人工心脏支架,以及用于医美的线雕用材等[15-16]。
本研究通过溶剂浇铸法制备载美洲大蠊提取物的蛛丝蛋白膜,并对其进行表征,探讨了载药膜的体外释放行为。结果表明,本研究所制备的载药膜具有三维多孔结构;在人工唾液中具有较好的缓释性,可作为一种具优异生物相容性的药物缓释载体,有望作为新型口腔膜及黏膜制剂等应用于临床。
