15种细胞毒性抗肿瘤药物在我院PIVAS中的环境残留检测及清洁方法 Δ
2023-02-09屈昱晨刘文秀苏州大学附属第二医院药学部江苏苏州215006
耿 洲,王 洋,屈昱晨,陈 浩,刘文秀,费 雯,潘 杰 (苏州大学附属第二医院药学部,江苏 苏州 215006)
细胞毒性抗肿瘤药物是指能直接杀伤或抑制肿瘤细胞生长或增殖的一类化合物,该类药物具有致突变、致畸、致癌性,可通过皮肤接触、吸入等方式进入人体,导致系统或器官组织功能损伤[1]。有研究表明,细胞毒性抗肿瘤药物可引起接触者脱发、生殖损害及黏膜损伤等[2]。Mahmoodi等[3]研究发现,长期接触细胞毒性抗肿瘤药物的医护人员的淋巴细胞遗传学损伤显著增加。Moretti等[4]研究发现,尽管完善了防护措施,但细胞毒性抗肿瘤药物职业暴露的医护人员仍存在较高的遗传毒性风险。国内多中心研究也表明,长期接触细胞毒性抗肿瘤药物的医护人员存在较高的职业暴露风险[5-8]。为找到危险来源,采取正确的防护措施和调配操作,最终降低细胞毒性抗肿瘤药物对医护人员的危害,本研究根据该类药物的临床使用量,采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(ultra-high performance liquid chromatography quadrupole orbitrap high resolution mass spectrometry,UPLC-Q/Orbitrap-HRMS)技术测定了静脉用药集中调配中心(pharmacy intravenous admixture service,PIVAS)环境中吉西他滨、环磷酰胺、多柔比星等15种细胞毒性抗肿瘤药物(以下简称“15种药物”)的含量,以探讨减少细胞毒性抗肿瘤药物环境残留的措施,旨在为保障医护人员的职业健康提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有Q-Exactive Focus-Q/Orbitrap型高分辨质谱仪、Thermo Fisher UltiMate 3000型超高效液相色谱仪(美国Thermo Fisher Scientific公司),Milli-Q HR型超纯水净化仪(德国Merck公司),G560E型涡旋仪(美国Scientific Industries公司),H1750R型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),860-5211A型超声仪(上海声彦超声波仪器有限公司)。
1.2 主要药品与试剂
环磷酰胺(批号50-18-0,纯度98%)、依托泊苷(批号33419-42-0,纯度98%)、异环磷酰胺(批号3778-73-2,纯度98%)、表柔比星(批号56390-09-1,纯度≥98%)标准品均购自上海麦克林生化科技有限公司;阿糖胞苷(批号69-74-9,纯度>98%)、吉西他滨(批号122111-03-9,纯度>99%)、甲氨蝶呤(批号59-05-2,纯度>99%)、高三尖杉酯碱(批号26833-87-4,纯度≥99%)、雷替曲塞(批号112887-68-0,纯度≥99%)、多柔比星(批号25316-40-9,纯度>99%)、柔红霉素(批号23541-50-6,纯度>98%)、吡柔比星(批号MB3763,纯度>98%)、伊达比星(批号57852-57-0,纯度>98%)、多西他赛(批号114977-28-5,纯度≥97%)、紫杉醇(批号33069-62-4,纯度>99%)标准品均购自大连美仑生物技术有限公司;CCK-8试剂盒(批号1681706)购自合肥白鲨生物科技有限公司;所有试剂均为色谱纯。
1.3 细胞
人皮肤细胞Hacat(批号20201004)购自武汉普诺赛生命科技有限公司。
1.4 数据分析
采用SPSS 22.0统计软件及GraphPad Prism 7.01软件处理数据。数据以±s表示,两组间比较采用独立样本t检验。检验水准α=0.05。
2 方法与结果
2.1 15种药物定量分析方法的建立
2.1.1 试验条件 色谱条件为:以Thermo Hypersil GOLD(2.1 mm×100 mm,3 μm)为色谱柱,以0.1%甲酸溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~3 min,10%A;3~14 min,10%A→30%A;14~15.5 min,30%A→90%A;15.5~17.5 min,90%A;17.5~18 min,90%A→10%A;18~21 min,10%A);流速为0.3 mL/min;柱温为30 ℃;进样量为5 μL。
质谱条件为:采用全扫描和目标离子选择性扫描模式,以电喷雾离子源进行正负离子扫描;毛细管温度为320 ℃;鞘气体积流量为15 psi;辅助气体积流量为2 psi;正、负离子模式的喷雾电压分别为3.5、2.5 kV;透镜电压为55 kV;探头加热器温度为300 ℃;最大喷射电流为 100 V;碰撞能量梯度为 10、30、50;扫描范围 m/z 150~2 000;质量分辨率为70 000。15种药物的保留时间和质谱参数见表1。
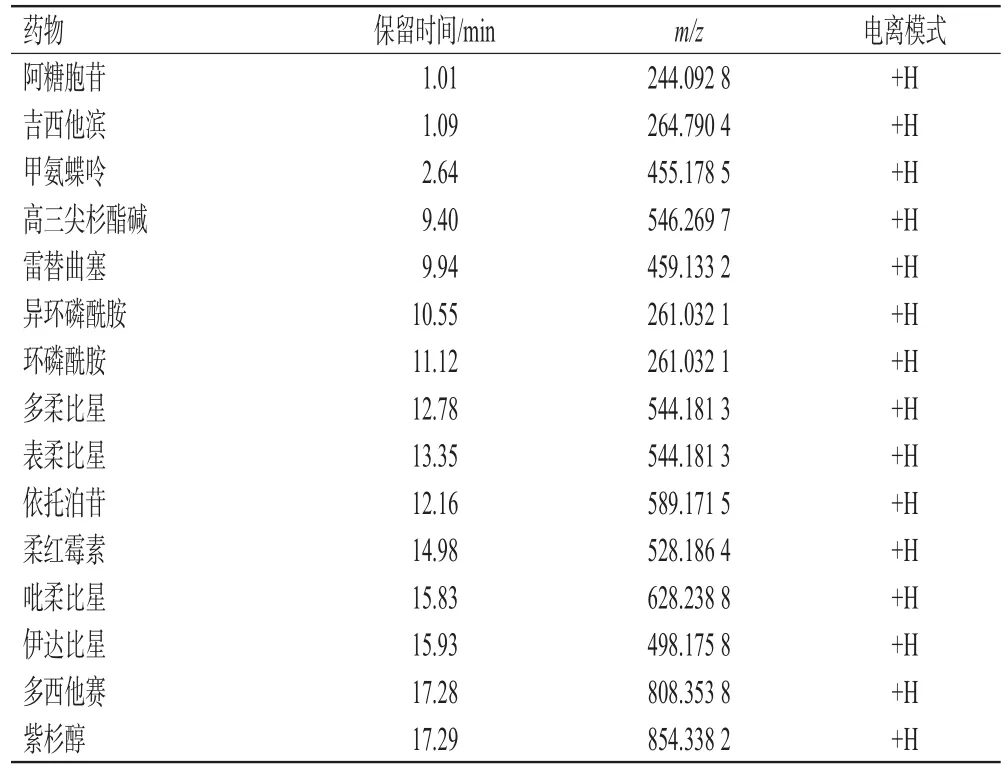
表1 15种药物的保留时间和质谱参数
2.1.2 样品溶液及阴性溶液的制备 分别精密称取15种药物标准品各1 mg,溶于甲醇-乙腈-水(1∶1∶2,V/V/V,下同)溶液1 mL中,得15种药物质量浓度均为1 mg/mL的单一储备液。分别精密量取上述各单一储备液50 μL,混合,加入甲醇-乙腈-水溶液250 μL,制得15种药物质量浓度均为50 μg/mL的混合标准溶液(15MIX溶液),经0.22 μm有机滤膜滤过,备用。另取甲醇-乙腈-水溶液作为阴性溶液。
2.1.3 专属性考察 分别取15种药物标准品1 mg,加甲醇-乙腈-水溶液稀释,得15种药物质量浓度均为50 ng/mL的单一标准品溶液。分别取上述单一标准品溶液、阴性溶液、15MIX溶液,按“2.1.1”项下试验条件进样分析,记录色谱图(图略)。结果显示,15种药物的检测互不干扰。
2.1.4 标准曲线绘制与定量下限考察 取“2.1.2”项下15MIX溶液,用甲醇-乙腈-水溶液稀释,制成系列线性工作溶液,按“2.1.1”项下试验条件进样分析,记录峰面积。以各药物质量浓度为横坐标(X)、质谱响应强度(Y)为纵坐标进行线性回归,并以线性范围下限作为定量下限。结果见表2。
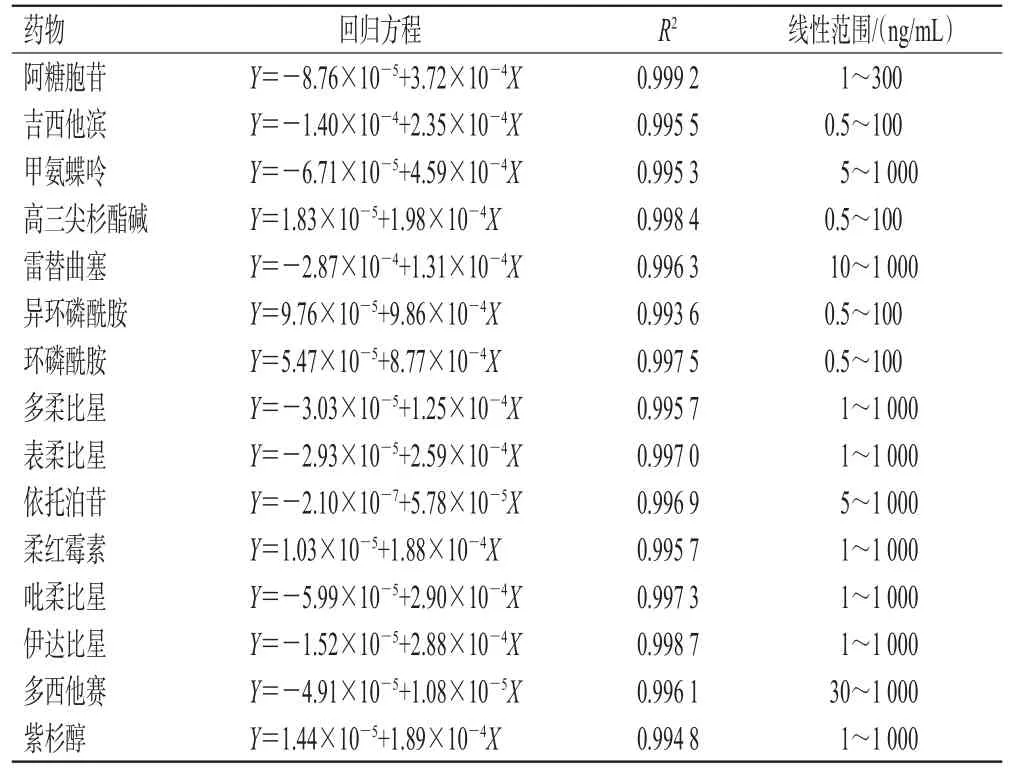
表2 阿糖胞苷等15种药物的回归方程与线性范围
2.1.5 准确度与精密度试验 按“2.1.4”项下线性范围,每种药物设置4个浓度(阿糖胞苷质量浓度设1、3、80、250 ng/mL,吉西他滨、高三尖杉酯碱、异环磷酰胺、环磷酰胺均设0.5、1、15、80 ng/mL,甲氨蝶呤、依托泊苷均设5、10、150、800 ng/mL,雷替曲塞设10、30、150、800 ng/mL,多柔比星、表柔比星、柔红霉素、吡柔比星、伊达比星、紫杉醇均设 1、3、150、800 ng/mL,多西他赛设30、80、250、800 ng/mL),按“2.1.1”项下试验条件于同一天对每个浓度平行测试5次,考察日内精密度;连续进样3 d,每个浓度平行测试5次,考察日间精密度;将实测质量浓度与理论质量浓度进行比较,以相对误差(relative error,RE)考察准确度。结果显示,15种药物的日内、日间精密度的RSD均不高于20.00%,RE为-14.04%~14.55%,符合《中国药典》的相关规定[9]。
2.1.6 稳定性试验 取“2.1.2”项下15MIX溶液,用甲醇-乙腈-水溶液稀释,得各成分质量浓度均为1 000 ng/mL的溶液。取各药物在线性范围内的溶液,用上述质量浓度为1 000 ng/mL的溶液稀释,制得低、高质量浓度的溶液(阿糖胞苷为3、250 ng/mL,吉西他滨、高三尖杉酯碱、异环磷酰胺、环磷酰胺为1、80 ng/mL,甲氨蝶呤、依托泊苷为10、800 ng/mL,雷替曲塞为30、800 ng/mL,多柔比星、表柔比星、柔红霉素、吡柔比星、伊达比星、紫杉醇为3、800 ng/mL,多西他赛为80、800 ng/mL),分别于室温下放置12、24 h时,按“2.1.1”项下试验条件进样分析,记录峰面积。结果显示,15种低质量浓度药物的RE在±20%之间;高质量浓度中除12 h的雷替曲塞、多柔比星和24 h的吉西他滨外,其余药物的RE均在±20%之间。
2.2 PIVAS环境中15种药物的残留量检测
为了检测PIVAS环境中药物的残留,本课题组首先对采样方法进行了考察,并通过此采样方法对PIVAS环境中15种药物的残留量进行检测。
2.2.1 采样方法考察 (1)擦拭材料考察。取“2.1.2”项下15MIX溶液,用甲醇-乙腈-水溶液稀释至各成分质量浓度均为1 μg/mL后,取100 μL滴于生物安全柜操作表面,分别用玻璃纤维滤纸、定性滤纸、医用纱布和无尘纸进行擦拭,按“2.1.1”项下试验条件进样分析,考察不同擦拭材料对药物回收率的影响。结果显示,除阿糖胞苷和吡柔比星外,玻璃纤维滤纸擦拭下其余13种药物的回收率均在80%~120%之间,故选择玻璃纤维滤纸作为擦拭材料。结果见图1A。
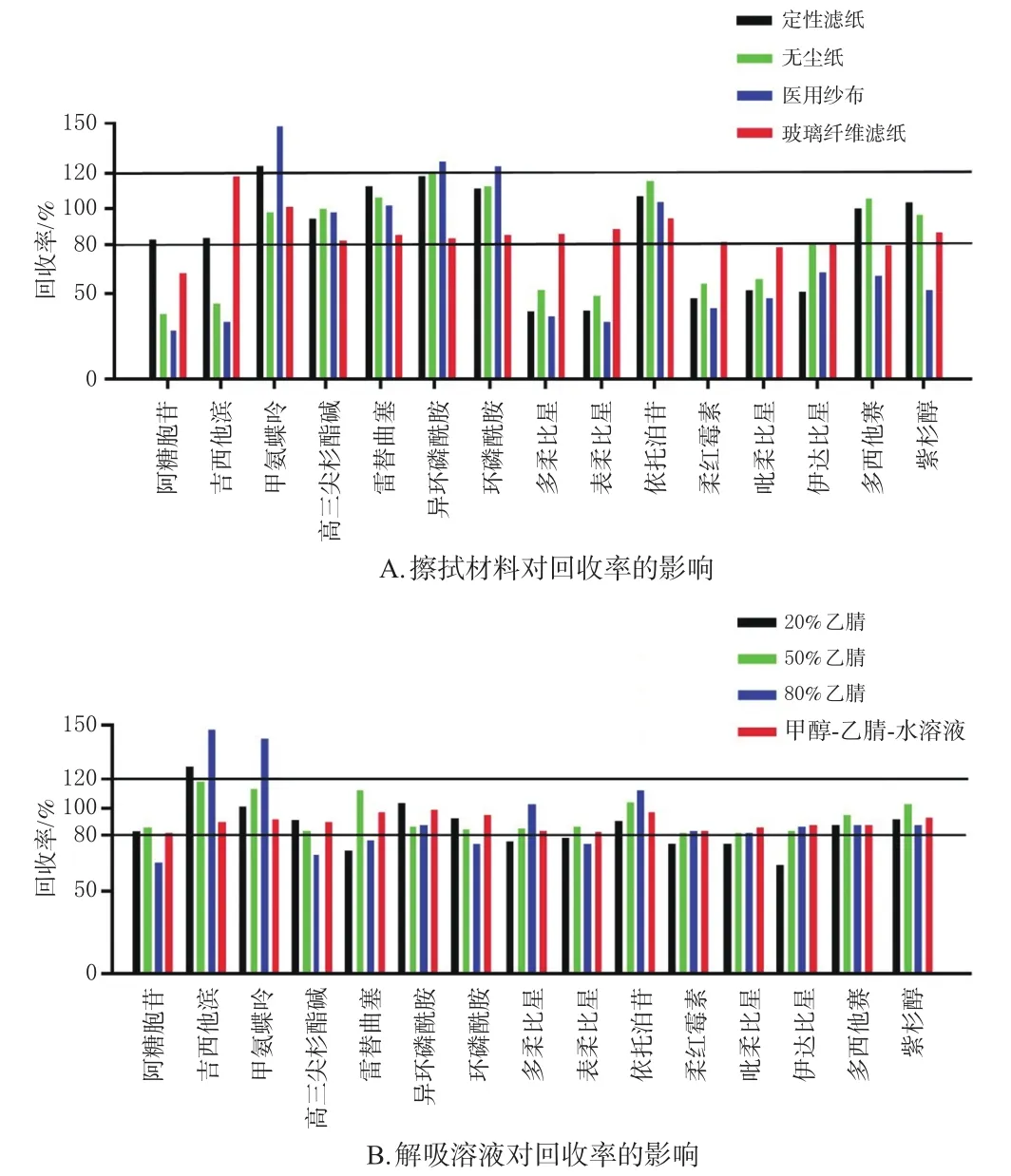
图1 不同因素对阿糖胞苷等15种药物回收率的影响
(2)解吸溶液考察。取“2.1.2”项下15MIX溶液,滴于生物安全柜操作面上,待溶液挥干。分别取50 μL20%乙腈、50%乙腈、80%乙腈、甲醇-乙腈-水溶液润湿玻璃纤维滤纸后,擦拭生物安全柜操作面,然后将上述滤纸置于1.5 mL EP管中,分别加入20%乙腈、50%乙腈、80%乙腈、甲醇-乙腈-水溶液450 μL,涡旋15 min,再超声10 min,以12 000 r/min离心20 min后,取100 μL,按“2.1.1”项下试验条件进样分析,考察不同解吸溶液对药物回收率的影响。结果显示,以50%乙腈和甲醇-乙腈-水溶液为解吸溶液时,15种药物的回收率均在80%~120%之间。由于甲醇-乙腈-水溶液更加稳定,故选择该溶液为解吸溶液。结果见图1B。
2.2.2 PIVAS环境的检测 分别于环境清洁(先用清水清洁,再用500 mg/L含氯消毒剂清洁5 min,最后用75%酒精清洁后风干)前后,将玻璃纤维滤纸用50 μL甲醇-乙腈-水溶液润湿后擦拭待测区域(表5中所示区域),擦拭后将滤纸置于1.5 mL EP管中,加入甲醇-乙腈-水溶液450 μL,按“2.2.1(2)”项下“涡旋15 min……取100 μL”操作,再根据表2中各药物的线性范围(低于定量下限的药物,需进一步浓缩上清液5倍),按“2.1.1”项下试验条件进样分析。结果显示,清洁后,共有6种药物被检出,其中环磷酰胺的残留量较高。结果见表3。
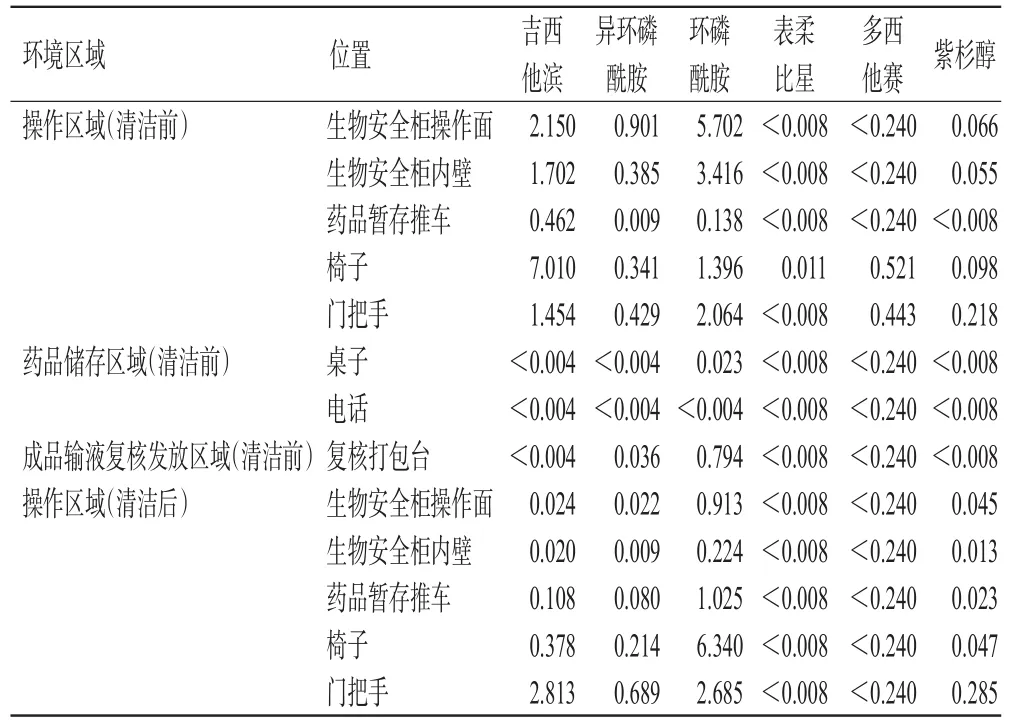
表3 PIVAS环境中吉西他滨等6种药物的检测结果(ng/cm2)
2.3 清洁流程优化
由表3可知,现有清洁程序并不能完全去除PIVAS环境中的细胞毒性抗肿瘤药物残留,加之目前也未有标准的PIVAS细胞毒性抗肿瘤药物残留清洁流程,故本课题组对常用消毒清洁剂的种类、清洁时间、浓度以及清洁程序进行了考察。
2.3.1 常用消毒清洁剂考察 含氯消毒液和苯扎溴铵溶液是PIVAS常用的消毒清洁剂。将生物安全柜操作面分为含氯消毒液区域和苯扎溴铵区域。取“2.1.2”项下15MIX溶液200 μL,滴于上述2个区域,分别用0.1%苯扎溴铵溶液1 mL、500 mg/L含氯消毒液1 mL清洁,将玻璃纤维滤纸用50 μL甲醇-乙腈-水溶液润湿后,擦拭生物安全柜操作面,擦拭后将滤纸置于1.5 mL EP管中,加入甲醇-乙腈-水溶液450 μL,按“2.2.1(2)”项下“涡旋15 min……取100 μL”操作,再按“2.1.1”项下试验条件进样分析。结果显示,含氯消毒液区域除异环磷酰胺、环磷酰胺、多西他赛和紫杉醇有残留外,其余细胞毒性抗肿瘤药物的残留量均低于定量下限,表明含氯消毒液对细胞毒性抗肿瘤药物具有较强的降解作用;苯扎溴铵溶液区域中均检出15种药物残留,表明苯扎溴铵溶液不具有降解细胞毒性抗肿瘤药物的作用。结果见表4。
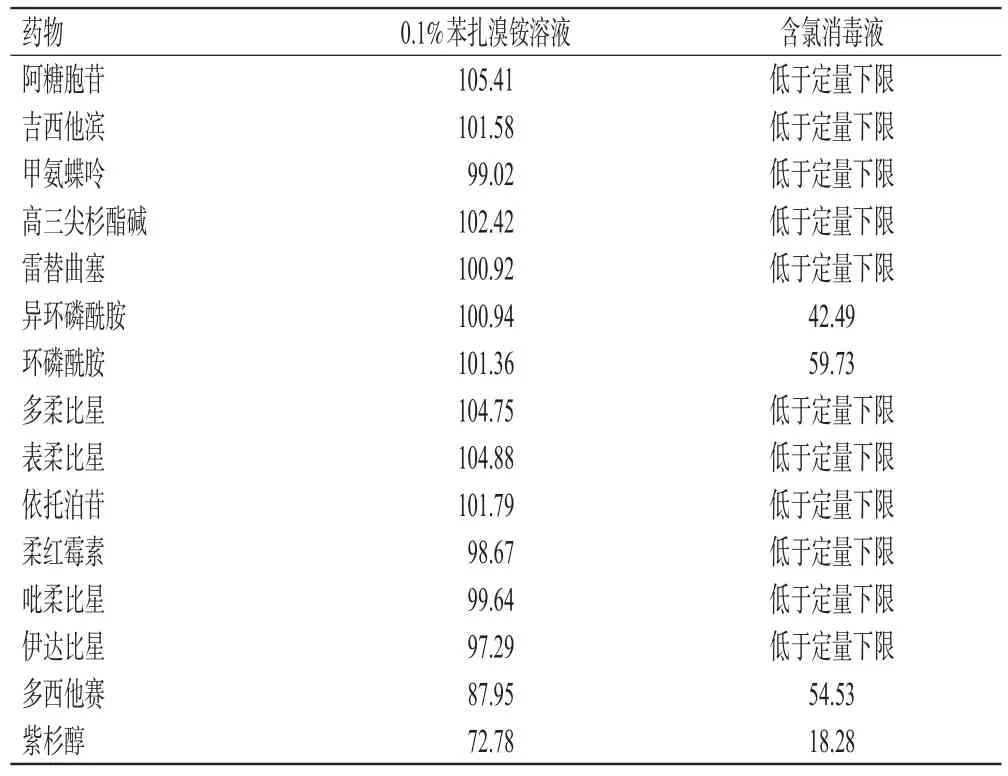
表4 常用消毒清洁剂条件下阿糖胞苷等15种药物回收率的检测结果(%%)
2.3.2 含氯消毒液消毒时间考察 取4只EP管,每管加入“2.1.2”项下15MIX溶液10 μL,在第1、5、10、15 min分别加入500 mg/L含氯消毒液10 μL,以甲醇-乙腈-水溶液990 μL终止反应后,按“2.1.1”项下试验条件进样分析。结果显示,除阿糖胞苷和吉西他滨外,其余13种药物在各时间点均降解至定量下限以下;阿糖胞苷和吉西他滨残留量随消毒时间的延长而降低,消毒5 min时的残留量显著低于消毒1 min时(P<0.05),但消毒10 min与15 min比较,残留量差异无统计学意义(P>0.05)。考虑实际工作效率,建议含氯消毒液的消毒时间为10 min。结果见图2。
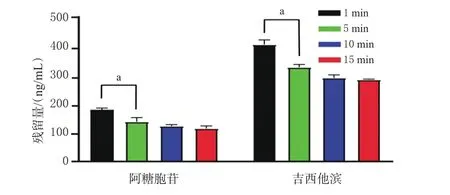
图2 含氯消毒液不同消毒时间下的药物残留量结果
2.3.3 含氯消毒液质量浓度考察 取2只EP管,每管加入“2.1.2”项下15MIX溶液10 μL,分别加入500、1 000 mg/L的含氯消毒液10 μL,消毒10 min后,加入甲醇-乙腈-水溶液990 μL终止反应后,按“2.1.1”项下试验条件进样分析。结果显示,在2种质量浓度下,除阿糖胞苷和吉西他滨外,其余13种药物的残留量均低于定量下限,且1 000 mg/L含氯消毒液时的残留量低于500 mg/L时,故建议含氯消毒液的质量浓度为1 000 mg/L。结果见图3。
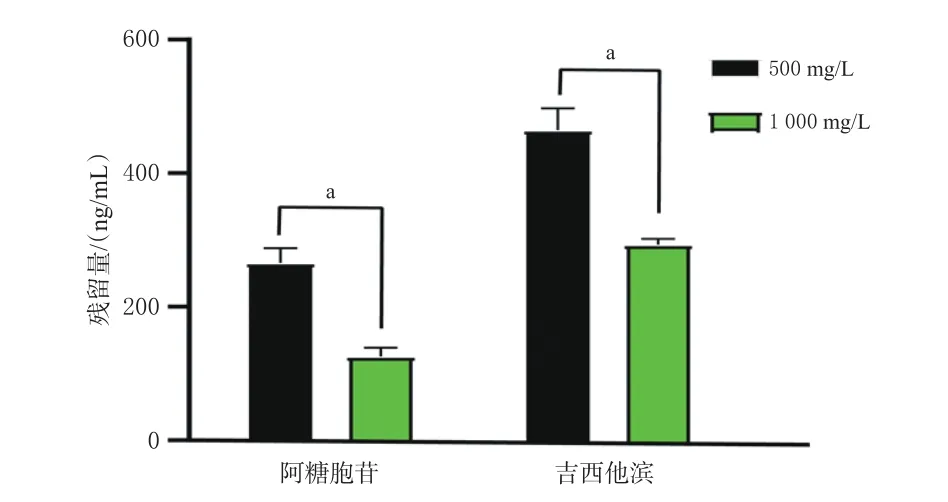
图3 含氯消毒液不同浓度下的药物残留量结果
2.3.4 清洁程序考察 清水和75%酒精是常用的细胞毒性抗肿瘤药物残留洗涤剂。用水和75%酒精擦拭生物安全柜操作面后,取“2.1.2”项下15MIX 溶液1 mL,均匀涂布于生物安全柜操作面上,待溶剂挥发后,再用不同清洁程序清洁(程序A:用清水擦拭3次后风干;程序B:用清水擦拭2次+75%酒精清洁1次后风干;程序C:用清水清洁1次+1 000 mg/L含氯消毒液清洁1次+75%酒精清洁1次后风干;程序D:用清水清洁1次+1 000 mg/L含氯消毒液清洁1次+75%酒精清洁1次后,用干纱布擦拭;程序E:用清水清洁1次+0.1%苯扎溴铵溶液清洁1次+75%酒精清洁1次后,用干纱布擦拭),将玻璃纤维滤纸用50 μL甲醇-乙腈-水溶液润湿后,擦拭生物安全柜操作面,擦拭后将滤纸置于1.5 mL EP管中,加入甲醇-乙腈-水溶液450 μL,按“2.2.1(2)”项下“涡旋15 min……取100 μL”操作,再按“2.1.1”项下试验条件进样分析。结果显示,A、B程序清洁后共检出14种药物,仅雷替曲塞未检出;C、D、E程序清洁后检出12种药物,雷替曲塞、多西他赛、依托泊苷未检出,同时,D程序清洁后药物的残留量较C、E程序清洁后低,故选择清洁程序为“清水清洁1次+1 000 mg/L含氯消毒液清洁1次+75%酒精清洁1次后,用干纱布擦拭”。结果见图4。
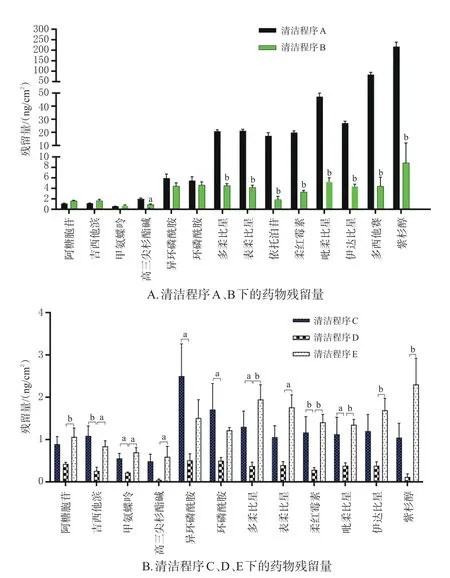
图4 不同清洁程序下的药物残留量结果
2.3.5 酒精挥发试验 取“2.1.2”项下15MIX溶液100 μL,用75%酒精400 μL稀释,制得质量浓度为10 μg/mL的溶液作为75%酒精组;另取“2.1.2”项下15 MIX溶液100 μL 2份,加甲醇-乙腈-水溶液400 μL稀释,制得质量浓度为10 μg/mL的溶液,其中1份不作氮吹处理的作为对照组,进行氮吹处理的作为甲醇-乙腈-水溶液组。将75%酒精组和甲醇-乙腈-水溶液组经氮吹风干后,以甲醇-乙腈-水溶液500 μL复溶。取上述3组溶液适量,按“2.1.1”项下试验条件进样分析。结果显示,对照组与75%酒精组各药物的残留量比较,差异无统计学意义(P>0.05),表明细胞毒性抗肿瘤药物不会随着75%酒精的挥发而造成操作区的二次污染;甲醇-乙腈-水溶液组与75%酒精组各药物的残留量比较,差异也无统计学意义(P>0.05),因此也可排除甲醇-乙腈-水溶液挥发的影响。结果见图5。
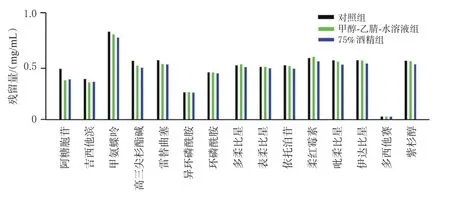
图5 酒精挥发后各药物残留结果
2.4 细胞毒性抗肿瘤药物的毒性检测
有文献报道,环磷酰胺经光降解后可产生毒性更大的降解产物[10],因此评价含氯消毒液对细胞毒性抗肿瘤药物降解作用的同时需考察其安全性。将Hacat细胞接种至96孔板中,不作处理的作为对照组,加入500 mg/L含氯消毒液10 μL的作为CI组,加入15MIX溶液10 μL的作为15MIX组,加入500 mg/L含氯消毒液处理过的15MIX溶液10 μL的作为15MIX+CI组。细胞培养24 h(5%CO2、37 ℃)后,每组加入CCK-8溶液10 μL,温育3 h,通过酶标仪于450 nm波长处检测细胞活力。结果显示,与对照组比较,15MIX组细胞生存率显著下降(P<0.01);与15MIX组比较,15MIX+CI组的细胞生存率显著升高(P<0.01),表明含氯消毒液能降低药物毒性。结果见图6。
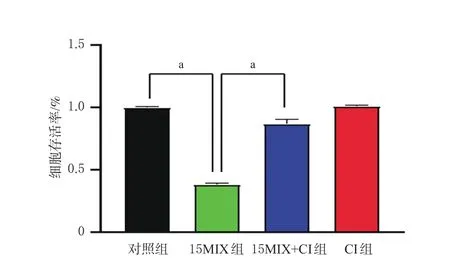
图6 细胞毒性抗肿瘤药物的毒性检测结果
3 讨论
与传统临床科室配药相比,PIVAS在配备防护服、口罩、手套等防护工具的前提下,于生物安全柜内进行药物调配,能显著降低医护人员职业暴露的风险[11-12]。然而,由于防护能力有限,虽集中调配药品,但是细胞毒性抗肿瘤药物的转运、存储、配制等环节仍然易发生职业暴露[13]。医护人员与细胞毒性抗肿瘤药物的频繁接触,使得毒性药物在医护人员体内蓄积,从而存在白细胞减少、胎儿畸形、流产、致癌等潜在危险[14]。
本研究建立了15种药物残留定量采集与检测的UPLC-Q/Orbitrap-HRMS方法,并评估了方法的准确度与精密度、线性范围、稳定性、回收率等指标,为细胞毒性抗肿瘤药物残留的快速评估提供了理论及方法依据。本研究结果显示,我院PIVAS操作区域有较高的细胞毒性抗肿瘤药物残留量,主要包括吉西他滨、环磷酰胺及紫杉醇等;虽然采用了严格的调配操作及清洁程序,但仍有不同程度的细胞毒性抗肿瘤药物残留,医护人员可能会因防护不到位或者重视程度不够,而引起职业暴露。
含氯消毒液是PIVAS常用的清洁消毒剂之一,但含氯消毒液的最佳使用浓度、方法及安全性评价未见报道。本研究发现,与0.1%苯扎溴铵溶液比较,含氯消毒液对细胞毒性抗肿瘤药物具有明显的降解作用,以1 000 mg/L含氯消毒液降解作用更强。采用清水、1 000 mg/L含氯消毒液、75%酒精依次擦拭,最后用干纱布擦拭残留溶剂的清洁程序可显著降低细胞毒性抗肿瘤药物的残留。同时,本研究通过CCK-8实验也证明,含氯消毒液能显著降低细胞毒性抗肿瘤药物的毒性,且残留药物不会随酒精挥发而造成操作区域的二次污染。
本研究的局限性为:受研究条件、方法及时间的限制,本研究未对细胞毒性抗肿瘤药物院内物流、冲配操作对环境的影响等进行评估。笔者将在后续研究中通过建立统一的细胞毒性抗肿瘤药物标准化环境监测与管理平台,辅助药学部门做好内部质量控制,减少医护人员的职业暴露风险。
