CGRP/ASIC3参与大鼠食道扩张内脏痛模型中背根神经节神经元高敏感机制的研究
2023-02-08许草顾勇石亚婷汪桂祥牛小平
许草,顾勇,石亚婷,汪桂祥,牛小平
(1.皖南医学院研究生院,安徽 芜湖 241002;2.皖南医学院弋矶山医院儿科;3.皖南医学院弋矶山医院消化内科)
食管内脏高敏感在非糜烂性反流病发病机制中的作用日益受到重视,深入了解内脏高敏感的细胞与分子机制可为临床治疗提供重要的理论依据。脊髓背根神经节(DRG)神经元作为内脏痛觉信号传导与调控的初级靶点,是目前内脏高敏感的研究热点之一[1]。研究表明,当大鼠应激发生内脏高敏感反应时,其DRG 神经元兴奋性显著提高[2]。酸敏感离子通道3(ASIC3)在感受体液pH 值和调控痛觉方面有着重要作用[3]。Hattori等[4]研究发现,ASIC3 基因敲除小鼠肌肉痛和心脏痛传入的DRG 神经元中,表达酸诱导电流的神经元大量减少。在小鼠急性关节炎疼痛模型中,ASIC3 仅在降钙素基因相关肽(CGRP)表达阳性的DRG 神经元中表达,且ASIC3 的表达随CGRP表达上调而上调[5]。然而,ASIC3 与CGRP在食管内脏痛中的具体作用尚不清楚。本研究将建立大鼠食管扩张(ED)内脏痛模型[6],探讨ASIC3 与CGRP参与大鼠ED 内脏痛模型中DRG 神经元兴奋性改变的可能机制,并揭示CGRP是否通过调节ASIC3 表达与功能改变,参与大鼠ED 内脏痛模型中DRG神经元高敏感性的发生。
1 材料与方法
1.1 实验动物及分组 健康雄性SD 大鼠50 只,6~8 周龄,体重220~250 g,上海杰思捷公司提供,实验动物许可证号SYXK(沪)2008-0021。单笼饲养,在动物实验室适应1周后开始实验。将大鼠随机分成2组,实验组30只,对照组20只。
1.2 动物模型的建立和DRG 神经元分离培养 于SD 大鼠腹腔注射氯胺酮(75 mg/kg)与赛拉嗪(10 mg/kg)麻醉,于中上腹部沿腹中线逐层打开腹腔,切口为(2.5±0.5)cm,暴露胃,分离胃底和贲门周围结缔组织,将食道向腹腔牵拉,暴露食管下段,于食管壁多点注射5 μmol/L的1,1'-二十八烷基-3,3,3',3'-四甲基吲哚羰基花青高氯酸盐(DiI)乙醇溶液(7~8点,1 μl/点)。采用荧光逆行示踪技术进行标记DRG 神经元,被标记的DRG 神经元为食道特异DRG 神经元。注射DiI 10 d 后,所有大鼠常规腹腔注射麻醉,利用PE-240 管对实验组大鼠的胸段食管进行1 h 重复ED刺激,对照组则不予处理[7]。
1.3 DRG 神经元分离培养 ED 刺激结束后30 min,颈椎脱臼处死2 组大鼠,取出胸段脊髓两侧的DRG,经过洗涤、消化、离心等步骤,逐步分离DRG 细胞[7]。其中随机选取15份实验组样本加入CGRP8-37(10 mol/L,美国Sigma 公司)。根据培养液中有无加入CGRP8-37将实验组进一步分为ED组(n=15)和ED+CGRP8-37组(n=15)。
1.4 全细胞膜片钳技术记录DRG 神经元动作电位频率及形态的改变 DiI 标记的DRG 神经元在荧光显微镜下呈橘红色,对DiI 标记的电容<40 pF的神经元的动作电位频率及形态改变进行记录[7]。
1.5 免疫荧光检测技术记录DRG 神经元中CGRP与ASIC3 的表达定位 对ED 组及对照组DRG 细胞进行固定和透化、封闭、抗体孵育,最后用显微镜(德国Leica公司)采集图片,核染色采用4',6二脒基-2-苯基吲哚(DAPI)[7]。
1.6 逆转录实时聚合酶链反应(qRT-PCR)法检测CGRP与ASIC3 mRNA 表达 所有采集的标本均在24 h 内进行检测,检测前将标本置于微量振荡器上震荡1 min,充分混匀后,按照CGRP、ASIC3 核酸测定试剂盒(德国Qiagen 公司;美国Ambion 公司)及PCR 扩增仪(美国Applied Biosystems 公司)使用指导书规定的方法进行。整个试验操作均严格按照操作规范进行,采用β-actin为内参,同时做阴性和阳性对照,均在控。结果判读以试剂说明书为准,本实验所有的PCR 引物序列及扩增片段:CGRP上游引物:5'-CTCTCAGCAGCATGTGGGT-3',下游引物:5'-TAACTCATTTATACTTGGTTTCA-3',扩增片段554 bp;ASIC3 上游引物:5'-CCCAGCTCTGGACGCTATG-3',下游引物:5'-TCTTCCTGGAGCAGAGTGTTG-3',扩增片段414 bp;β-actin上游引物:5'-TAAAGACCTCTATGCCAACACAGT-3',下游引物:5'-CACGATGGAGGGGCCGGACTCATC-3',扩增片段:241 bp。
1.7 Western blot 法检测CGRP 与ASIC3 蛋白表达 按照BCA Kit(美国Thermo Pierce 公司)说明书进行操作。提取组织蛋白,制备蛋白样品,采用α-tublin 为内参,进行电流强度确定、转膜及封闭,得出蛋白电泳条带,并测量各蛋白值。
1.8 全细胞膜片钳技术测定DRG 神经元中ASIC3电流 应用全细胞膜片钳技术,采用ASIC3 特异性阻断剂APETx2(英国Tocris 公司)将ASIC3 电流与其他电流区分开。检测正常及ED 刺激后大鼠ASIC3通道离子电流的变化。
1.9 统计学方法 采用SPSS 24.0 软件进行统计学分析,符合正态分布的计量资料采用独立样本t检验或单因素方差分析;不符合正态分布的计量资料采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 ED 刺激使DRG 神经元高敏感性发生 全细胞膜片钳技术记录结果显示,给予大鼠1 h 重复ED 刺激后,大鼠胸段脊髓DRG 神经元受去极化刺激产生的动作电位频率明显增多,所记录的ED组DRG 神经元动作电位个数与对照组比较差异有统计学意义(P<0.01),见图1。

图1 全细胞膜片钳技术记录DRG神经元动作电位个数
2.2 CGRP 与ASIC3 在DRG 神经元中共表达 免疫荧光结果显示,CGRP 主要表达于DRG 神经元细胞质中,ASIC3 主要表达于DRG 神经元细胞质和细胞膜中,DRG 神经元细胞核由DAPI 染色,将CGRP 表达与ASIC3 表达叠加后发现,两者在DRG 神经元中存在共表达;且ED 组DRG 神经元中CGRP与ASIC3表达较对照组密集,见图2。
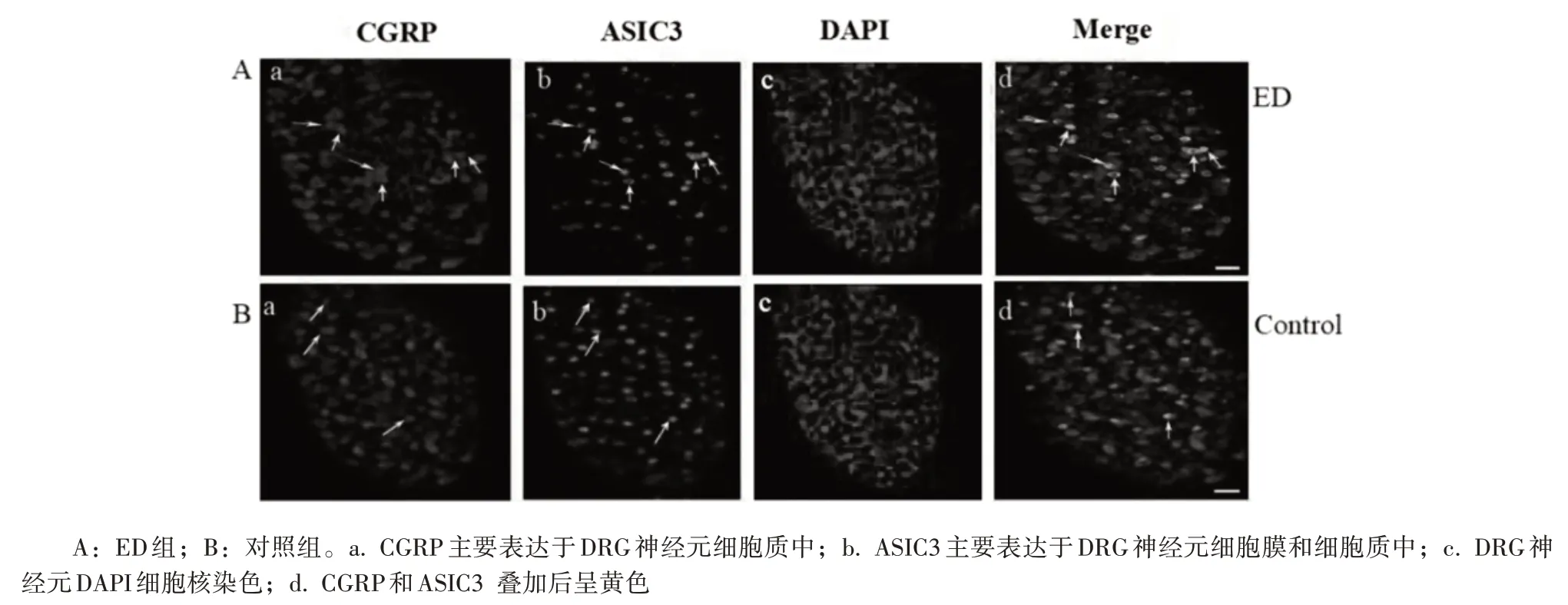
图2 免疫荧光技术检测CGRP与ASIC3在DRG神经元中的表达定位(箭头所示)(scale bar=50 μm)
2.3 ED 刺激使DRG 神经元中CGRP、ASIC3 mRNA 和蛋白表达上调 qRT-PCR 和Western blot检测结果显示,与对照组比较,ED 组DRG 神经元中CGRP、ASIC3 mRNA 和蛋白表达水平显著上调(P<0.01);ED 组CGRPmRNA 与ASIC3 mRNA 表达呈正相关(r=0.833,P<0.01),CGRP蛋白与ASIC3 蛋白表达呈正相关(r=0.981,P<0.01),见图3、图4。
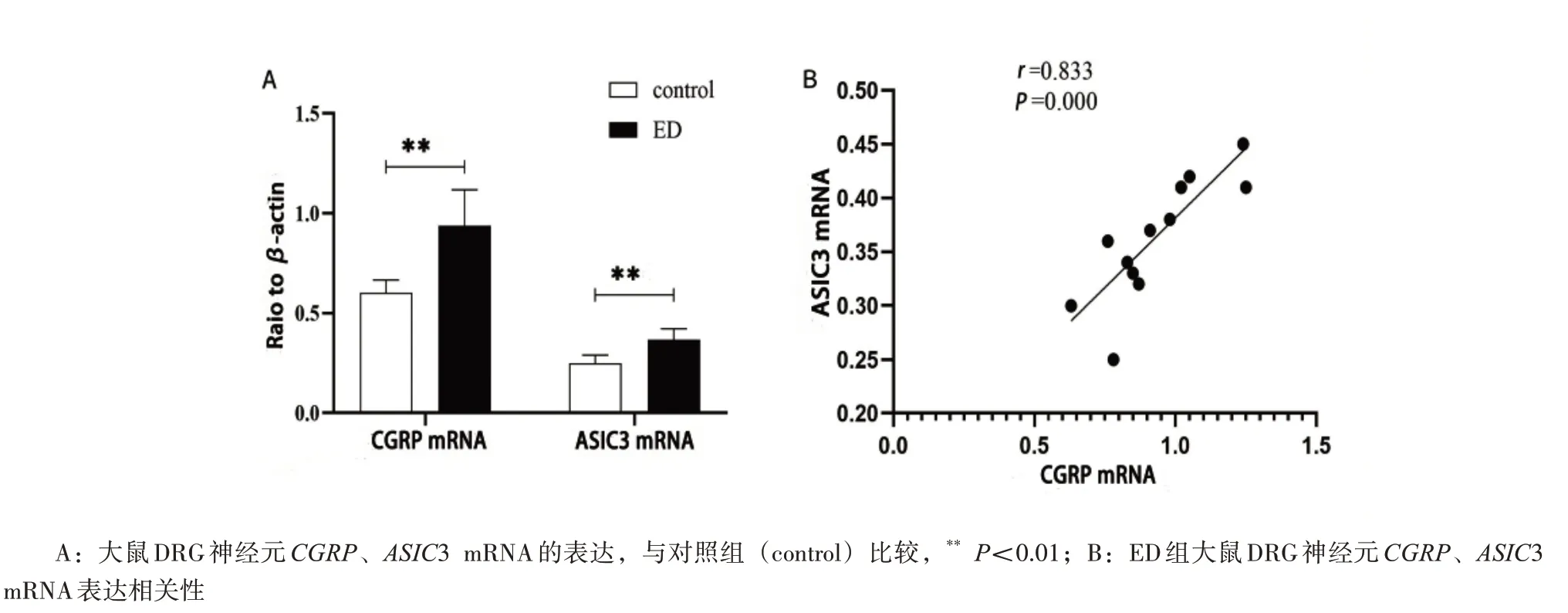
图3 qRT-PCR检测大鼠DRG神经元CGRP、ASIC3 mRNA 的表达
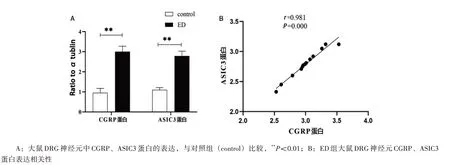
图4 Western blot检测大鼠DRG神经元中CGRP、ASIC3蛋白的表达
2.4 ED 刺激与CGRP8-37 影响DRG 神经元中ASIC3 电流变化 全细胞膜片钳技术记录结果显示,ED 组 和ED+CGRP8-37 组DRG 神经元中ASIC3 电流较对照组显著增加(P<0.01);与ED组比较,ED+CGRP8-37 组DRG 神经元中ASIC3电流显著减少(P<0.01),见图5。
3 讨论
非糜烂性反流病是指胃-十二指肠内容物反流至食管,引起反流、烧心等症状,但无食管黏膜破损或Barrett 食管表现的疾病,是胃食管反流病中最常见类型。长期反复的酸暴露使食管上皮感觉受体和黏膜下层神经元致敏,形成食管内脏高敏感[8-10]。部分非糜烂性反流病对质子泵抑制剂(PPIs)疗效差,可能由于PPIs 不能解决内脏高敏感[11-13],明确食管内脏高敏感发生机制可为临床治疗提供重要理论依据。
在既往研究中发现,给予大鼠1 h 重复ED 刺激后,胸段脊髓DRG 神经元受到去极化刺激产生的动作电位数量较对照组明显增多(P<0.01),且DRG 神经元细胞膜和细胞质中ASIC3 的表达分布较对照组密集[7]。本研究也同样证实了这点,本研究还通过qRT-PCR 及Western blot 法检测发现,ED组ASIC3 mRNA及蛋白表达水平显著高于对照组(P<0.01);全细胞膜片钳技术记录的ED组DRG 神经元细胞中ASIC3 电流也较对照组显著增加(P<0.01)。由此可见,在ED 诱导的大鼠内脏痛模型中,ASIC3 参与了DRG 神经元高敏感性发生,增加食管内脏敏感性。酸诱导的ASIC3 能被快速激活并介导稳态电流,进一步诱发DRG 神经元的动作电位。此外,过度表达的ASIC3 可能会改变DRG 神经元中相关离子通道的通透性,产生异位放电,导致痛觉过敏。
CGRP是一种由37 个氨基酸残基组成的感觉性神经肽,由感觉神经末梢释放,广泛分布于中枢神经系统及外周组织,参与伤害性信息的传递和痛觉敏感化,属痛觉一级传递兴奋性神经递质[14-15]。本研究发现,在大鼠ED 内脏痛模型中,CGRP 与ASIC3 在胸段脊髓DRG 神经元中存在共表达。ED 组CGRPmRNA 及蛋白表达水平较对照组显著上调(P<0.01),且CGRPmRNA、蛋白表达与ASIC3 mRNA、蛋白呈明显正相关(P<0.01)。由此可推测,CGRP与ASIC3 可能共同参与食管内脏高敏感的发生。为进一步证实推测,我们通过向DRG 神经元细胞的培养液中加入CGRP8-37 来观察DRG 神经元中ASIC3 电流变化,CGRP8-37 作为CGRP 的受体拮抗剂,可对CGRP竞争性抑制。最终检测结果显示,ED+CGRP8-37组ASIC3 电流较ED 组明显减少(P<0.01)。这说明CGRP及CGRP受体参与调节DRG 神经元中ASIC3 的功能表达。在DRG 神经元中,CGRP对ASIC3 的功能表达有正向调节作用,但CGRP及其受体是如何参与调节ASIC3 的功能表达呢?目前具体作用机制尚不明确。有实验证实,CGRP与CGRP受体特异性结合后,可激活腺苷酸环化酶(AC),催化ATP 转变为cAMP,促进cAMP 浓度上调,激活cAMP 依赖性蛋白激酶A(PKA),进而表现出高度多样的生物学活性,包括炎性介质释放、靶蛋白表达增加、离子通道开放等,从而影响痛觉的产生[16-18]。CGRP可能就是通过与CGRP受体结合后激活AC-cAMP-PKA 信号传导通路,诱导改变ASIC3 功能表达,使细胞去极化,增加DRG 神经元兴奋性,从而影响痛觉信号的传导,但这需要进一步实验证实。
综上所述,内脏高敏感的发生是由多因素共同参与的复杂过程,主要涉及外周敏感化和中枢敏感化,初级传入神经元敏感化是中枢敏感化发生的必要条件[19-20]。所以了解初级传入神经元敏感化机制对抑制痛觉信号的传导无疑具有重要意义。本研究成功构建了食道扩张内脏痛动物模型,从ASIC3 表达及功能改变的机制入手,进一步研究ED 内脏痛动物模型中DRG 神经元兴奋性改变的机制,并揭示CGRP可能通过调节ASIC3表达及功能改变,参与ED 内脏痛动物模型中DRG 神经元高敏感性的发生,为非糜烂性反流病内脏高敏感的靶向治疗提供初步的理论依据。
