巨菌草根际高效解磷菌的筛选
2023-02-08周童晖卜建超张皓珊苏德伟罗海凌林冬梅林占熺
周童晖, 卜建超, 张皓珊, 苏德伟, 林 辉, 罗海凌, 林冬梅, 林占熺
(1.福建农林大学国家菌草工程技术研究中心;2.福建农林大学生命科学学院,福建 福州 350002)
巨菌草(CenchrusfungigraminusZ. X. Lin & D. M. Lin & S. R. Lan sp. nov.),隶属于蒺藜草属(CenchrusL.)[1],因其生长速度快、分蘖能力强、根系发达、产量高、适应性强可在不同环境条件下种植,具有较高的经济价值[2-3].
磷是巨菌草生长发育过程中不可或缺的重要矿质元素,我国土壤总磷含量丰富,但固态磷含量高达95%,植物可以直接利用的可溶性磷含量低于5%[4].土壤中的磷素主要分为有机磷和无机磷,有机磷含量约占总磷的20%~50%[5].土壤中的有机磷主要来源于动物粪便、动植物残体以及人类活动产出物[6].磷化肥的施用在一定程度上缓解了“磷贫瘠”现象,但同时会出现许多生态破坏问题,近年来国家农药化肥两减政策出台,如何释放出土壤中的固态磷成为了研究热点.研究表明,解磷菌可以释放被土壤固定的磷元素,提高土壤中磷素的利用率,从而减少磷肥的使用量[7].以微生物菌肥部分或全部代替化学肥料对环境更友好,对于实现生态可持续发展具有重要价值[8-10].解磷微生物主要分为两类,分别溶解固态无机磷和固态有机磷.两类解磷微生物在土壤中广泛分布,能减少磷肥被土壤固定,提高施入磷肥的利用率,溶解土壤中的不溶性磷,并通过产胞外酶和有机酸来刺激植物生长[11-12].
目前已从各类生态环境中分离培养出多种解磷微生物.如:高威等[13]筛选出一株唐菖蒲伯克霍尔德氏菌,将该菌株制作成菌肥对辣椒幼苗有明显的促生长作用;孙健等[14]将紫变异链霉菌制成液体菌剂可显著提高油菜株高和鲜质量,且低肥力土壤的促生长效果优于高肥力土壤;王君等[15]从黄河三角洲地区盐碱化耕地的农作物根际土壤中分离筛选出杓兰泛菌株B19,将其接种在盐碱化土壤中可使有效磷含量提高36.2%,并且可显著提高小麦株高、根长、株鲜质量和根鲜质量.
本试验立足于筛选具备优良解磷能力的菌株,对其固氮能力、生长素的产生等多种促生性能展开研究,并用小麦盆栽试验验证其促生性能,旨在丰富微生物菌肥种质资源库,为该菌株的开发提供科学依据.
1 材料与方法
1.1 土壤取样
样品采集地信息如表1所示,在6个地区的菌草试验基地采用5点取样法采集成熟期巨菌草根际土壤.将采集的土壤样品放入灭菌玻璃瓶中于4 ℃保存,并迅速带回实验室处理.
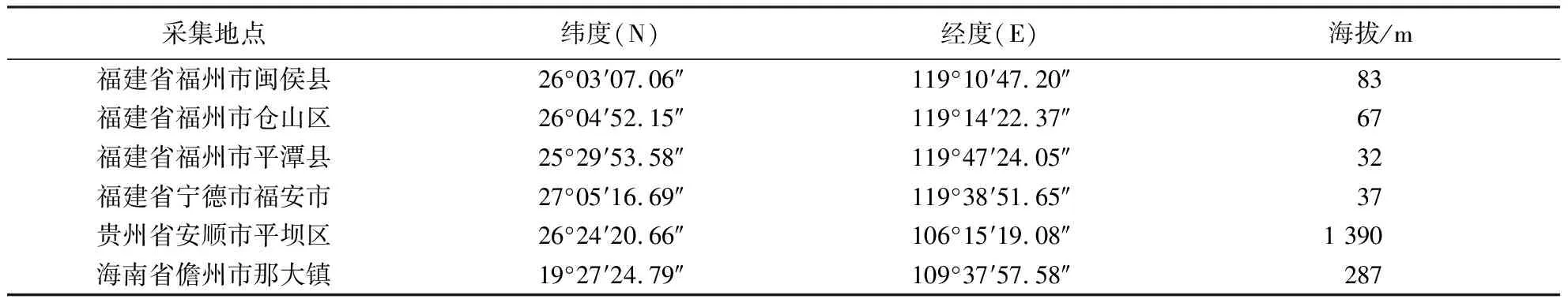
表1 样品采集地点信息Table 1 Sampling site information
1.2 培养基配制
1.2.1 牛肉膏蛋白胨培养基 含3 g牛肉膏、10 g蛋白胨、18 g琼脂、5 g NaCl,加蒸馏水至1 L.
1.2.2 有机磷固体培养基 含1 L牛肉膏蛋白胨培养基,灭菌后加入蛋黄液(含30 mL 0.9%生理盐水、30 mL蛋黄)[16].
1.2.3 有机磷液体培养基 含10 g葡萄糖、0.5 g (NH4)2SO4、0.3 g NaCl、0.3 g MgSO4、0.03 g FeSO4、0.03 g MnSO4、5.0 g CaCO3、0.3 g KCl、2 g卵磷脂、0.5 g酵母膏,加蒸馏水至1 L,pH为7.2~7.4.
1.2.4 LB液体培养基 含5 g酵母浸粉、10 g胰蛋白胨、10 g NaCl,加蒸馏水至1 L[17].
1.3 解磷菌的分离和筛选
1.3.1 分离 在灭菌的三角瓶中加入10 g新鲜土样、100 mL无菌水,于37 ℃、180 r·min-1振荡40 min,静置10 min.以无菌水为溶质设置10-2、10-3、10-4、10-5、10-6梯度稀释土壤原液.将梯度稀释液分别涂布在有机磷固体平板培养基上,分离细菌的平板倒扣在37 ℃恒温培养箱中培养5 d.将能产生溶磷圈的菌株挑出,反复划线,直到得到纯菌株.
1.3.2 筛选 将代表菌株接种在有机磷固体培养基上,每个菌株重复接种到3个相同的培养基中,于37 ℃培养7 d,观察菌落周围有无透明溶磷圈.采用十字交叉法测量溶磷圈直径(D)和菌落直径(d),计算菌株解磷能力.溶磷指数(α)=D/d[18].α越大表示菌株解磷能力越强,当α为1时则表示菌株无解磷能力[19].
采用钼锑抗比色法[20]测定离心后上清液中的可溶性磷含量,设置3次平行试验.
选取溶磷指数和产磷量均表现最佳的解磷菌PJS-18进行进一步研究.
1.4 解磷菌磷酸酶活性的测定
碱性、酸性磷酸酶活性分别采用碱性、酸性磷酸酶活性测定试剂盒(苏州格锐思生物科技有限公司)测定,设置3次平行试验.
1.5 PJS-18菌株的鉴定
1.5.1 菌落形态特征 参照《常见细菌系统鉴定手册》[21]的方法鉴定.
1.5.2 革兰氏染色 采用革兰氏染色液试剂盒(北京索莱宝科技有限公司)鉴定.
1.5.3 生理生化特征 采用细菌生化鉴定管(青岛海博生物技术有限公司)进行甲基红、乙酰甲基甲醇(V-P)、硝酸盐还原、淀粉水解、明胶液化、产氨、硫化氢、脲酶等试验,均设置3次平行试验.
1.5.4 系统发育树的构建 采用快速无毒DNA提取试剂盒提取菌株DNA,以细菌通用引物27F和1492R对代表菌株进行PCR扩增.PCR的反应体系和反应程序参见2×TaqPlus Master MixII试剂说明书(南京诺唯赞生物科技股份有限公司).将产物送至上海生物工程技术服务有限公司进行序列鉴定,所得测序结果在NCBI数据库中通过Blast搜索同源序列,采用Mega X软件进行序列同源性比对分析,采用邻接法构建系统发育树.
1.6 PJS-18菌株促生特性的测定
1.6.1 PJS-18菌株产IAA、ACC脱氨酶、固氮酶的能力 细菌固氮酶活性和生长素IAA浓度均采用ELISA试剂盒(上海羽朵生物科技有限公司)测定;ACC脱氨酶活性采用Penrose et al[22]的方法测定.以上测定均设置3次平行试验.
1.6.2 盆栽验证试验 将PJS-18菌株接种至LB液体培养基中,于37 ℃、180 r·min-1摇床培养12 h,待菌液在600 nm波长下的光密度(D)为1时将菌液离心,收集菌体,用无菌蒸馏水稀释.设置10倍稀释液为高浓度菌液,20倍稀释液为低浓度菌液,以无菌水为对照.
小麦盆栽试验设计如表2所示.选取长势均一、高为(2±0.3) cm的小麦苗种植于营养钵中,浇透水后置于人工气候室(温度25 ℃、光照∶黑暗=12 h∶12 h)培养,每天观察并记录麦苗生长情况.缓苗3 d后,第1次浇灌处理液;待麦苗生长1周后,第2次浇灌处理液;待麦苗生长15 d时测量麦苗的叶长、主根长、株高、地上部干质量和鲜质量、地下部干质量和鲜质量,用根系扫描仪检测根系长度、根表面积、根直径.

表2 盆栽试验设计Table 2 Pot experiment design
1.7 数据处理
数据以平均值±标准差表示,采用Microsoft Excel 2016软件处理,采用SPSS 23软件中的单因素方差分析法进行多重比较.
2 结果与分析
2.1 解磷菌的分离和筛选
因解磷菌存在根际效应[23],故从6个样品采集地分离纯化出73株解磷菌,采用透明溶磷圈法初步筛选出8株代表菌株(表3).表3显示,8株代表菌株的溶磷指数为1.46~2.19,均大于1.其中,N-7菌株的溶磷指数为1.46,解磷能力最弱;PJS-18菌株的溶磷指数为2.19,解磷能力最强.只凭借溶磷指数断定菌株解磷能力太过片面,需要结合液体培养基中的可溶性磷含量综合判定[24].表3还显示,8株代表菌株产生的可溶性磷含量为34.72~82.87 mg·L-1.其中,PJS-18菌株产磷量最高,产生的可溶性磷含量达82.87 mg·L-1;HN-12菌株产磷量最低,产生的可溶性磷含量为34.72 mg·L-1.PJS-18菌株在溶磷指数和产磷量两项筛选指标中均表现最佳,故选取综合能力排名第一的PJS-18菌株进行进一步研究.

表3 8株代表菌株的溶磷指数和产磷量 Table 3 Phosphate solubilization index and soluble phosphorous yield of 8 representative strains
2.2 解磷菌磷酸酶活性
由图1可知,8株代表菌株的碱性磷酸酶活性为25.77~87.17 μmol·min-1·L-1,酸性磷酸酶活性为6.24~23.94 μmol·min-1·L-1.碱性磷酸酶在活性上占绝对优势,判断菌株以分泌碱性磷酸酶为主,推断碱性磷酸酶在菌株解磷功能上发挥着重要作用.
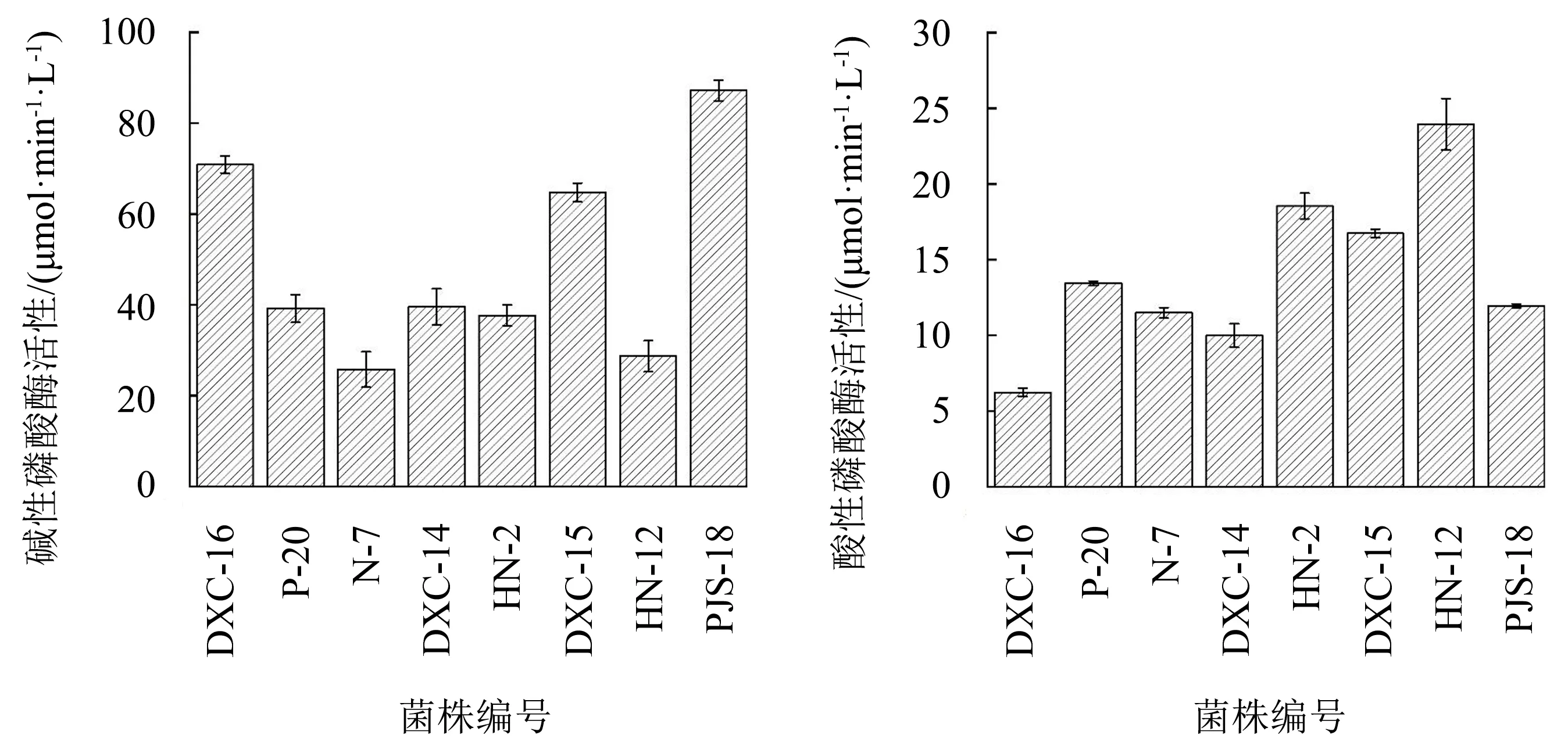
图1 8株代表菌株的碱性磷酸酶和酸性磷酸酶活性Fig.1 Alkaline phosphatase and acid phosphatase activities of 8 representative strains
2.3 PJS-18菌株鉴定结果
2.3.1 菌落形态特征 PJS-18菌株在LB固体培养基上呈现不规则、边缘不整齐、淡黄不透明、干燥扁平、皱皮的菌落形态特征(图2).
2.3.2 革兰氏染色结果 革兰氏染色后镜检显示,PJS-18菌株呈阳性反应,染色均匀呈紫色,杆状不成链(图3).
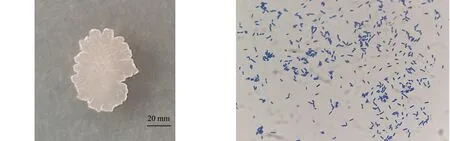
图2 PJS-18菌落形态Fig.2 Colony morphology of strain PJS-18
2.3.3 生理生化特征 PJS-18菌株在乙酰甲基甲醇、硝酸盐还原、淀粉水解、脲酶、产氨、明胶液化试验中呈阳性反应,在甲基红、硫化氢试验中呈阴性反应.
2.3.4 系统发育树的构建 PJS-18菌株经16S rDNA扩增得到1 600 bp左右的条带,扩增产物经测序后所获得的序列在NCBI数据库采用Mega X软件进行序列同源性比对分析,利用邻连法构建系统发育树.结果(图4)显示,PJS-18菌株与枯草芽孢杆菌(Bacillussubtilis)位于同一系统发育分支上.综合PJS-18菌株的生理生化特征、形态特征和16S rDNA序列结果,初步确定PJS-18菌株为枯草芽孢杆菌.

图4 PJS-18菌株的系统发育树Fig.4 Phylogenetic tree of strain PJS-18
2.4 PJS-18菌株的促生特性
2.4.1 PJS-18菌株产IAA、ACC脱氨酶、固氮酶的能力 PJS-18菌株产生的IAA浓度为8.65 nmol·L-1,ACC脱氨酶活性为27.43 μmol·min-1·mg-1,固氮酶活性为180.3 U·L-1.表明PJS-18菌株可产生一定量的IAA、ACC脱氨酶及大量的固氮酶.固氮酶可以在自然环境下固氮成氨,是固氮微生物的主要催化剂,它能将氮从生物体无法直接利用的分子氮转化为可直接利用的氨态氮[25].
2.4.2 盆栽验证结果 表4~5显示:有机肥+低浓度菌液组小麦的叶长、株高、主根长较有机肥对照组分别提高了11.26%、12.01%、14.93%;小麦地上部干质量、鲜质量,地下部干质量、鲜质量较有机肥对照组分别提高了12.07%、38.46%、21.70%、30.90%;小麦的根系长度、根表面积、根直径、根体积较有机肥对照组分别提高了53.30%、56.79%、3.13%、60.00%.各组小麦生长情况的优劣表现为:有机肥+低浓度菌液组>有机肥对照组>有机肥+高浓度菌液组>空白对照组.
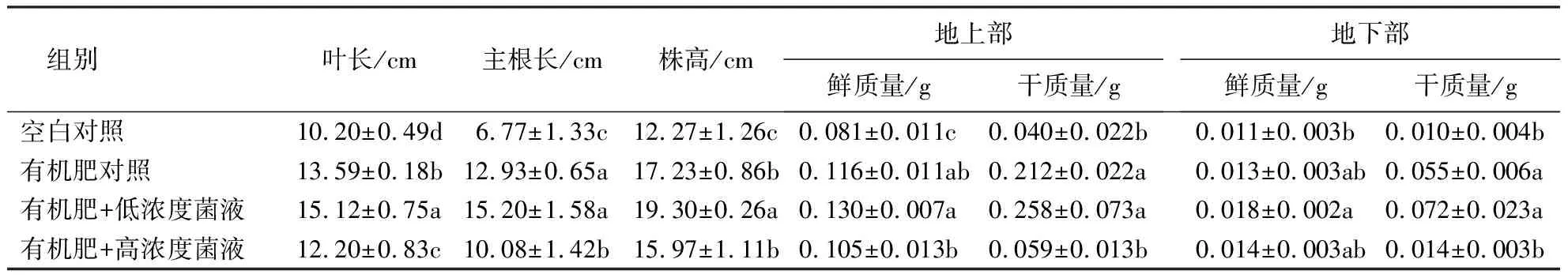
表4 不同处理小麦的促生效果1)Table 4 Growth-promoting effect of different treatments on wheat
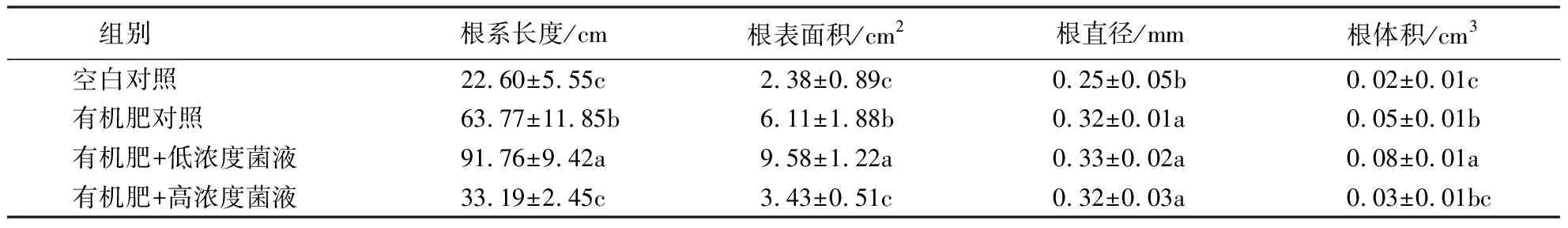
表5 不同处理小麦根系的生长情况1)Table 5 Root growth of hydroponic wheat under different treatments
可见,在施用的有机肥中添加低浓度PJS-18菌液可显著促进小麦生长,但在施用的有机肥中添加高浓度菌液则会抑制植株对有机肥的吸收.
3 讨论与结论
目前为止已有许多学者对解磷微生物有较多研究,如从达乌里胡枝子[26]、磷高效转基因水稻[27]等植物根系和根际土壤获得解磷菌株,菌株包含芽孢杆菌属Bacillius、根瘤菌属Rhizobium、青霉属Penicillium等[28].本研究从巨菌草根际土壤中筛选出一株优质解磷菌PJS-18,初步鉴定为枯草芽孢杆菌;该菌株在有机磷固体培养基中培养7 d时的溶磷指数为2.19,在有机磷液体培养基中培养7 d时产生的可溶性磷含量达82.87 mg·L-1;该菌株碱性磷酸酶活性为87.17 μmol·min-1·L-1,酸性磷酸酶活性为11.94 μmol·min-1·L-1;该菌株产生的IAA浓度为8.65 nmol·L-1,固氮酶活性为180.3 U·L-1,ACC脱氨酶活性为27.43 μmol·min-1·mg-1.
已有众多学者对微生物菌剂的促生作用展开了研究.如:林志伟等[29]研究表明,解磷菌DQ-N发酵液可以有效促进大豆根的抗逆能力;刘赛男等[30]研究表明,生物炭与解磷菌配合施用对磷胁迫下水稻苗生长具有显著的促生效应;刘广超等[31]从烟草根际土壤分离得到高效解磷菌——皮特不动杆菌(Acinetobacterpittii)3P29,并对其进行促生试验发现其可显著促进烟草根系生长.本研究结果显示,与空白对照组相比,PJS-18低浓度菌液与有机肥配施可显著提高小麦苗的株高、根长等各项生长指标.
已有研究表明,磷是参与植物叶绿体光合作用的重要元素,与产量呈显著相关性[32],且一定量的磷可以促进植物根系生长[33].本研究中,PJS-18菌株可将土壤中的难溶性有机磷转化为植物可以直接利用的可溶性磷;试验设计中采用与巨菌草同科不同属的小麦作为对象进行盆栽验证试验,发现施用低浓度PJS-18菌液可促进小麦根系生长同时提高产量,表明PJS-18菌液可成为巨菌草、小麦等禾本科作物增产的优良菌肥.PJS-18菌株具有分泌固氮酶、磷酸酶、ACC脱氨酶等多种有利于植物生长发育的促生物质,对提高植物抗旱、抗寒、耐重金属、耐盐等抗逆性有一定的促进作用.但本研究中的小麦盆栽验证试验局限于实验室条件,微生物真正应用于自然环境中往往受诸多因素交互影响,如盐碱胁迫、干旱胁迫、重金属离子胁迫等,故脱离了实验室理想试验条件对于该菌株的扩大化应用存在挑战,因此探究交错环境因子对解磷能力的影响与实际适用条件,对于PJS-18菌株的应用具有重大意义.
由于表型和系统发育特征相似的枯草芽孢杆菌组、解淀粉芽孢杆菌组与地衣芽孢杆菌所属菌种的亲缘关系相近,被统称为“枯草芽孢杆菌复合群”(包括贝莱斯芽孢杆菌)[34-35],仅通过16S rDNA分子鉴定难以有效区分.由于解淀粉芽孢杆菌的乙酰甲基甲醇试验和硝酸盐还原试验呈阴性,枯草芽孢杆菌的乙酰甲基甲醇试验和硝酸盐还原试验呈阳性[36],故排除PJS-18菌株是解淀粉芽孢杆菌的可能性.由于贝莱斯芽孢杆菌与枯草芽孢杆菌的生理生化特征较为相似难以区分,本研究对PJS-18菌株进行16S rDNA分子鉴定,发现该菌株在16S rDNA水平上与Bacillussubtilisstrain NR_027552.1的同源一致性达到99.86%,结合表型和生理生化特征初步鉴定该菌株为枯草芽孢杆菌(Bacillussubtilis).RpoB、gyrA和cheA作为看家基因具有高度保守性,能显示出更高的遗传差异,在芽孢杆菌的鉴定上具有更强的分辨力[35].因此可通过这3个保守基因对PJS-18菌株进行进一步鉴定以确定其更为准确的系统发育学地位.
