泌乳期母兔乳中微生物多样性变化规律研究
2023-02-08于志凯王国洲来宁洁吴峰洋郭万华刘亚娟陈宝江
于志凯 王国洲,2 来宁洁 吴峰洋 夏 苗 郭万华 刘亚娟 陈宝江*
(1.河北农业大学动物科技学院,保定 071001;2.国家北方山区农业工程技术研究中心,保定 071001;3.河北农业大学山区研究所,保定 071001;4.山东省聊城市东阿县农业农村局,聊城 252200)
初生仔兔肠道菌群的构建对其成活及后期发育至关重要,健康的肠道菌群可以提高仔兔的生长性能、促进免疫系统成熟和发育[1],肠道菌群代谢产生的短链脂肪酸还可作为信号分子调节肠道外其他器官的代谢[2]。而非健康状态下即肠道菌群紊乱是造成仔兔腹泻的主要原因之一,据家兔病情统计,在平均死亡率为24%的兔群中,超75%为腹泻所致[3]。子代出生后肠道微生物开始定植[4],母乳作为子代哺乳期最主要的食物,对于子代肠道功能发育与肠道免疫系统的成熟关系重大[5]。母乳中含有抗体、溶菌酶、生长因子、抗菌肽和母乳低聚糖等多种生物活性物质和免疫因子,能够促进子代免疫系统的发育,抵抗病原体的侵袭[6-7]。研究显示,双歧杆菌和乳酸杆菌可以通过母乳喂养垂直传递给子代,利用母乳低聚糖在子代肠道内增殖[4,8]。母乳微生物通过乳汁直接影响子代肠道微生物组成,从而对子代健康形成长久影响,因此,研究哺乳期内母乳中微生物变化规律,构建乳汁菌群结构模型是研究子代肠道菌群结构的重要环节。
以前关于哺乳期母乳菌群变化的研究大多集中于人及反刍动物。迄今为止,在人初乳中发现了154种细菌,在过渡乳中发现了127种细菌[9-10],乳中微生物受遗传、分娩方式、环境差异等多种因素影响[11-12],核心菌属差异明显。Murphy等[13]研究发现,人乳在由初乳向常乳过渡过程中,菌群结构发生显著变化,厌氧菌在常乳中的丰度提高。Niyazbekova等[14]研究表明,山羊不同泌乳阶段显著影响乳中微生物群落和多样性,初乳中富含新鞘氨菌、短杆菌、乳酸杆菌等,而常乳中类杆菌、消化链球菌、梭状芽孢杆菌占比较高。Doyle等[15]研究指出,泌乳期不同显著影响牛乳微生物群落组成,泌乳中期牛乳中拟杆菌属、粪杆菌属、弯曲杆菌属和红细菌的比例较高,而到泌乳后期,放线菌成为牛乳中的优势菌。迄今为止,关于哺乳期内家兔乳菌群变化规律的研究尚未见报道。本试验以伊拉肉兔为研究对象,运用高通量测序技术,探索母兔不同泌乳阶段乳中菌群变化规律,以期填补兔乳微生物群落结构研究的空白,为进一步阐明仔兔肠道菌群来源提供依据。
1 材料与方法
1.1 试验设计与饲养管理
从同批人工授精的3胎次伊拉妊娠母兔中选取12只体况良好、同天分娩,产仔数≥7的母兔,通过调整寄养使每只母兔哺喂7只仔兔。试验于母兔分娩后开始,至仔兔35日龄断奶结束。试验期间按程序进行清洁和消毒,保持兔舍通风、卫生和干燥,母兔哺乳期内不使用任何药物,每天饲喂2次,保持充足饮水。哺乳期母兔所喂基础饲粮参照De Blas等[16]推荐的兔营养需求进行配制,其组成及营养水平见表1。
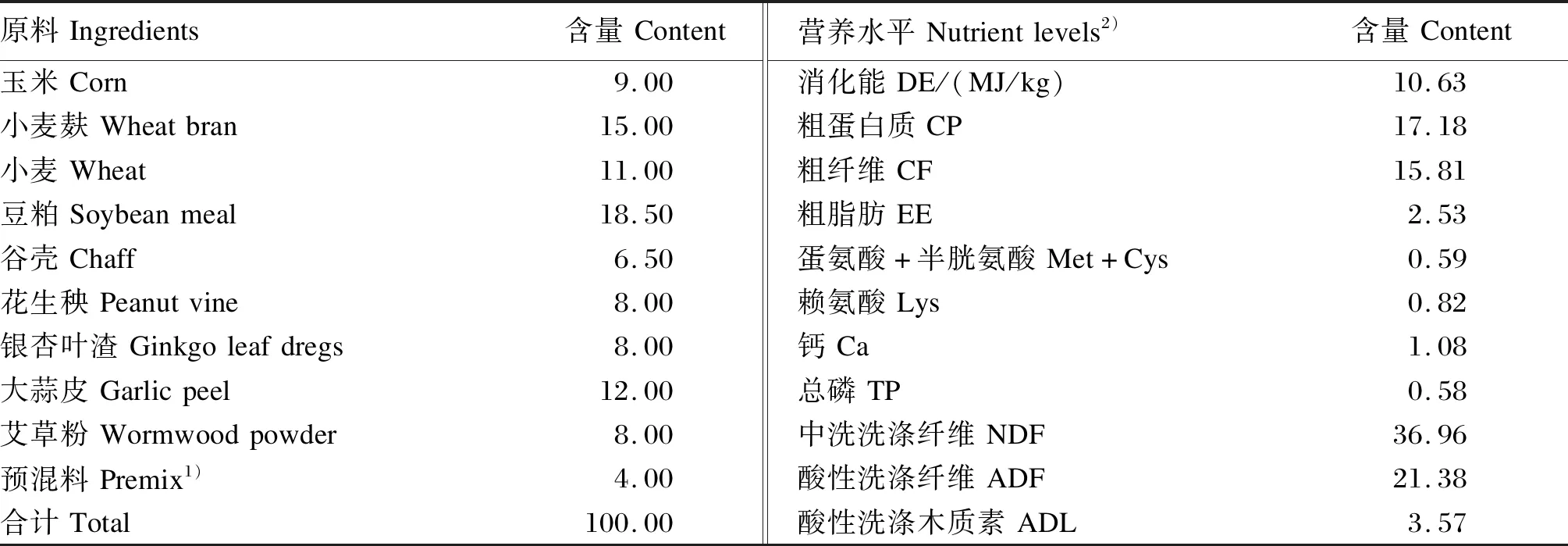
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.2 样品采集及16S rDNA测序
每只母兔分别于泌乳第0天(分娩后0.5 h内,L0)、第3天(L3)采集初乳,泌乳第7天(L7)采集过渡乳,泌乳第21天(L21)、第35天(L35)采集常乳,收集前用75%酒精对乳房及周围进行擦拭消毒,弃去第1滴乳汁以后,用无菌棉签蘸取母兔乳汁,置于10 mL无菌离心管中,-80 ℃保存。总DNA提取、PCR扩增和Illumina MiSeq测序及结果分析由上海派森诺生物科技有限公司协助完成。样品采用OMEGA Mag-Bind soil DNA kit (200)(M5635-02)(Omega Bio-Tek,美国)试剂盒提取总DNA,提取后的DNA进行0.8%琼脂糖凝胶电泳进行分子大小判断,利用NanoDrop 1000分光光度计(Thermo Fisher Scientific,美国)检测DNA的浓度和纯度,采用引物338F(5’-barcode+ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGTWTCATTA-3’)对V3~V4可变区进行PCR扩增。PCR扩增结束后,对PCR产物进行2%琼脂糖凝胶电泳检验,于Illumina MiSeq平台进行双端测序。
1.3 生物信息学与数据分析
对测序得到的PE reads进行去引物、质量过滤和拼接。利用QIIME软件对有效序列在100%序列相似度下进行聚类,得到扩增子序列变体(ASV),并与GreenGene数据库进行比对,获得每个ASV分类学信息。基于获得的ASV信息,对乳中微生物进行alpha多样性分析、beta多样性分析、物种组成分析。
试验数据用Excel 2010初步整理后,运用R软件的ggplot2程序进行绘图。利用GraphPad Prism V8.0软件对alpha多样性指数和微生物相对丰度进行非参数检验中的Kruskal-Wallis检验,P<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 ASV信息统计与聚类分析
高通量测序下机序列经质量过滤、去噪拼接后,60个兔乳样本共产生352 7531条高质量序列,每个样本平均序列为58 792条,序列长度分布在26~442 bp。物种累积曲线可用于判断样本量是否足够并估计群落丰富度,由图1-A可知,随着样本量增大,曲线上升速度趋于平缓,表明测序深度足够、样品量足以反映物种组成。基于100%相似度对高质量序列进行聚类分析,韦恩图(图1-B)显示,L0特征ASV数量为2 361个,L3特征ASV数量为3 105个,L7特征ASV数量为7 558个,L21特征ASV数量为2 653个,L35特征ASV数量为2 933个,5个时间点共有的ASV数量为302个。

图1 乳中微生物物种累积曲线(A)和韦恩图(B)Fig.1 Species accumulation curve (A) and Venn diagram (B) of milk microbiota
2.2 alpha多样性分析
本试验以Chao1和Observed_species指数表征丰富度,以Shannon和Simpson指数表征多样性,以Goods_coverage指数表征覆盖度。由图2-A可知,各泌乳时间点的Goods_coverage指数均在0.92以上,提示测序结果可以代表样本真实情况。由图2-B、图2-C可知,L7的Chao1和Observed-species指数显著低于L3、L35(P<0.05),极显著低于L0、L21(P<0.01);由图2-D、图2-E可知,L7的Shannon指数显著低于L0(P<0.05),极显著低于L21(P<0.01),L3极显著低于L21(P<0.01);而对于Simpson指数,只有L7显著低于L21(P<0.05),其余时间点间差异均不显著(P>0.05)。
2.3 beta多样性分析
根据Bray_Curtis距离,运用主坐标分析(PCoA)来评估样品菌群的beta多样性,由图3可知,第1主坐标(PCo1)、第2主坐标(PCo2)分别解释了总差异性的34.9%、11.6%;5个时间点内样本聚类效果较好;L0、L21、L35间样品聚类在一起,但L3、L7与L0、L21、L35之间出现了明显分离。
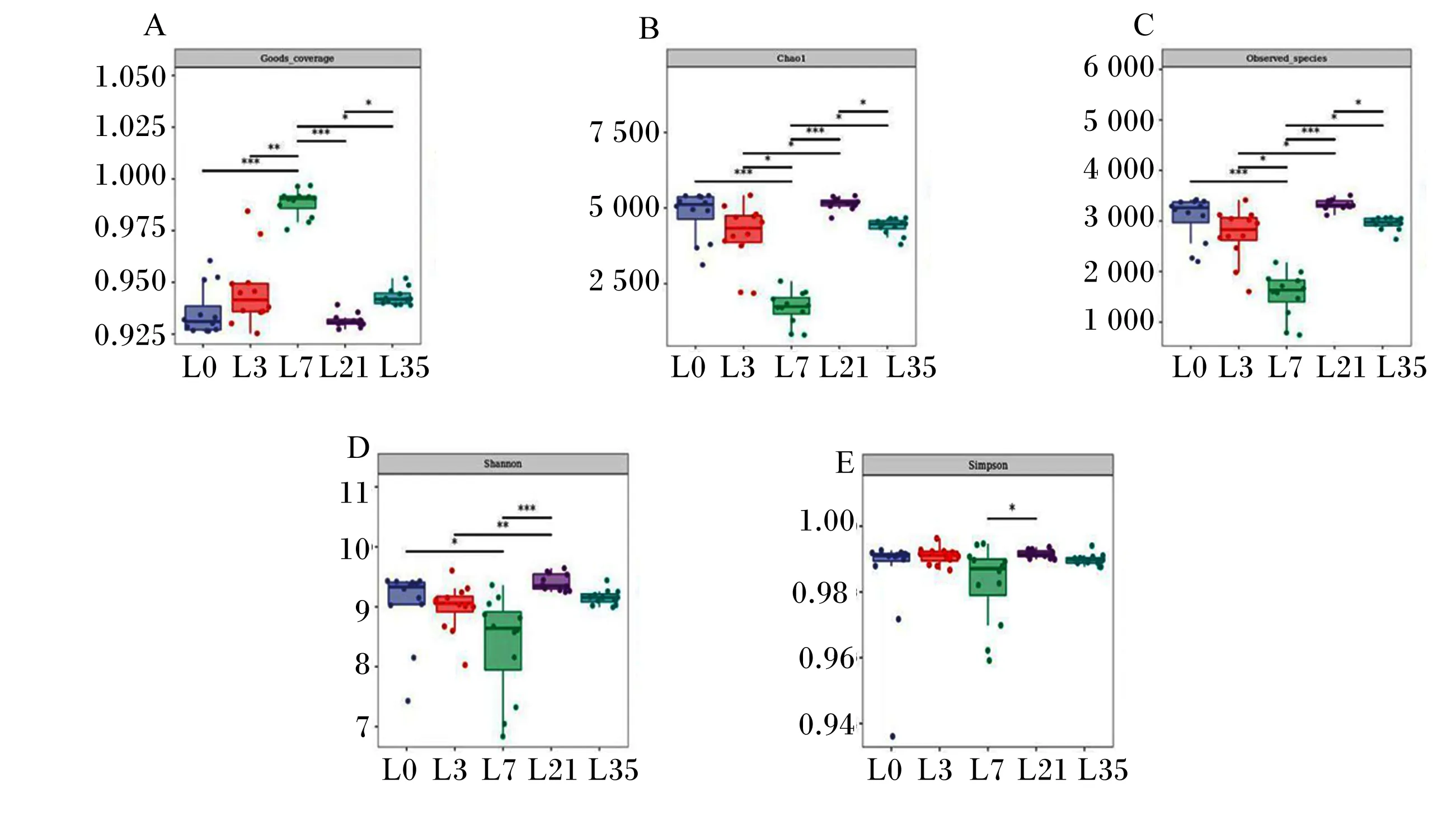
“*”:P<0.05;“**”:P<0.01;“***”:P<0.001。图4、图5同 the same as Fig.4 and Fig.5。图2 兔乳菌群的alpha多样性Fig.2 Alpha diversity of rabbit’s milk microbiota
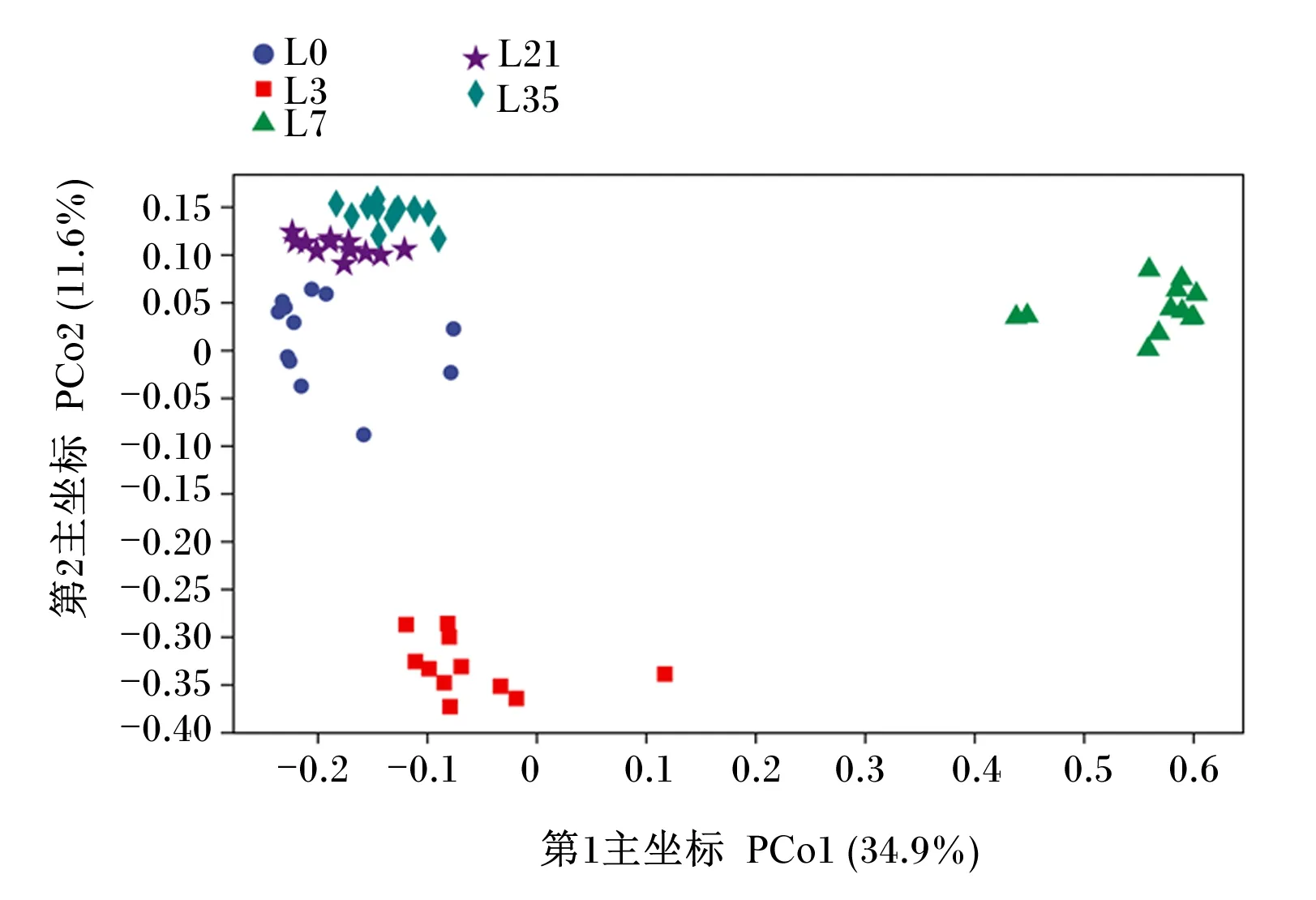
图3 兔乳菌群主坐标分析图Fig.3 PCoA plot of rabbit’s milk microbiota
2.4 菌群结构分析
2.4.1 门水平结构分析
由图4-A可知,在门水平上,泌乳母兔乳汁中优势菌群主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)。对门水平上相对丰度较高的5个菌门进行显著性分析,结果如图4-B所示,随着泌乳的进行,厚壁菌门相对丰度先降低后升高,其中L7最低,极显著低于L0、L35(P<0.01);L7的变形菌门相对丰度极显著高于L0、L3(P<0.01);拟杆菌门相对丰度表现为L7极显著低于L3、L21(P<0.01),显著低于L0(P<0.05),且以L21最高,显著高于L35(P<0.05);随着泌乳的进行,疣微菌门(Verrucomicrobia)相对丰度先降低后升高,其中L7极显著低于L0、L21、L35(P<0.01),L3显著低于L21(P<0.05),极显著低于L35(P<0.01);放线菌门(Actinobacteria)相对丰度表现为L7极显著高于L0、L3、L21(P<0.01),L0显著低于L35(P<0.05)。
2.4.2 属水平结构分析
为了进一步探索不同泌乳阶段乳中菌群结构变化,在各阶段进行属水平结构分析。由图5-A可知,在属水平上泌乳0、3、21、35 d母兔乳中优势菌群主要为艾克曼菌属(Akkermansia)、布劳特氏菌属(Blautia)、乳杆菌属(Lactobacillus)和考拉菌属(Phascolarctobacterium),而泌乳7 d母兔乳中优势菌群主要为放线杆菌属(Actinobacillus)。对属水平上相对丰度较高的6个菌属进行显著性分析,结果(图5-B)显示,L7的艾克曼菌属相对丰度极显著低于L0、L21、L35(P<0.01),L3显著低于L0、L21(P<0.05),极显著低于L35(P<0.01);随着泌乳的进行,布劳特氏菌属相对丰度先降低后升高,其中L0、L3、L35极显著高于L7(P<0.01),L21显著高于L7(P<0.05);L7的乳杆菌属、考拉菌属相对丰度极显著低于L0、L21、L35(P<0.01),L3显著低于L0、L35(P<0.05);放线杆菌属相对丰度随着泌乳的进行呈先升高后降低趋势,在L7时最高,极显著高于L0、L21、L35(P<0.01),L3极显著高于L0(P<0.01);不动杆菌属(Acinetobacter)相对丰度随泌乳进行先降低后升高,L0显著高于L7(P<0.05),显著低于L21(P<0.05),L3极显著低于L21(P<0.01),同时L7极显著低于L21、L35(P<0.01)。
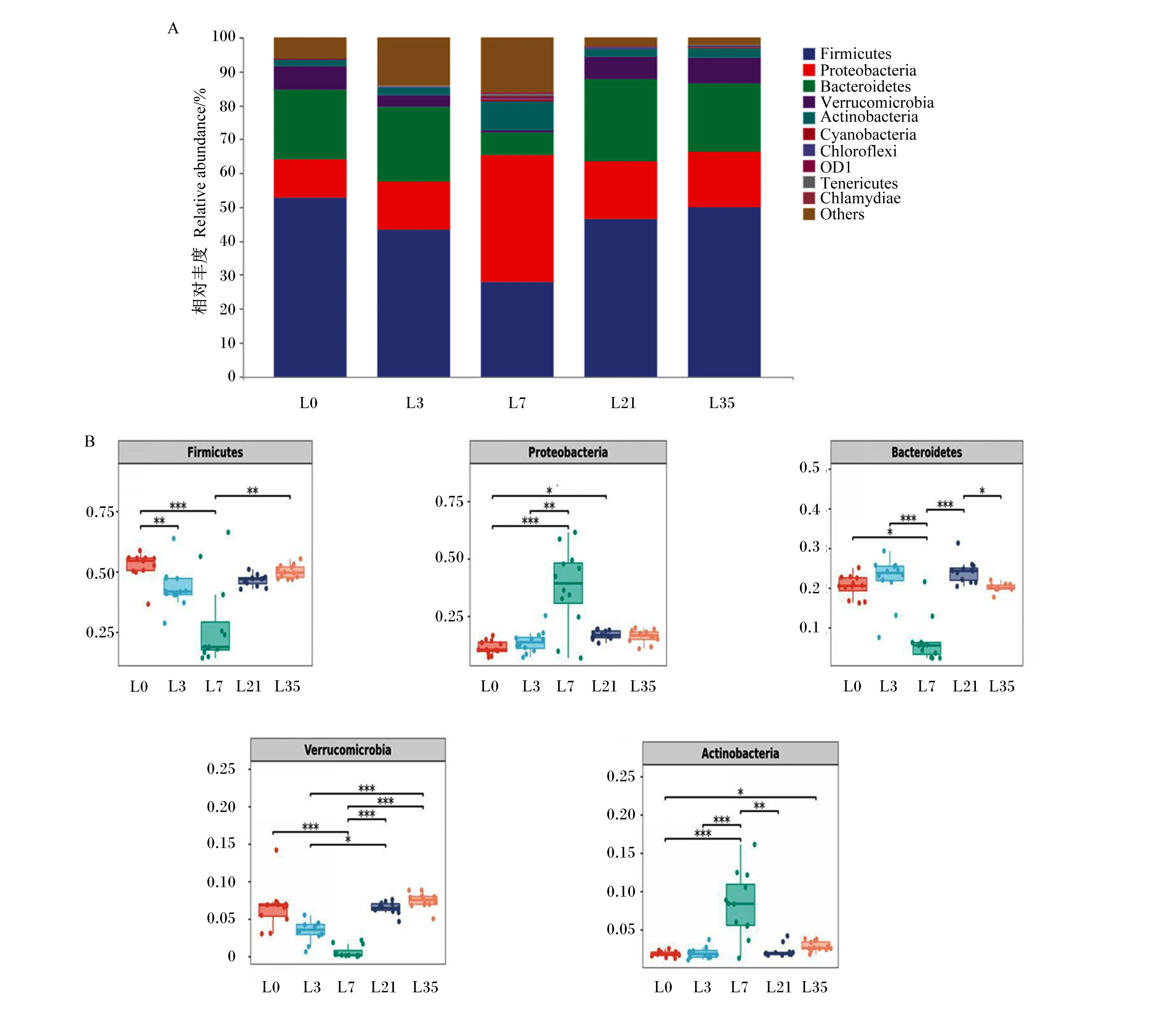
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Verrucomicrobia:疣微菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝细菌门;Chloroflexi:绿菌门;Tenericutes:软壁菌门;Chlamydiae:衣原体门;Others:其他。图4 兔乳微生物在门水平上的组成(A)和差异菌群相对丰度(B)Fig.4 Composition of rabbit’s milk microbiota at phylum level (A) and relative abundance of differential microbiota (B)
3 讨 论
母乳中富含微生物,通常认为这些微生物参与并影响子代肠道菌群的建立过程,对子代的健康有着长久影响[17]。但泌乳期内乳中微生物群落结构是否发生变化仍存在分歧,有研究表明,人类母乳中微生物高度多样化,但泌乳期内乳汁微生物群落结构相对稳定[18]。而另一种观点认为,不同泌乳阶段乳中微生物群落结构组成有显著差异,且其组成受环境及母体健康状况的影响[19]。本研究以alpha和beta多样性共同表征微生物总体多样性和群落的生物异质性,结果显示,随着泌乳的进行,母兔乳中微生物多样性先降低后升高,以泌乳7 d为转折点,多样性最低,这一变化与兔乳中蛋白质、乳糖含量变化[20-21]一致。有研究表明,兔初乳向常乳转变的过程中有一个过渡期,初乳中较高含量的干物质、脂肪和能量随泌乳的进行逐渐降低,并在泌乳7 d时过渡完成,营养物质趋于稳定[20]。本试验中兔乳微生物多样性在泌乳7 d时发生转折的原因可能是随着泌乳进行,兔初乳和过渡乳中的营养成分发生改变,在过渡完成后常乳营养成分趋于稳定,恰恰是乳中营养成分的改变影响了菌群的组成和活性[22]。
Zhang等[23]研究发现山羊乳中优势菌门为变形菌门、厚壁菌门、放线菌门和拟杆菌门,而关于哺乳期内兔乳中微生物组成的报道很少。本研究表明,哺乳期母兔乳中优势菌门为厚壁杆菌门、拟杆菌门和变形菌门,同时我们发现,尽管厚壁杆菌门、拟杆菌门和变形菌门的相对丰度在整个哺乳期内有所波动,但总比例保持在72%~88%,表明这些微生物相互竞争生态位[24]。厚壁菌门可以分解饲粮中的纤维,供机体利用[25]。拟杆菌门能够分解母乳和饲粮中的多糖和蛋白质,促进子代肠道免疫系统的发育[26-27]。变形菌门最主要的作用是进入幼龄动物肠道,通过消耗氧气创造厌氧环境,促进专性厌氧菌的定植,为幼龄动物生长提供能量[28-29]。但有资料显示,仔兔肠道中变形菌门的比例极低[30],这说明菌群在子代肠道的定植是一个选择性的过程,乳中只有某些特定菌才能在子代肠道中定植。但对于母乳微生物群如何定植于新生儿肠道以及选择性定植机制需要进一步研究。放线菌门是动物肠道内的重要生理菌群,能够代谢多糖和寡糖[31],同时,放线菌门是兔口腔代表菌[32]。本试验结果显示,初乳中放线菌门的相对丰度较低,随着泌乳的进行而逐渐升高,在第7天时达最大值,这可能是随着哺乳期的进行,仔兔口腔内的放线菌门逆行回流至母兔乳腺,释放至乳中[5]。

Akkermansia:艾克曼菌属;Blautia:布劳特氏菌属;Lactobacillus:乳杆菌属;Phascolarctobacterium:考拉杆菌属;Acinetobacter:不动杆菌属;Actinobacillus:放线杆菌属;Pusillimonas:极小单胞菌属;Ochrobactrum:苍白杆菌属;Bacteroides:拟杆菌属;Corynebacterium:棒状杆菌属;Burkholderia:伯克氏菌属;Oscillospira:颤螺菌属;Ruminococcus:瘤胃球菌属;Coprococcus:粪球菌属;Dorea:多尔氏菌属;Clostridiaceae_Clostridium:梭菌科_梭菌属;Staphylococcaceae_Staphylococcus:葡萄球菌科_葡萄球菌属;Pasteurella:巴氏杆菌属;Facklamia:费克蓝姆氏菌属;Others:其他。图5 兔乳微生物在属水平上的组成(A)和差异菌群相对丰度(B)Fig.5 Composition of rabbit’s milk microbiota at genus level (A) and relative abundance of differential microbiota (B)
母兔乳中的主要菌属是艾克曼菌属、布劳特氏菌属、乳杆菌属、考拉杆菌属、不动杆菌属,这与猪乳微生物群落结构(以瘤胃球菌属、链球菌属、未分类梭状芽孢杆菌属、乳酸杆菌属、棒状杆菌属和未分类毛螺菌属为主要菌属)明显不同[33],造成这一差异的原因可能是兔与猪属于不同科属动物,猪饲粮以精料为主,需要消化大量淀粉,兔则为草食动物,主要特点是能够充分利用高纤维饲粮。同时,猪和兔乳中营养物质含量不同,有研究表明兔乳中的干物质、脂肪、蛋白质含量远高于猪乳,而乳糖含量则低于猪乳[34-36]。本研究在兔乳中检测到肠道相关微生物,如阿克曼菌属、布劳特氏菌属和考拉菌属。艾克曼菌属可以通过糖苷水解酶分解寡糖供机体利用[37],与放线菌门竞争乳中寡糖,在本试验中,随放线菌门相对丰度升高,艾克曼菌属的相对丰度降低。布劳特氏菌属是肠道菌群的优势菌属,在维持肠道环境平衡和预防炎症方面具有重要意义,本试验中,在泌乳期内,布劳特氏菌属相对丰度先降低后升高,与Chen等[33]研究结果趋势一致。乳杆菌属作为兔乳中的优势菌属,不仅可促进仔兔肠道菌群的定植,还可保障母体健康,有研究表明乳中乳杆菌属可以预防乳房炎,抑制金黄色葡萄球菌的生长和感染[38-39]。考拉菌属是一种严格厌氧菌,主要存在于肠道中,其可以产生短链脂肪酸,并与宿主的代谢状况有关[40-41],兔肠道中的考拉菌属可能是通过肠-乳途径进入兔乳中。肠-乳途径是一种内源性途径,树突状细胞通过这种途径在肠上皮细胞之间的紧密连接处引入开口,通过树突获取兔肠道中考拉菌属,随后树状细胞通过淋巴和血液循环,最终到达乳腺导管,释放到母兔乳中。Maertens等[20]研究发现,哺乳母兔乳中乳糖含量先降低后升高,与本试验中不动杆菌属相对丰度的变化规律一致,这可能是因为兔乳中不动杆菌属可以利用乳糖进行生长[34]。
4 结 论
① 泌乳期母兔乳中微生物多样性随泌乳的进行先降低后升高,泌乳第7天是转折点。
② 母兔乳中优势菌门为厚壁菌门、拟杆菌门和变形菌门,其变化主要出现在过渡乳阶段;优势菌属为艾克曼菌属、布劳特氏菌属、乳杆菌属、考拉菌属和不动杆菌属,其变化主要出现在初乳和过渡乳阶段。
