吡咯喹啉醌二钠对种公鸡抗氧化能力及睾丸组织形态的影响
2023-02-08王子腾旦增加布盛熙晖王相国肖龙菲吕学泽倪和民齐晓龙
龙 城 王子腾,2 旦增加布,3 盛熙晖 邢 凯 王相国 肖龙菲 吕学泽 郭 勇 倪和民 孙 越 齐晓龙*
(1.北京农学院动物科学技术学院,北京 100096;2.中华合作时报社,北京 100070;3.那曲职业技术学校,那曲 852000;4.北京市畜牧总站,北京 100020)
生产实践中,种公鸡极易受到氧化应激,尤其是睾丸。睾丸是精子发生的场所,精子发生是非常活跃的复制过程,每秒产生约1 000个精子。该过程中较高的细胞分裂率意味着上皮细胞消耗线粒体氧的相应速率亦较高。然而,睾丸血管化发育不全意味着该组织中的氧张力较低,并且睾丸内对这一重要元素的竞争非常激烈[1]。因此,睾丸中精子发生相关的细胞都极易受到氧化应激。
精浆富含多不饱和脂肪酸(PUFA),对活性氧(ROS)引起的氧化应激较敏感。研究表明,高ROS水平与精子质量低和男性不育症相关[2]。在老龄公鸡中情况更糟,ROS随着年龄的增长在睾丸中积累,不断诱导细胞中的氧化应激[3]。因此,氧化应激是导致老龄公鸡繁殖性能下降的重要因素之一。尽管睾丸和精子的抗氧化能力较弱,但睾丸组织和精浆中的抗氧化化合物能保护精子免受ROS的侵害。基于上述研究结果,研究者采用了一些方法来提高精液质量以及睾丸和精浆的抗氧化能力,包括在膳食中添加苹果渣[2]、α-亚麻酸[4]等,尽管如此,需要更有效的替代品来提高老龄种鸡的繁殖性能,因为这些公鸡尤其表现出与年龄相关的生育能力低下。
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是一种氧化还原的辅酶,是ROS清除剂,具有很强的自由基清除能力,能提高机体的抗氧化能力。研究表明,PQQ对乙醇等引起的肝损伤具有良好的保护作用[5]。在繁殖性能方面,小鼠饲粮添加PQQ对其繁殖性能和生长发育具有改善作用[6],其机理可能是PQQ提升了小鼠机体尤其是睾丸组织的抗氧化性能,从而保护了小鼠的精子发生过程。PQQ应用最广泛的是其二钠盐形式——吡咯喹啉醌二钠(pyrroloquinoline quinone disodium,PQQ·Na2)。本课题组前期研究结果表明,PQQ·Na2可显著改善种公鸡的繁殖性能[7],推测PQQ可通过提高种公鸡机体的抗氧化能力改善其繁殖性能。本试验在此基础上进一步研究饲粮添加PQQ·Na2对种公鸡血清、肝脏、肾脏和睾丸组织抗氧化能力及对睾丸组织形态的影响,旨在为PQQ·Na2在种公鸡生产种的应用提供理论依据。
1 材料与方法
1.1 试验材料
京红1号蛋用种公鸡购自华都峪口禽业有限责任公司,PQQ·Na2购自上海医学生命科学研究中心有限公司,PQQ·Na2中PQQ的含量为1%;无水乙醇和冰醋酸购自北京化工厂;总超氧化物歧化酶(T-SOD)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、羟自由基测试盒、超氧阴离子自由基测试盒及丙二醛(MDA)测试盒均购自南京建成生物工程研究所。
1.2 试验设计
选取440日龄健康的、体况一致的京红1号蛋用种公鸡96只,随机分为4组,每组6个重复,每个重复4只,各重复之间体重无显著差异(P<0.05)。对照组饲喂不添加PQQ·Na2的基础饲粮,基础饲粮组成及营养水平见表1。试验组饲喂在基础饲粮中分别添加0.5、1.0和2.0 mg/kg PQQ·Na2的试验饲粮。预试期1周,正试期6周。
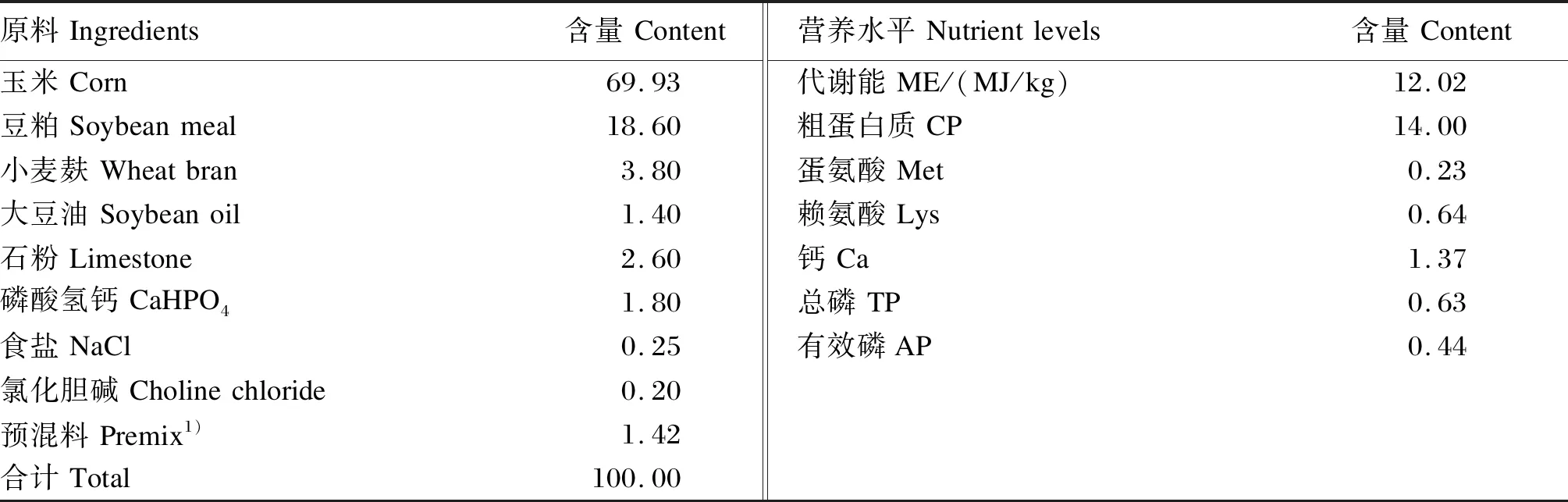
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air dry basis) %
1.3 饲养管理
所有试验用种公鸡均采用单笼饲养,参照鸡场内安排每日饲喂1次,舍内光照充足且持续12 h,具有相关的排风设备,温度和相对湿度分别控制在24 ℃和50%左右,保持空气流通。种公鸡自由采食,充足饮水,按正常免疫程序进行免疫接种。
1.4 采集样本
试验期末,每个重复选取1只种公鸡用10 mL真空采血管取血,血样在4 ℃下12 000 r/min的条件下离心20 min分离血清,于-80 ℃保存,用于后续抗氧化指标检测;取血后进行屠宰,立即取出肝脏、肾脏和睾丸,用生理盐水清洗表面污物,在一次性培养皿内迅速剥离质膜后立即分装于1.5 mL离心管中,在-80 ℃冰箱内保存,用于后续抗氧化指标检测;将睾丸裁剪成厚度不超过0.5 cm的组织块,将其放入配好的固定液中,使细胞维持原本的形态,用于后续睾丸组织形态(曲细精管直径与生精上皮厚度)检测。
1.5 检测指标
1.5.1 抗氧化指标的测定
严格按照试剂盒中说明书的操作流程,用酶标仪(宝特,威努斯基,美国)分别测定血清、肝脏、肾脏和睾丸等组织中T-SOD、GSH-Px活性以及清除羟自由基能力、清除超氧阴离子能力、MDA含量。
1.5.2 睾丸组织切片的制备
采用伊红-苏木精(HE)染色法进行睾丸组织切片的制备,每个重复制作6张切片,具体步骤如下。
1)修块:从4%的多聚加强固定液中取出固定好的睾丸组织块,修成约5 mm×5 mm×2 mm的小块后用流水冲洗12 h。
2)脱水、硬化:冲洗后的睾丸组织依次放入70%(4 h)、80%(4 h)、90%(2 h)、95%(1 h)的酒精中,再分2次放入100%(30 min)的酒精中,进行脱水。
3)透明:将脱水后的睾丸组织块从100%的酒精中取出,放于混合液(二甲苯∶100%酒精=1∶1,20 min)中,再分2次用纯二甲苯(15 min)透明。
4)浸蜡和包埋:将透明好的睾丸组织浸入到熔点为54~56 ℃熔化的石蜡中1.5 h,再放入熔点为58~60 ℃熔化的石蜡中1.5 h包埋。
5)塑型和切片:把含睾丸组织的包埋蜡块塑成梯形,切片厚度设置为3~10 μm。
6)展片:用毛笔将切好的石蜡切片沾起,放到水浴展片机中进行展片(水温38 ℃),待蜡片充分展平以后,缓慢从水中捞出蜡片。
7)干燥:将载玻片放入40 ℃带鼓风的干燥箱中进行干燥,以便进行染色。
8)染色:取已烤干的切片,采用HE染色法进行脱蜡和染色。
9)封片:把载玻片从二甲苯中取出平放于干燥木板上,待二甲苯完全挥发后,在组织上滴1滴树胶,加盖盖玻片,放于切片盒中保存以备日后观察统计。
10) 镜检:显微镜(尼康,日本)镜检,图像采集分析睾丸曲精细管直径与生精上皮厚度。
1.5.3 睾丸切片曲细精管直径与生精上皮厚度指标测定
睾丸切片曲细精管直径与生精上皮厚度测量采用显微测微尺测量法,每张睾丸切片选择3个视野,每个视野选择3个大小相似的曲细精管进行测量。
显微测微尺包括目镜测微尺和测微台尺。目镜测微尺分为5大格,每格分10小格,共50小格。测微台尺长1 mm,分为10大格,每格分为10小格,共100小格,每小格等于10 μm。将测微台尺放在载物台上,调焦后在视野中使目镜和台尺刻度在“0”刻度完全重叠,再向右找出这2个尺上的刻度重叠的格数。计算公式为:
目镜测微尺每小格=台尺重叠格×10 μm/目尺重叠格。
在本试验中,目镜测微尺上的9格与测微台尺上的第10格重叠。按照公式,本试验目镜测微尺每小格长度=10×10 μm/9=11.11 μm。测量时,不再使用测微台尺,在视野中利用目镜测微尺记录格数即可。
1.6 数据分析
利用Excel 2021对原始数据进行处理。使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),用Duncan氏法进行多重比较,然后进行趋势检验,检验是否满足线性和二项式等多项式变化。最终结果表示为平均值和均值标准误(SEM),P<0.05为差异显著。
2 结 果
2.1 饲粮添加不同水平PQQ·Na2对种公鸡抗氧化能力的影响
由表2可知,与对照组相比,3个PQQ·Na2组血清中GSH-Px活性、清除羟自由基能力和清除超氧阴离子能力显著升高(P<0.05),血清中MDA含量显著降低(P<0.05);同时,1.0与2.0 mg/kg PQQ·Na2组血清中T-SOD活性显著升高(P<0.05)。除清除超氧阴离子能力外,1.0与2.0 mg/kg PQQ·Na2组之间以上血清抗氧化指标均差异不显著(P>0.05)。

表2 饲粮添加不同水平PQQ·Na2对种公鸡血清抗氧化能力的影响Table 2 Effects of different dietary supplemental levels of PQQ·Na2 on serum antioxidant capacity of breeder cocks
由表3可知,与对照组相比,饲粮中添加不同水平PQQ·Na2均可显著提高肝脏中T-SOD、GSH-Px活性与清除羟自由基能力和清除超氧阴离子能力(P<0.05),显著降低肝脏中MDA含量(P<0.05)。1.0与2.0 mg/kg PQQ·Na2组之间以上肝脏抗氧化指标差异不显著(P>0.05)。
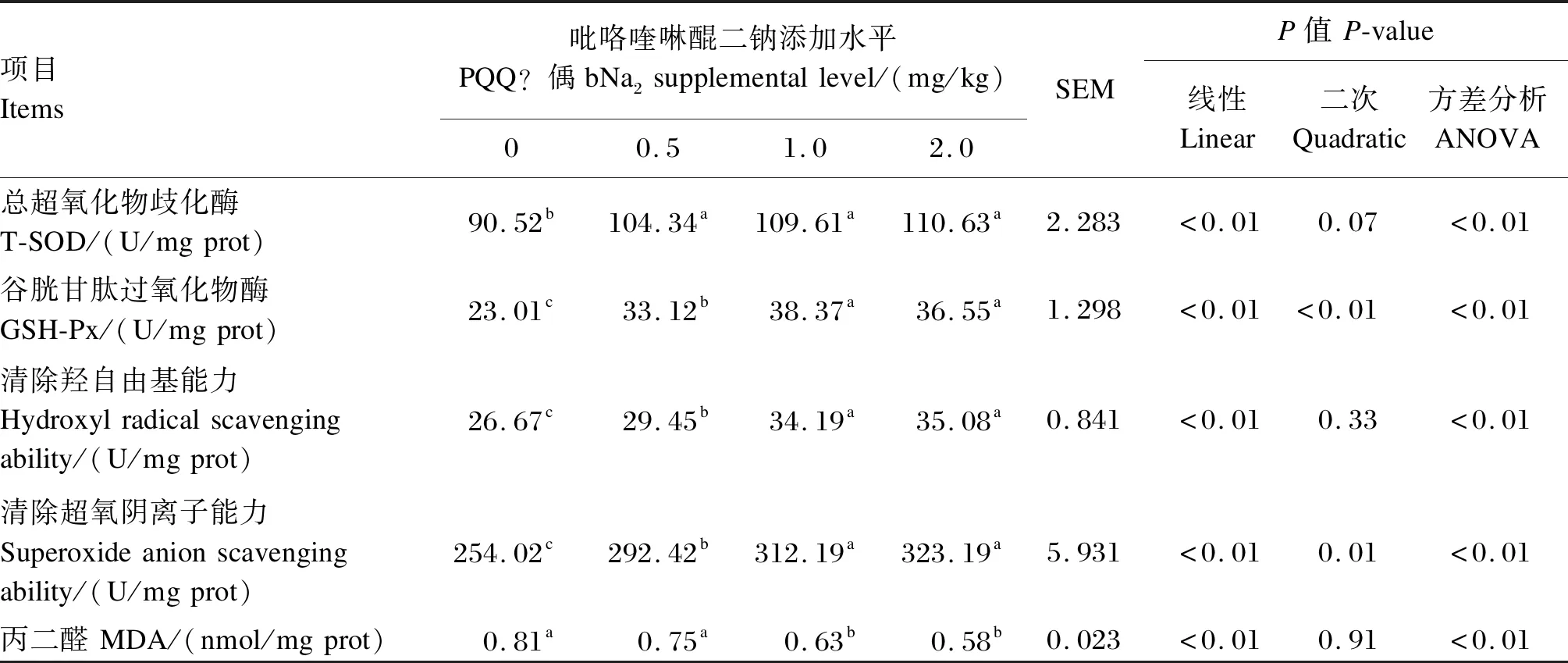
表3 饲粮添加不同水平PQQ·Na2对种公鸡肝脏抗氧化能力的影响Table 3 Effects of different dietary supplemental levels of PQQ·Na2 on liver antioxidant capacity of breeder cocks
由表4可知,饲粮中添加0.5和2.0 mg/kg PQQ·Na2显著提高肾脏中T-SOD活性(P<0.05),分别较对照组提高11.0%和12.5%。随着饲粮PQQ·Na2添加水平的增加,肾脏中GSH-Px活性和清除羟自由基能力呈线性增加(P<0.05)。肾脏中GSH-Px活性从对照组的23.20 U/mg prot增加到2.0 mg/kg PQQ·Na2组的35.77 U/mg prot,肾脏清除羟自由基能力从对照组的254.66 U/mg prot增加到2.0 mg/kg PQQ·Na2组的320.49 U/mg prot,各组间差异显著(P<0.05)。各PQQ·Na2添加组肾脏清除超氧阴离子能力与对照组无显著差异(P>0.05)。随着饲粮PQQ·Na2添加水平的增加,肾脏中MDA含量呈线性下降(P<0.05)。饲粮PQQ·Na2添加水平从0增加到2.0 mg/kg可使肝脏中MDA含量降低58.9%(P<0.05)。
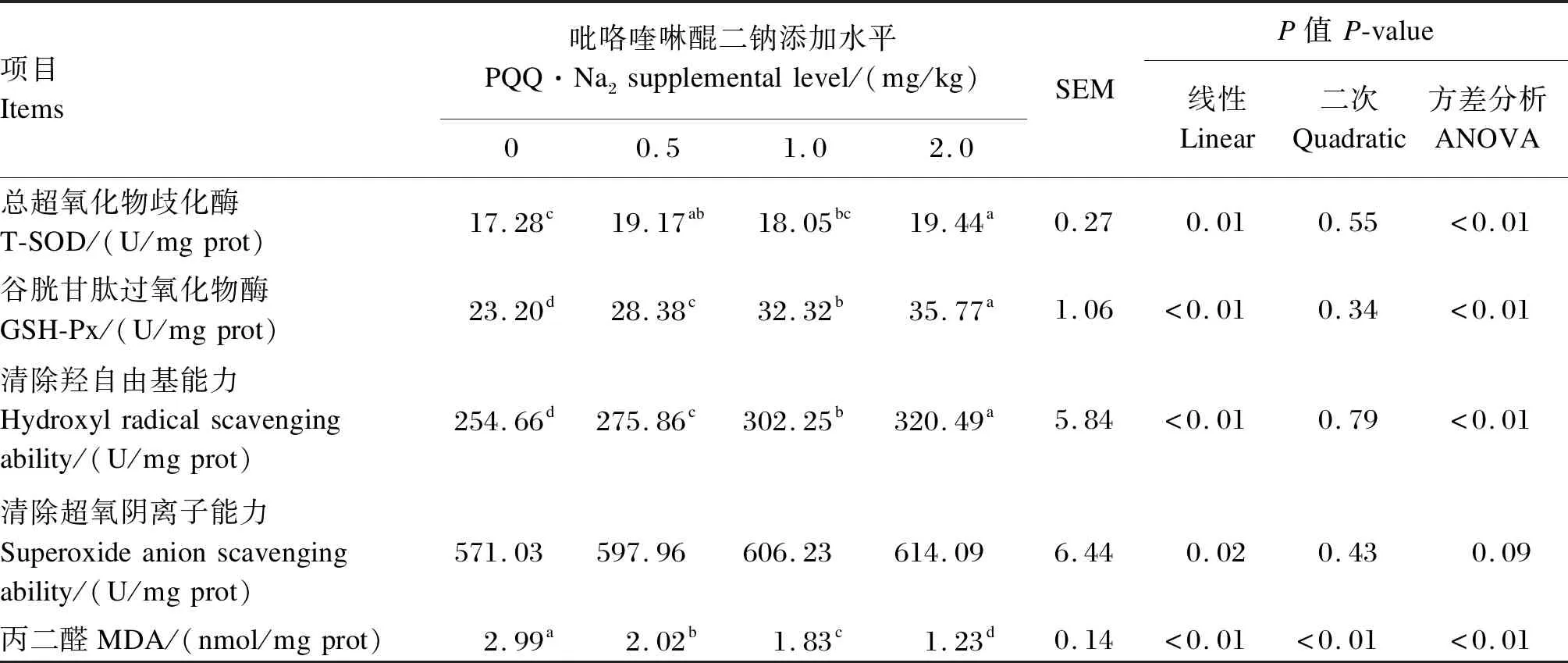
表4 饲粮添加不同水平PQQ·Na2对种公鸡肾脏抗氧化能力的影响Table 4 Effects of different dietary supplemental levels of PQQ·Na2 on renal antioxidant capacity of breeder cocks
由表5可知,随着饲粮 PQQ·Na2添加水平的增加,睾丸中T-SOD、GSH-Px活性以及清除超氧阴离子能力和清除羟自由基能力呈线性增加(P<0.05),睾丸中MDA含量线性降低(P<0.05)。1.0和2.0 mg/kg PQQ·Na2组睾丸中T-SOD活性和清除超氧阴离子能力显著高于对照组和0.5 mg/kg PQQ·Na2组(P<0.05),同时1.0和2.0 mg/kg PQQ·Na2组睾丸中MDA含量显著低于对照组(P<0.05)。饲粮PQQ·Na2添加水平从0增加到2.0 mg/kg,睾丸中GSH-Px活性增加了40.4%(P<0.05)。与对照组相比,饲粮中添加1.0和2.0 mg/kg PQQ·Na2显著提高了睾丸清除超氧阴离子能力和清除羟自由基能力(P<0.05)。
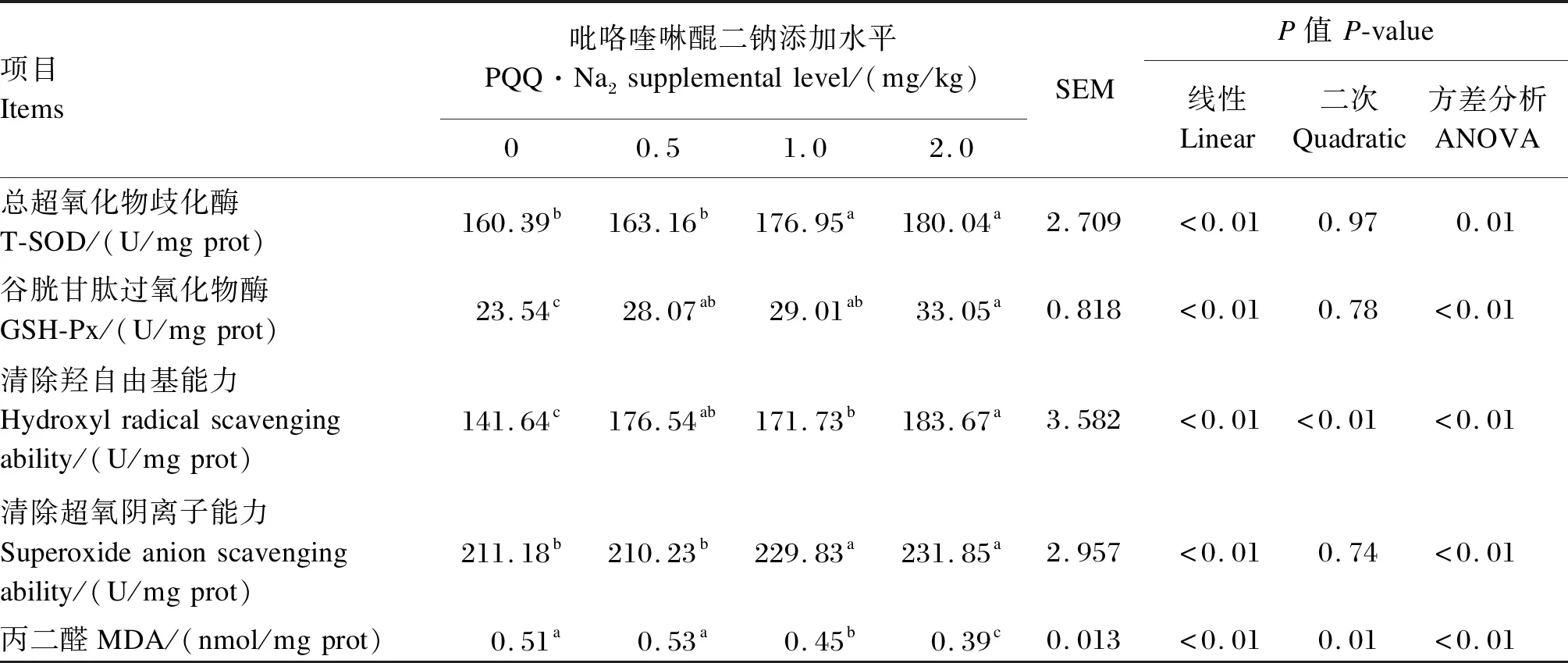
表5 饲粮添加不同水平PQQ·Na2对种公鸡睾丸抗氧化能力的影响Table 5 Effects of different dietary supplemental levels of PQQ·Na2 on testicular antioxidant capacity of breeder cocks
2.2 饲粮添加不同水平PQQ·Na2对种公鸡睾丸组织形态的影响
由表6可知,与对照组相比,各PQQ·Na2添加组的生精小管直径和生精上皮厚度均显著增加(P<0.05)。同时,1.0 mg/kg PQQ·Na2组的生精小管直径和生精上皮厚度均大于其他PQQ·Na2添加组(P<0.05)。由图1可知,与对照组相比,在各PQQ·Na2添加组中观察到在曲细精管内生精细胞数量增加,且1.0 mg/kg PQQ·Na2组优于其他组。
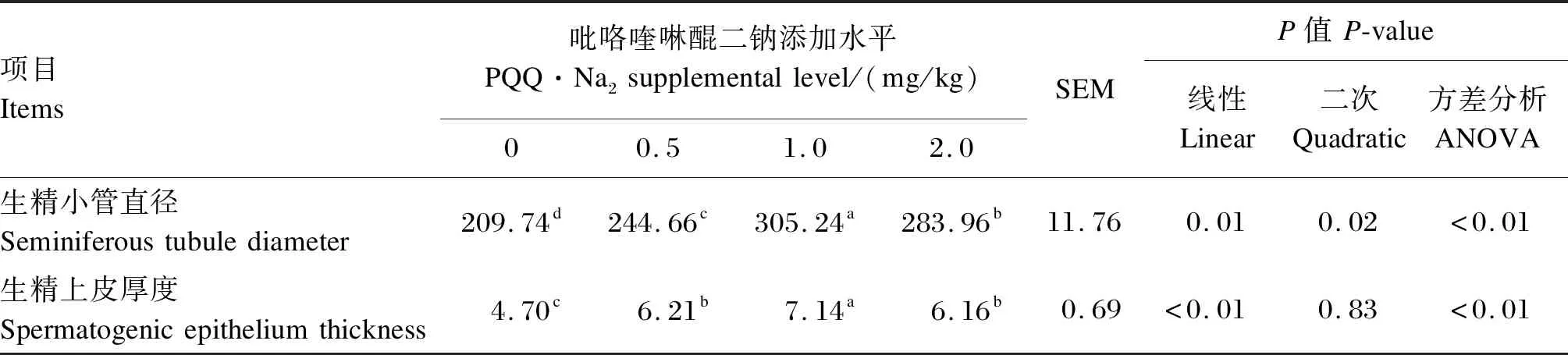
表6 饲粮添加不同水平PQQ·Na2对种公鸡睾丸组织形态的影响Table 6 Effects of different dietary supplemental levels of PQQ·Na2 on testicular morphology of breeder cocks μm

A、B、C和 D分别代表对照组和 0.5、1.0、2.0 mg/kg PQQ·Na2组。A,B,C and D represented control group and 0.5,1.0,2.0 mg/kg PQQ·Na2 groups,respectively.图1 各组种公鸡睾丸组织切片Fig.1 Testicular tissue sections of breeder cocks in each group (200×)
3 讨 论
3.1 饲粮添加不同水平PQQ·Na2对种公鸡抗氧化能力的影响
种公鸡精液中含大量多不饱和脂肪酸,其极易被氧化,进而影响精液品质。PQQ是一种氧化还原酶辅酶,具有较强的抗氧化作用。本团队前期研究结果表明,饲粮添加PQQ·Na2可显著提高种公鸡繁殖性能[7]。因此,本试验推测PQQ·Na2可通过提高种公鸡机体的抗氧化能力改善其繁殖性能。
机体内含有微量的PQQ·Na2,研究表明动物从饲粮中补充一定量的PQQ·Na2才可达到自身发育生长的需要量。PQQ·Na2具有较强的清除自由基能力,PQQ·Na2的清除超氧阴离子能力和清除羟自由能力比坏血酸高30~50倍,在正常生理条件下,体内既有自由基生成同时也有自由基被清除,因此自由基总量维持在动态平衡的某一个量左右。本试验中试验动物采用的是440日龄的京红1号种公鸡,这个时期的种公鸡机体产生老化,机体氧化应激水平相对较高,因此本试验旨在研究PQQ·Na2是否能改善老龄种公鸡的氧化应激状态。本试验结果表明,饲粮添加1.0和2.0 mg/kg PQQ·Na2显著提高了京红1号种公鸡血清、肝脏及睾丸中T-SOD、GSH-Px活性及清除羟自由基能力、清除超氧阴离子能力与肾脏中T-SOD、GSH-Px活性及清除羟自由基能力,降低了京红1号种公鸡血清、肝脏、肾脏及睾丸中MDA含量,这表明PQQ·Na2在老龄种公鸡机体内具有很高的抗氧化效率。
肝脏是胆固醇的储存中心。胆固醇首先从小肠吸收后,运输到肝脏,然后以高密度脂蛋白(HDL)-胆固醇的形式重新分配到靶器官(如肾脏和睾丸)[8]。肝脏受到氧化应激后,易引起肝细胞死亡及其组织损伤[9]。因此,肝脏的脂质过氧化可能对HDL的运输有负面影响,而HDL对维持肝脏和肾脏的功能具有重要作用,最终影响精子的质量。本试验结果表明,饲粮添加1.0和2.0 mg/kg PQQ·Na2显著提高了肝脏中T-SOD、GSH-Px活性及清除羟自由基能力和清除超氧阴离子能力,这与Qiu等[10]的研究结果一致。且本试验表明,与1.0 mg/kg PQQ·Na2组相比,饲粮添加2.0 mg/kg PQQ·Na2未进一步改善种公鸡肝脏中抗氧化指标。这可能是添加1.0 mg/kg PQQ·Na2已达到提高种公鸡抗氧化能力的极限,因肝脏MDA含量在添加2.0 mg/kg PQQ·Na2后亦未见进一步降低。
睾丸是精子发生的场所。精子发生是一个非常活跃的复制过程,能够每秒产生大约1 000个精子。该过程中较高的细胞分裂率意味着上皮细胞消耗线粒体氧的相应速率较高。因此该过程极易受到氧化应激[1]。饲粮添加1.0和2.0 mg/kg PQQ·Na2显著提升了种公鸡肾脏和睾丸组织的抗氧化能力,这可进一步提升种公鸡的抗氧化能力。Kumar等[11]同样报道PQQ·Na2能显著提高小鼠肾脏和睾丸的抗氧化能力。同样有报道指出,PQQ具有清除自由基的能力[12]。在睾丸组织中,同样表现为饲粮添加2.0 mg/kg PQQ·Na2未进一步改善种公鸡肝脏中抗氧化指标。这提示饲粮中添加1.0 mg/kg PQQ·Na2已达到提高种公鸡抗氧化能力的上限。
3.2 饲粮添加不同水平PQQ·Na2对种公鸡睾丸组织形态的影响
PQQ的有益作用也反映在生精小管直径和生精上皮厚度的改变上。饲粮添加PQQ·Na2显著增加了生精小管直径和生精上皮厚度,同时还增加了生精细胞的数量。Kumar等[13]研究同样表明,饲粮添加PQQ·Na2可改善小鼠曲细精管直径和生精上皮厚度。这可能是因为PQQ·Na2可防止老龄种公鸡睾丸的氧化损伤,从而促进了生精小管和生精上皮的生长。
结合本团队前期的结果[7],PQQ·Na2改善种公鸡繁殖性能的可能机制可能是源于其较强的抗氧化特性,保护了机体免受氧化损伤(尤其是睾丸组织),从而保护了精子发生的过程。
4 结 论
基于上述结果,饲粮中添加1.0 mg/kg的PQQ·Na2改善了老龄种公鸡的抗氧化能力,提高种公鸡睾丸生精小管直径和生精上皮厚度,而更高添加水平(2.0 mg/kg)未进一步改善机体抗氧化能力。
