海参粉微丸制备工艺
2023-02-08喻樊蔡蓉蔡伶丽
喻樊 *,蔡蓉,蔡伶丽
1. 江苏省肿瘤靶向纳米诊疗材料工程研究中心,盐城师范学院盐城(盐城 224007);2. 药学院盐城师范学院(盐城224051);3. 江苏省滩涂生物资源与环境保护重点建设实验室(盐城 224002);4. 南京工业大学(南京 210000)
海参属于棘皮动物门海参纲的动物,大多分布在世界各大海洋的潮间带及深海海域。近年来,随着人们保健意识和生活水平的提高,海参的药用价值和保健价值受到越来越多的关注。大量研究表明,海参富含海参多糖、胶原蛋白、海参皂苷和脑苷脂等生物活性物质及18种氨基酸,具有抗肿瘤、抗氧化、降血压、降血糖和增强免疫力等药理作用[1-5]*。海参粉中海参多糖的含量最高,约占干海参总有机物的31%[6]*。海参多糖主要为海参糖胺聚糖,能提高机体的细胞免疫功能,促进淋巴细胞增长,增加胸腺指数,从而起到增强免疫力的作用;具有清除氧自由基的能力;能增加血纤维蛋白酶的活力,以防止血纤维蛋白的聚合,并改变血纤维蛋白的构筑,从而起到抗血栓的作用[7]*。
微丸属于多单元型给药系统,与单剂量型给药系统相比有许多优点:(1)每个给药剂量通常含有几十或几百个微丸,释药行为是所有微丸的总和;(2)在胃内的滞留时间长,粒径小,转运受食物输送节律的影响较小,因此微丸在胃肠道内的吸收一般不受胃排空的影响;(3)药物在胃肠道内的分布面积扩大,生物利用度提高,且对胃肠道的刺激减少或消除。此外,微丸还具备生产工艺简洁、流动性好、脆碎度小、稳定性强等优点[8]*。
常见的微丸制备工艺有包衣锅法、离心造粒法、流化床包衣法和挤出滚圆法[9-10]*。采用挤出滚圆法制丸,制粒种类广泛、微丸粒径分布均匀、圆整度好、载药量高[11]*。试验采用的是挤出滚圆法,并利用单因素试验对工艺参数进行优化,考察微丸的粉体学性质并对微丸进行表征。
1 材料与方法
1.1 仪器与设备
E-50挤出制粒机、R-250离心滚圆机(均为重庆英格制药设备制造有限公司);FD-1D-80冷冻干燥机(北京博衣康实验仪器有限公司);IKA研磨机、CS-2脆碎度测试仪(均为天津市国铭医药设备有限公司);布鲁克TENSORⅡ研究级傅里叶变换红外光谱仪(德国布鲁克光谱仪器公司);SDP电子天平[赛多利斯科学仪器(北京)有限公司];三目生物显微镜XSP-8C(上海严丰精密仪器有限公司);Lambda 950紫外分光光度计(美国PE公司);环境扫描电子显微镜(Quanta 200,荷兰FEI公司);FT-104B休止角测定仪(宁波瑞柯伟业仪器有限公司);DSC 8500差示扫描量热仪(美国PerkinElmer);Millipore Q超纯水系统(美国Merck)。
1.2 材料与试剂
淡干海参(烟台瑞参堂水产有限公司);玉米淀粉(广饶丽枫生物科技有限公司,批号2016032601);碳酸钙(宜兴市第二化学试剂厂,批号070613);微晶纤维素(国药集团化学试剂有限公司,批号20130802);其他试剂为分析纯。
1.3 试验方法
1.3.1 海参粉的制备
(1)回软:在淡干海参中倒入0~5 ℃纯净水,置于4 ℃冰箱中泡发24~48 h,每12 h换1次水。
(2)去沙嘴:用剪刀将海参开膛去沙嘴,去除海参的内脏。
(3)水煮:将海参放入锅中小火煮70~90 min。
(4)泡发:出锅后用凉水冲洗海参,将其用0~5 ℃纯净水泡发,置于4 ℃冰箱保存2~3 d,每12 h换1次水。
(5)冷冻保存:将上述泡发完成后的海参剪成厚度约2 cm小块装在培养皿中,冷冻保存24 h左右。
(6)冷冻干燥:将冷冻后的海参放入冷冻干燥机进行冷冻干燥。
(7)粉碎机粉碎:将干燥后的海参放入研磨机中进行粉碎,将粉碎后的海参粉放入干燥器中保存。
1.3.2 微丸的制备[12]*
(1)混合:将物料混合均匀。
(2)制软材:将混合均匀的物料与10%淀粉浆捏合均匀。
(3)挤出:将软材握成团后放入挤出制粒机中,挤成直径相同的条状软材。
(4)滚圆:将挤出的软材倒入离心滚圆机中进行滚圆。
(5)微丸干燥:将滚圆好的微丸放入烘箱(60~80 ℃)干燥。
空白微丸的制备处方:碳酸钙40 g、微晶纤维素10 g。
海参粉微丸的制备处方:海参粉2.0 g、碳酸钙10.0 g、微晶纤维素3.2 g。
1.3.3 工艺因素考察
由于挤出频率、滚圆频率和滚圆时间对试验的结果影响较大,因此以圆整度为主要的评价指标,利用单因素试验筛选出最佳的制备工艺参数。
1.3.3.1 挤出频率的考察
挤出频率是影响挤出物料质量的一个重要因素。若挤出频率过快,软材温度升高,造成软材中水分丧失,成形性变差;若挤出频率过慢,则耗时长,软材容易变干,不易滚圆[13]*。固定滚圆频率50 Hz、滚圆时间4 min,考察挤出频率30,40和50 Hz时对微丸成丸效果影响。
1.3.3.2 滚圆频率的考察
滚圆为条状软材提供剪切力和离心力,若滚圆频率太低,细长条软材难以切断,无法形成微丸。固定挤出频率30 Hz、滚圆时间4 min,考察滚圆频率30,40和50 Hz时对微丸的成丸效果影响。
1.3.3.3 滚圆时间的考察
在一定的范围内,滚圆时间越长,微丸的圆整度越好。但时间过长,则造成微丸的粒径增大或粘连,且粉尘增多;时间过短,软材则不易塑变成球形[14]*。固定挤出频率30 Hz、滚圆频率50 Hz,考察滚圆时间4,6和8 min时对微丸的成丸效果影响。
1.3.4 粉体学性质的测定
1.3.4.1 海参粉粉体学性质的测定
1.3.4.1.1 流动性的测定
将海参粉、碳酸钙和微晶纤维素倒入漏斗中,使其在重力的作用下做自由落体运动,在漏斗下方形成圆锥体,测量圆锥体的高度(h)和半径(r),计算出休止角。
1.3.4.1.2 松密度的测定
将一定量的海参粉倒入量筒中,在没有外力的作用下,测定海参粉的密度,即松密度[15]*。
1.3.4.2 微丸粉体学性质的测定
1.3.4.2.1 粒度分布
采用筛析法测定空白微丸的粒度分布。称取40 g微丸,用标准筛筛分3 min,称量通过不同孔径筛孔的微丸的质量,记录数据,绘制粒度分布图。
1.3.4.2.2 休止角的测定
使用休止角测定仪测量空白微丸的休止角。将空白微丸倒入漏斗中,使其在重力作用下做自由落体运动,空白微丸落到表面皿中形成圆锥体,测量空白微丸的锥形高度(h)和微丸在表面皿中的半径(r),θ为休止角,按式(1)计算[16]*。

1.3.4.2.3 表面形态和圆整度
通过生物显微镜观察微丸的表面形态,利用HRT1000图像颗粒软件拍摄图片并测定圆整度。
1.3.4.2.4 堆密度的测定
称取20 g微丸,缓缓通过玻璃漏斗倾倒至50 mL量筒内,测出微丸的松容积,按式(2)计算出微丸的堆密度。
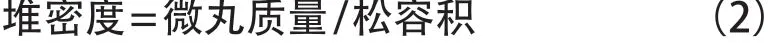
1.3.4.2.5 脆碎度的测定
称取质量m0的微丸倒入脆碎度仪,转速24 r/min,旋转圈数100 r。收集并称量剩下微丸质量m,按式(3)计算脆碎度Fr。

1.3.5 微丸的表征
1.3.5.1 扫描电子显微镜法(SEM)
以海参粉、空白微丸、海参粉微丸、海参粉微丸的横切面、空白微丸的横切面和经人工胃液腐蚀5 s的海参粉微丸作为样品,喷金15 s后,置于电镜测试仪器内,于高压15.00 kV进行测定。
1.3.5.2 红外光谱
以海参粉、碳酸钙、微晶纤维素、空白微丸、物理混合物和海参粉微丸作为样品,分别在400~4 000 cm-1*范围内检测红外吸收光谱,记录数据并作图[17]*。
1.3.5.3 X射线衍射法(XRD)
以海参粉、碳酸钙、微晶纤维素、空白微丸、物理混合物和海参粉微丸作为样品进行XRD分析。检测的条件:Cu靶,K线;扫描方式,定性,步进扫描;管压40 kV,管流30 mA,扫描步长0.02°,扫描范围10°~80°,扫描速度2°/min。取干燥后的样品研磨,压片,置于X射线粉末衍射仪上;设置衍射参数(10°~80°,10°/min)[18]*,记录数据并作图。
2 结果与分析
2.1 工艺因素的确定
2.1.1 挤出频率的确定
固定滚圆频率50 Hz、滚圆时间4 min,考察挤出频率30,40和50 Hz时对微丸成丸效果影响,试验结果见表1。
由表1可知,挤出频率为30 Hz时,微丸的圆整度较好,因此挤出频率确定为30 Hz。
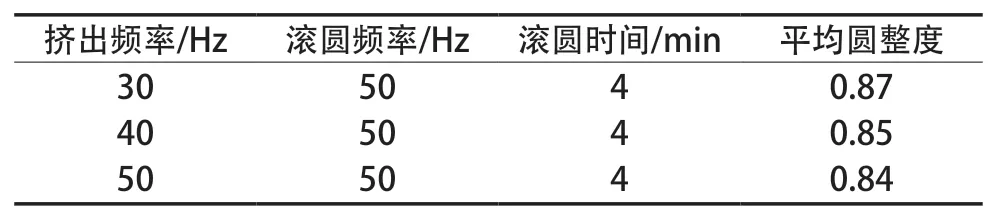
表1 挤出频率对微丸圆整度的影响
2.1.2 滚圆频率的确定
固定挤出频率30 Hz、滚圆时间4 min,考察滚圆频率30,40和50 Hz时对微丸的成丸效果影响,试验结果见表2。
由表2可知,滚圆频率50 Hz时,微丸的圆整度较好,因此滚圆频率确定为50 Hz。
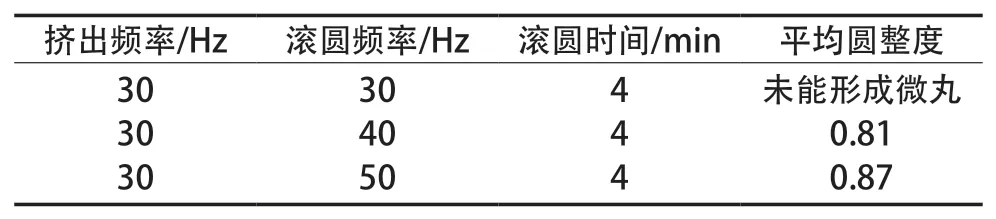
表2 滚圆频率对微丸圆整度的影响
2.1.3 滚圆时间的确定
固定挤出频率30 Hz、滚圆频率50 Hz,考察滚圆时间4,6和8 min时对微丸的成丸效果影响,试验结果见表3。
由表3可知,滚圆时间4 min时,微丸的圆整度较好,因此滚圆时间确定为4 min。
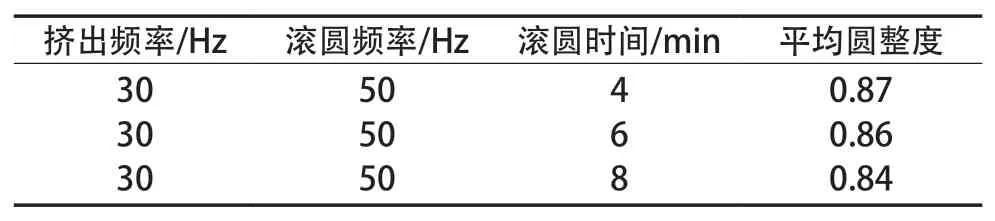
表3 滚圆时间对微丸圆整度的影响
综上所述,微丸的最佳制备工艺参数为挤出频率30 Hz、滚圆频率50 Hz、滚圆时间4 min。
2.2 粉体学性质结果分析
2.2.1 海参粉的粉体学性质结果分析
2.2.1.1 海参粉的流动性
通常休止角的大小可判定流动性。海参粉、碳酸钙、微晶纤维素的休止角分别为56.3°,34.1°和38.2°,可见海参粉的流动性差,但两种辅料的流动性均较好,可充当助流剂。
2.2.1.2 海参粉的松密度
通过计算,海参粉的松密度为0.08 g/mL,表明其密度小,因而制软材时应注意物料的加入顺序,先加入海参粉,再依次加入碳酸钙、微晶纤维素。
2.2.2 微丸的粉体学性质
2.2.2.1 微丸的粒度分布
微丸的粒度分布见图1。结果表明,空白微丸的粒度分布范围窄。

图1 空白微丸的粒度分布
2.2.2.2 微丸的流动性
微丸的休止角为38.7°。表面微丸的流动性基本符合要求。
2.2.2.3 微丸的表面形态
微丸的显微镜图片见图2。微丸的表面形态好,测得的圆整度均大于0.8,表明微丸形态基本合格。

图2 微丸显微镜图片
2.2.2.4 微丸的堆密度
利用式(2)计算得微丸的堆密度为1.4 g/mL。
2.2.2.5 微丸的脆碎度
利用式(3)计算得微丸的脆碎度为4.2%。
2.3 微丸的表征
2.3.1 扫描电子显微镜(SEM)分析
测试结果见图3。由图3(A)可以看出海参粉呈现片状和块状的形态。由图3(B和C)可以看出,空白微丸和海参粉微丸的圆整度均好,但2种微丸的表面粗糙,存在皱褶或裂缝,这可能是微丸干燥时被挤压造成的[19]*。将海参粉微丸与经人工胃液腐蚀5 s的海参粉微丸比较,后者的表面形态比前者差,其他并无差别,可能由于腐蚀的时间短,微丸的溶出效果不明显。观察空白微丸和海参粉微丸的横切面,可见两者的横切面均有缺口,可能因微丸干燥后药物或辅料缩水而造成。

图3 扫描电子显微镜结果
2.3.2 红外分析
红外光谱结果见图4。由于海参粉中富含大量氨基酸,氨基酸含有氨基和羧基,因此海参粉在3 315 cm-1*处有一个强度较弱的单峰,为N—H的伸缩振动;在1 536 cm-1*处为N—H的变形振动;在1 656 cm-1*处为羧基的特征吸收峰。碳酸钙红外吸收曲线在1 795 cm-1*出现的是C—O伸缩振动峰,在1 403 cm-1*出现C—O反对称伸缩振动,而在873 cm-1*出现CO32-*面外变形振动峰,在710 cm-1*处是O—C—O的面内变形振动峰。微晶纤维素的红外谱图中位于1 165 cm-1*处有C—O不对称伸缩振动峰,位于1 432 cm-1*处是O—H弯曲振动峰,位于1 647 cm-1*处是纤维素分子吸附水分子而出现的吸收峰,位于2 909 cm-1*处是C—H伸缩振动峰,而位于3 328和3 408 cm-1*处的宽峰是分子内氢键O—H伸缩振动峰。空白微丸在710和873 cm-1*的特征峰是由碳酸钙引起的,而在2 915 cm-1*处的特征峰是由微晶纤维素引起的,说明空白微丸中含有碳酸钙和微晶纤维素。物理混合物在710和873 cm-1*的特征峰是由碳酸钙引起的,但未检测到微晶纤维素和碳酸钙的吸收峰,可能因为碳酸钙量多,遮盖微晶纤维素和海参粉。而在海参粉微丸的红外谱图中,有碳酸钙和微晶纤维素的特征峰,但没有海参粉的特征峰,说明海参粉在制备过程中可能进入微丸内部,因而未检测到海参粉的特征峰。
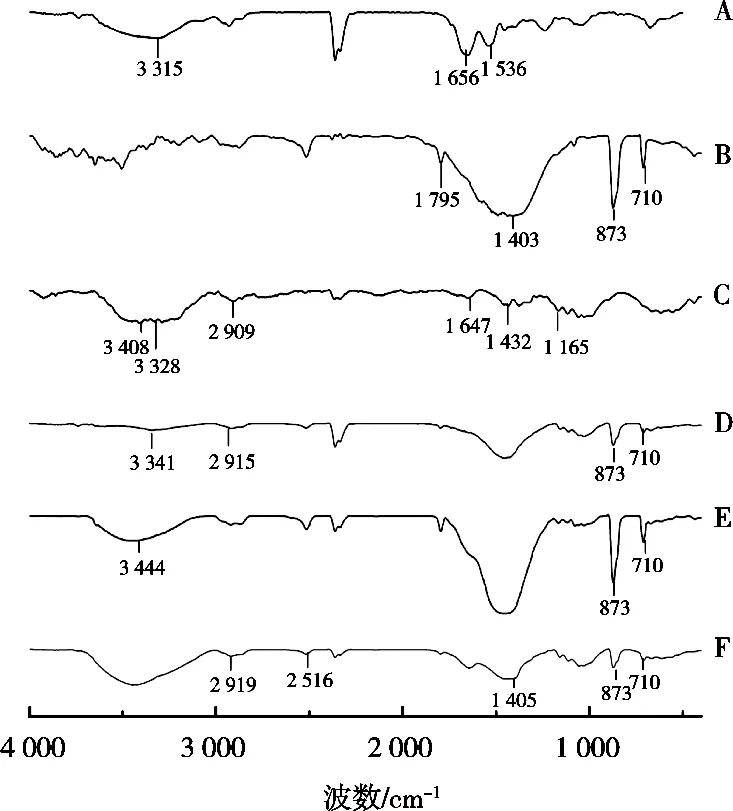
图4 红外吸收光谱
2.3.3 X射线衍射法(XRD)分析
XRD结果见图5。由曲线(A)可知,海参粉的峰形又宽又大,说明海参粉为非晶体物质。由曲线(B)可知,碳酸钙在30°左右呈现很强的衍射峰,表明其为晶体结构[20]*。微晶纤维素由于其结晶性质在23°有一个尖锐的衍射峰。由曲线(D)可知,空白微丸中含有碳酸钙和微晶纤维素的衍射峰,说明空白微丸中含有这两种辅料。由曲线(E)可知,物理混合物中只有辅料的衍射峰,可能由于海参粉的量少,被辅料掩盖,因而未发现海参粉的衍射峰,而海参粉微丸中也未出现海参粉的衍射峰,可能由于海参粉以无定形的形式高度分散于微丸中。
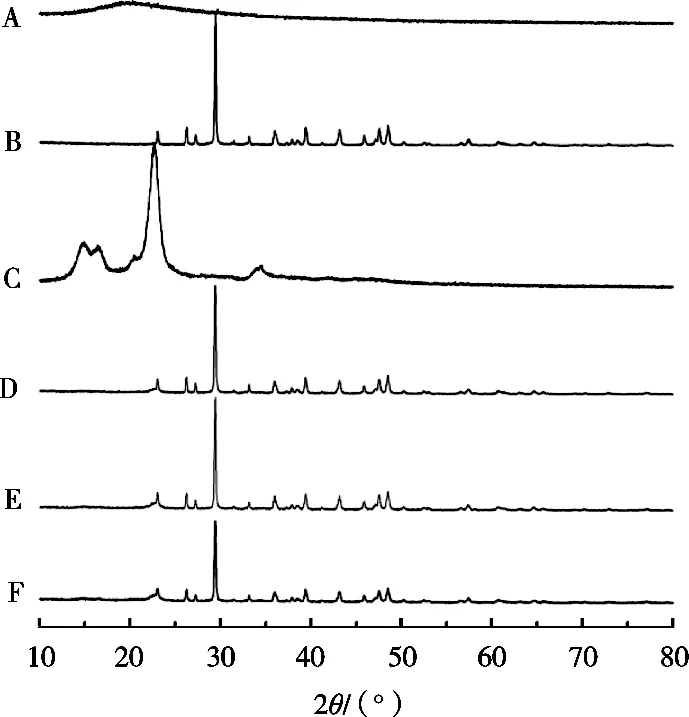
图5 X射线衍射法(XRD)测试结果
3 讨论与结论
常用的制备微丸所用辅料为微晶纤维素、淀粉、糊精和蔗糖。但是利用微晶纤维素所制备的微丸成品率不高,微丸密度也不高,并且微晶纤维素价格较昂贵,制备成本高,而利用淀粉和蔗糖制备的微丸不适用于患糖尿病的患者。为克服上述辅料存在不足,选用碳酸钙作为微丸的辅料。碳酸钙来源广且价格便宜,制备的微丸具有成品率高、密度高、脆碎度低、粒径分布窄、圆整度好等优点,还具有补钙效果。因此采用碳酸钙为辅料,微晶纤维素为成球促进剂,10%淀粉浆为黏合剂,再加入海参粉,利用挤出滚圆法制备海参粉微丸。
采用单因素试验考察制备工艺参数时发现:挤出频率不宜太快,若太快会导致物料分散,无法挤出;滚圆频率不宜太小,若太小会导致细长条软材无法切断,不易成丸;滚圆时间不宜太长,若太长会导致软材变干,出现许多细粉,微丸的圆整度也不高。
通过紫外和红外光谱分析,海参粉微丸中药物的结构没有发生改变,这有利于保持其原有的生物活性,差示扫描量热法和X射线衍射法结果表明,药物高度分散于微丸中。因此,试验制备海参粉微丸的方法具有可行性,为海参产品的进一步开发提供技术参考。
