不同阳极设置对人工湿地-微生物燃料电池脱氮及产能的影响
2023-02-07李朝明许丹黄铭意唐顺静韩胡威
李朝明,许丹,黄铭意,唐顺静,韩胡威
东华理工大学水资源与环境工程学院
随着环境污染和能源资源匮乏的加剧,发展资源化与能源化的污水处理工艺已成为当前污水处理领域关注的热点。微生物燃料电池(microbial fuel cell,MFC)是一种利用微生物作为生物催化剂,将有机物转化为电能的新型污水处理系统[1]。然而,目前MFC产电效率低且影响因素较多,限制了其在实际污水处理中的规模化应用。其中,阳极表面与微生物之间较低的电子传递效率是导致MFC产电效率低的关键原因[2]。目前,主要有2种提高阳极电子转移效率的方式[3]:1)通过电化学方法处理电极或用官能团修饰电极来提高细菌的黏附力和阳极的比表面积,这些官能团可以促进微生物附着在阳极上,促进电子从微生物转移到阳极上;2)使用高比表面积的导电材料,如碳纳米管、石墨烯和碳化物作为阳极,以降低阳极过电位,促进电子转移。然而,这些材料和方法价格昂贵且复杂,阻碍了其在MFC中的实际应用。
近年来,将MFC与其他现有技术(如活性污泥法[4]、膜生物反应器[5]、人工湿地[6]等)耦合不仅可实现电能的有效利用,同时还可以强化污染物的去除,因此该方面的研究已成为研究者关注的热点。人工湿地(constructed wetland,CW)是在自然湿地的基础上发展而来的一种生态处理工艺,由植物、填料和微生物组成,具有成本低、易维护且净化效果好等优势,近年来被广泛应用于污水处理领域。由于人工湿地中好氧区和厌氧区之间存在层状的氧化还原电势梯度,因此可以简单地通过铜/钛金属丝连接放置于接近气-液界面好氧区和底部厌氧区的电极来构建人工湿地-微生物燃料电池(CW-MFC)耦合系统。目前,CW-MFC耦合系统的阴极通常采用以石墨毡、不锈钢网等为主的平面电极直接放置于气-液界面附近,而阳极则有2种常用的设置方式:1)直接将阳极放置于湿地填料层中[7];2)将上述平面电极作为集电极放置于以活性炭、石墨颗粒为代表的三维电极填料层中,以收集更多的电子[6,8]。从理论上来说,平面结构的电极只能为电活性细菌的附着提供有限的表面积,而颗粒状的三维电极在电场中可以形成带电的微电极,粒子的高导电性和较大的比表面积有助于加速传质和增强电子传递,因此,可能具有更好的污水处理效果。例如Srivastava等[9]的研究表明,将石墨颗粒引入阳极可提高耦合系统的产电性能和化学需氧量(COD)的去除率。但有关这方面的研究还较少,尤其是这2种阳极设置方式对污水中含氮污染物净化效果及微生物群落结构的影响仍需进一步探索。笔者构建了2套CW-MFC耦合系统,一套单独以石墨毡作为阳极,另一套同时以石墨毡和活性炭颗粒作为阳极,探究2套系统产电性能的差异以及对常规污染物(有机物和氨氮)的去除效果,以期为该耦合系统的优化设计提供参考。
1 材料与方法
1.1 CW-MFC耦合系统的构建
构建了2套上流式CW-MFC耦合系统的试验装置(图1),记为CW-MFC1和CW-MFC2。2套耦合系统除阳极层设置有所不同外,其余部分均完全一致。耦合系统主体由直径为20 cm、高5 cm的有机玻璃和直径为12 cm、高47 cm的有机玻璃上下堆叠而成,从下到上依次为衬托层、阳极层、隔离层、阴极及水生植物,衬托层和隔离层均由粒径为8~15 mm的砾石组成,湿地种植的水生植物为美人蕉。CW-MFC1耦合系统的阳极由宽10 cm,长15 cm,厚5 mm的石墨毡卷曲成圆柱体放置于砾石中,而CW-MFC2耦合系统的阳极由同样尺寸的石墨毡卷曲后放置于2~4 mm的椰壳活性炭中。2套CW-MFC耦合系统的阴极均采用直径为18 cm,厚度为5 mm的石墨毡放置于最顶部,其中阳极和阴极相距17 cm,通过钛丝和500 Ω的外部电阻连接。
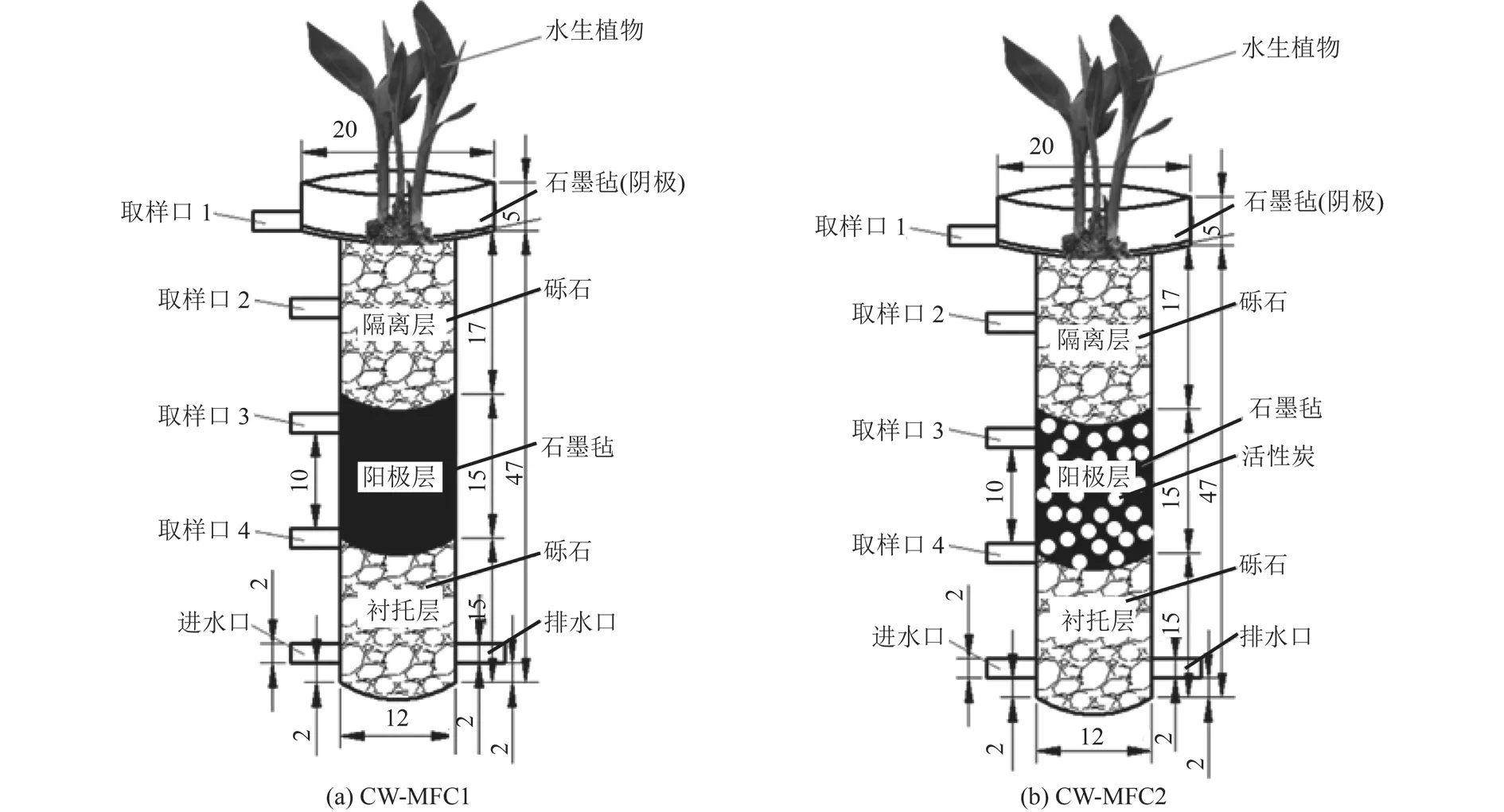
图1 CW-MFC耦合系统试验装置示意Fig.1 Schematic diagram of CW-MFC coupled system test devices
1.2 CW-MFC耦合系统的接种和启动
在CW-MFC耦合系统中接种来自南昌市某污水处理厂的好氧活性污泥。阴极石墨毡预先浸泡在好氧活性污泥中48 h进行微生物挂膜后再放入到耦合系统中,同时将长势均一的美人蕉(高度约40 cm)移栽至耦合系统中。污泥与配置的人工模拟配水(体积比为30%)混合均匀后一次性加入到耦合系统中,使泥水混合物和湿地中的填料、电极材料等充分接触后再一次性排空,每周更换耦合系统内接种液,连续2周输出电压变化幅度和氨氮去除率均在10%以内,则认为CW-MFC耦合系统驯化接种过程完成,此后无须向耦合系统中加入污泥。于2021年6月3日——8月7日进行接种驯化,驯化过程中植物长势良好,植株高度从初始的40 cm长到88 cm左右。耦合系统完成接种驯化后,进入正式试验阶段,时间为2021年8月8日——11月20日,共105 d。正式试验时,采用蠕动泵从耦合系统底部连续泵入人工模拟配水,进水流量为1.8 mL/min,水力停留时间(HRT)为24 h。人工模拟配水由乙酸钠、磷酸二氢钾、氯化铵、氯化钠等以自来水配置而成,配置药剂均为分析纯。试验过程进水水质指标:COD为303~331 mg/L,氨氮浓度为28.65~30.15 mg/L,水温为15.0~30.8 ℃,pH 为 6.9~7.2。
1.3 水样和电化学信号的采集与分析
在各耦合系统的取样口1处取约100 mL水样,水温采用便携式多参数分析仪(DZB-712)现场测定,其他水质指标(总氮、氨氮、COD)参考《水和废水监测分析方法》4版进行测定。其中,氨氮浓度采用纳氏试剂分光光度法测定,总氮浓度采用碱性过硫酸钾紫外分光光度法测定,COD采用哈希COD消解仪(DRB200,HACH,美国)快速消解后利用分光光度计测定。
CW-MFC耦合系统输出电压通过数据采集器(R6016/U,上海继升电器有限公司)每5 min记录一次。极化曲线表征的是MFC电压与电流密度的关系,常用于分析和描述MFC产电性能。采用手动改变外电阻的方式测定CW-MFC的极化曲线,调节外电阻从5万Ω到5 Ω,每个阻值下稳定15 min,并记录电阻两端的电压。电流密度采用欧姆定律计算,公式如下:

式中:J为电流密度,mA/m2;U为电池阳、阴两极的电压差,mV;Rex为外电阻,Ω;S为阳极石墨毡面积,m2。CW-MFC的总内阻则是通过计算极化曲线中线性区域的直线斜率求得。同理,功率密度采用欧姆定律计算,公式如下:

式中P为功率密度,mW/m2。
2套系统间的差异统计计算使用SPSS Statics 22.0 软件进行 one-way ANOVA (α=0.05)分析,所有统计结果在P<0.05时认为差异显著。
1.4 电极微生物群落分析
试验结束后,取出CW-MFC1和CW-MFC2耦合系统的阳极和阴极石墨毡,分别命名为1a、2a、1c和2c。将石墨毡样品剪成尽可能细小的碎片,以使样品表面的微生物可以与裂解液充分接触从而释放更多的DNA。样品送至上海生工生物工程有限公司进行高通量焦磷酸测序分析,以研究微生物群落结构。样品参照试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit(OMEGA,美国)进行DNA提取。采用引物341F/8056R用于PCR扩增细菌V3~V4区 16S rRNA基因。将扩增好的PCR产物的2个末端加上接头,采用Illmnina公司的Miseq测序仪进行测序分析。测序得到的数据通过过滤和去除低质量碱基处理后,得到有效序列。使用Usearch软件按97%的相似性将有效序列进行OTU聚类,得到OTU代表序列。采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,并分别在门和属水平上统计每个样本的群落组成。
2 结果与讨论
2.1 产电性能比较
CW-MFC耦合系统外电路电压、功率密度曲线和极化曲线如图2所示。由图2(a)可知,CW-MFC1、CW-MFC2平均输出电压分别为251和298 mV,其中CW-MFC2耦合系统的输出电压显著高于CW-MFC1耦合系统。此外,CW-MFC2耦合系统输出电压的稳定性明显要高于CW-MFC1。本研究结果与Srivastava等[9]的研究结果相近,活性炭颗粒引入阳极有效增大了系统的产电性能。CW-MFC1耦合系统所采用的平板状石墨毡阳极,理论上只能收集电极附近“短距离”区域内污染物转化产生的电子;而CW-MFC2耦合系统所采用的活性炭颗粒和石墨毡组成的复合电极可有效提高石墨毡的作用范围,提高阳极电子的收集量,进而提高系统的产电性能。由图2(b)可知,CW-MFC1 和 CW-MFC2 耦合系统的最大功率密度分别为7.77和8.39 mW/m2,且CW-MFC2比CW-MFC1电压降低更为明显。一般而言,MFC的总内阻由欧姆内阻、活化内阻、扩散内阻3个部分组成[10]。随着电流密度的增加,输出电压因欧姆内阻近似呈线性下降,因此可通过极化曲线的斜率求得CW-MFC耦合系统的表观内阻,其分别为424和329 Ω。
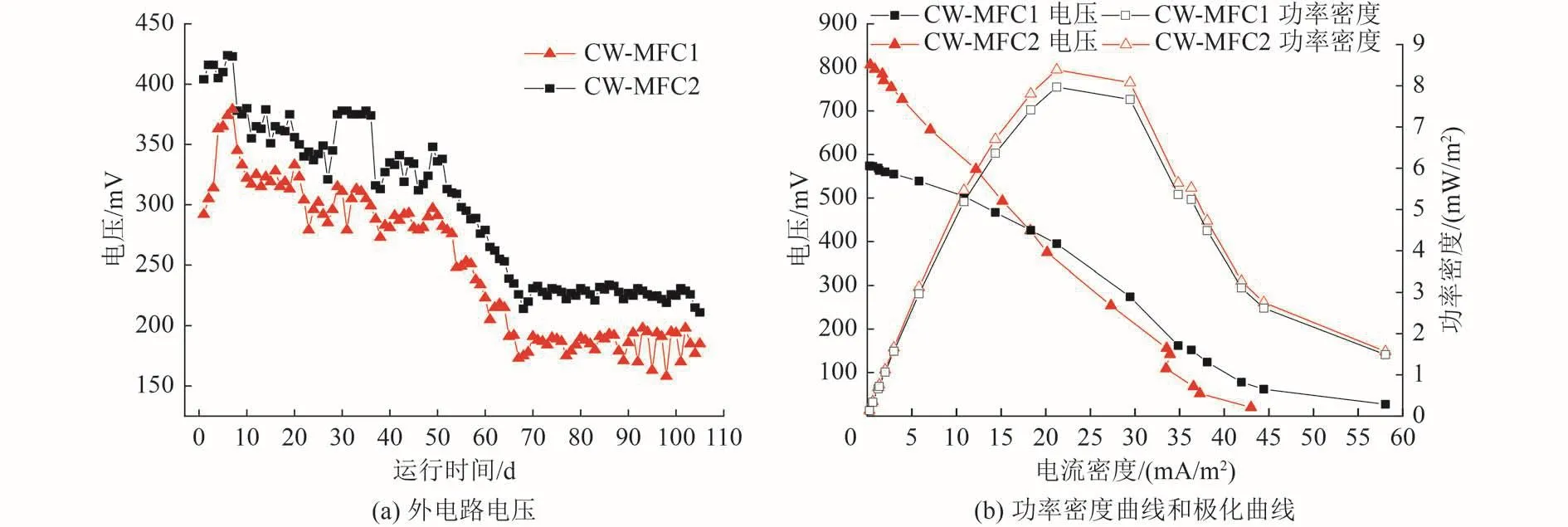
图2 CW-MFC耦合系统外电路电压、功率密度曲线和极化曲线Fig.2 Output voltage, power density curve, and polarization curve of CW-MFC coupling system
2.2 污染物去除效果比较
试验运行过程中CW-MFC耦合系统污染物去除性能变化如图3所示。由图3(a)和图3(b)可知,随着运行时间的延长,CW-MFC1和CW-MFC2耦合系统的氨氮和总氮去除效果呈现出不同的变化趋势。在试验运行0~29 d,CW-MFC2耦合系统的氨氮去除率为65.72%±3.06%,显著高于CW-MFC1的56.06%±3.71%(P<0.05),而二者的总氮去除率相差不大,分别为 43.48%±5.72%和 43.63%±5.00%(P>0.05)。随着时间的推移,CW-MFC1耦合系统的氨氮和总氮去除率逐渐高于CW-MFC2,尤其总氮去除更为显著。30~105 d,CW-MFC1耦合系统的氨氮和总氮去除率分别为55.75%±6.47%和42.69%±4.19%,显著高于CW-MFC2的48.40%±8.47%和32.50%±11.51%(P<0.05)。整个试验过程中,总氮和氨氮去除率总体呈现下降的趋势,这可能与试验运行期间外界气温变化导致水温的持续降低有关(图4)。例如,当水温从28 ℃逐渐降低时,CW-MFC1和CW-MFC2耦合系统的氨氮和总氮去除率均整体下滑,其中CWMFC2下降更为显著。此外,整个运行期间CW-MFC2耦合系统的COD去除率为94.00%±5.39%,高于CW-MFC1(90.97%±5.40%),此结果也与 Srivastava等[9]的报道一致。
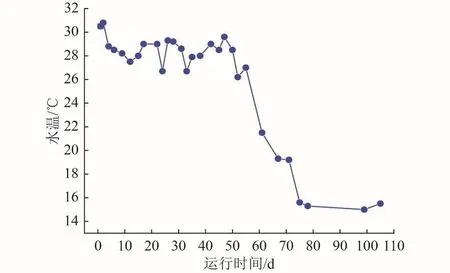
图4 CW-MFC耦合系统出水温度Fig.4 Effluent temperature of CW-MFC coupling system
植物吸收和微生物代谢被认为是人工湿地去除有机物和营养盐的主要方式[11-13]。对于上流式CW-MFC耦合系统来说,有机物的强化去除主要集中在湿地的阳极区域,而氮的强化去除则主要是作为阴极电子受体,接收阳极传递的电子从而将氧化态氮还原成氮气。三维阳极体系在CW-MFC耦合系统中的构建一方面显著增强了阳极的电子传递效率,提高了系统的产电性能〔图2(b)〕,另一方面也因此提高了有机物的去除率〔图3(c)〕。以往的研究结果也显示,COD的去除率往往与产电性能呈正相关[14]。然而,总氮和氨氮的去除率却并没有如COD一样呈现类似的变化趋势。如前所述,试验运行前期,三维阳极体系可有效强化CW-MFC耦合系统的氨氮去除率,然而随着时间的推移和温度的降低,三维阳极体系的氨氮和总氮去除率反而不如未添加活性炭颗粒的耦合系统。一般来说,温度降低主要是通过抑制植物的生长发育以及微生物的新陈代谢等生命活动从而对人工湿地脱氮效率产生负面影响。然而,本研究中2套CW-MFC耦合系统的脱氮效率虽然均整体下滑,但CW-MFC2下降更为明显。Xu等[15]的研究表明,CW-MFC耦合系统阴极数量的增多可显著增大耦合系统的产电性能,进而强化系统的总氮去除率,这同时也说明CW-MFC耦合系统对氨氮的强化去除主要依赖于产电过程,尤其是阴极的作用,即利用阴极作为电子供体将氧化态氮还原成氮气。本研究中CW-MFC2耦合系统较CW-MFC1具有更高的输出电压和功率密度,因此CW-MFC2的脱氮效率可能更依赖于阴极脱氮过程。由于阴极置于气-液界面处,直接与空气接触,因此温度的下降对阴极脱氮过程影响较大,从而导致CW-MFC2耦合系统脱氮效率降幅大于CW-MFC1。综上,本研究通过添加活性炭颗粒构建三维阳极体系,增大了系统的产电性能,但该系统对氨氮和总氮的去除却没有持续性的强化效果,该系统对不同污染物的去除效果,尤其是对污染物的还原去除效果还有待进一步考证。
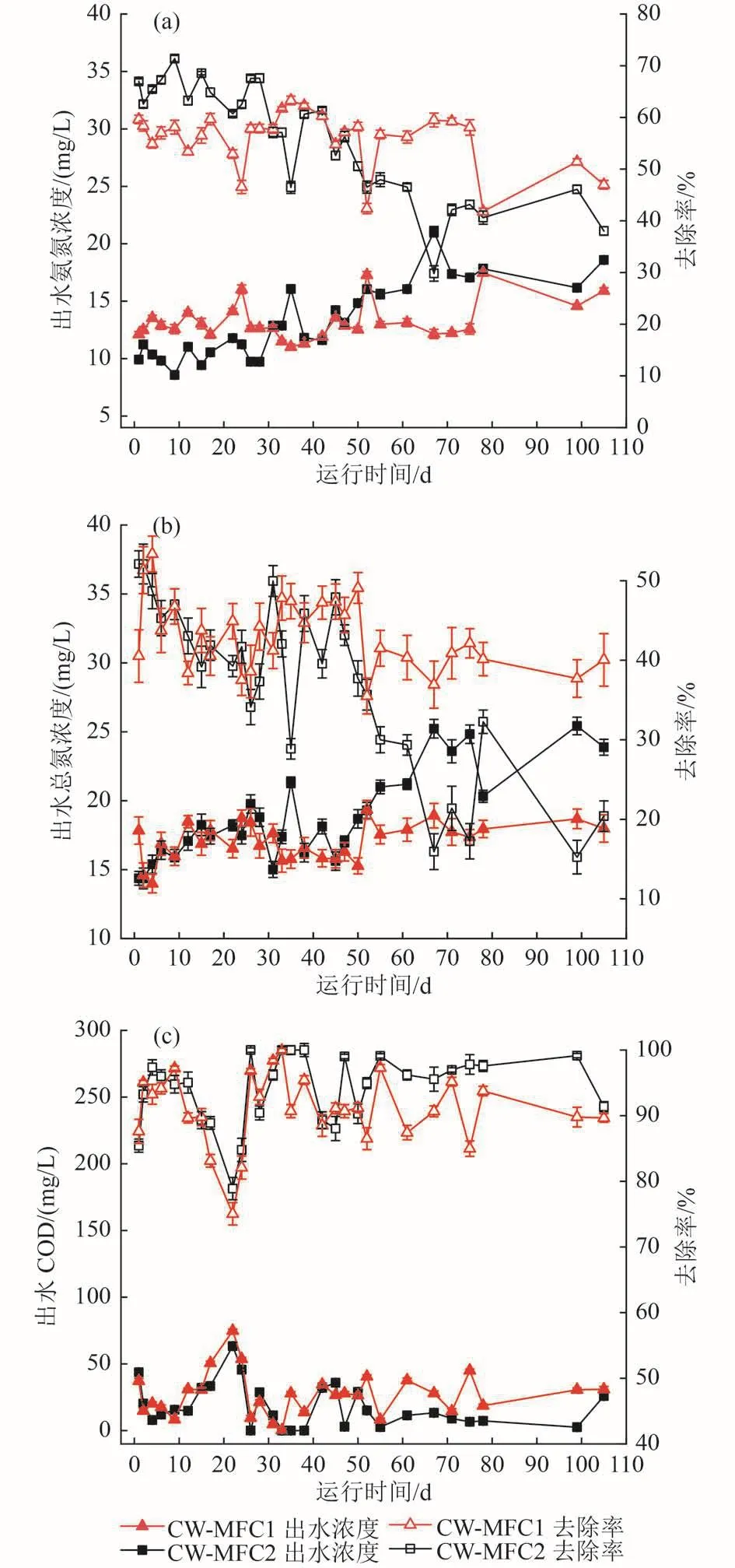
图3 CW-MFC耦合系统出水污染物浓度及其去除率Fig.3 Pollutant effluent concentrations and removal efficiencies of CW-MFC coupling system
2.3 电极微生物群落结构解析
为进一步解析不同阳极设置对CW-MFC耦合系统产电和污染物去除性能的影响,对2套耦合系统电极区域的样品进行了微生物群落结构分析,得到门水平和属水平上阳极和阴极的微生物群落结构组成,分别如图5所示。由图5可知,2套耦合系统阳极样品中出现的优势菌门较为相似,而阴极组成则相差较大。由图5(a)可知,CW-MFC1和CW-MFC2耦合系统中阳极的优势菌门为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)和拟杆菌门(Bacteroidetes),这5个菌门总相对丰度超过80%。变形菌门是CW-MFC耦合系统中最为丰富的菌门,该菌门下的多数细菌营兼性或者专性厌氧及异养生活,主要功能是去除废水中有机物和氮、磷等其他污染物,在人工湿地或其他污水处理工艺中也广泛存在,通常占据较高的丰度。浮霉菌门包含一类专性厌氧的无机自养细菌,即厌氧氨氧化细菌,该细菌可将氨氮和亚硝酸盐氮转化为氮气,对含氮污染物的去除有着重要的作用[16-17]。2套系统的阳极样品中绿弯菌门和拟杆菌门的相对丰度相差不大,拟杆菌门在分解大分子有机物、促进含氮物质利用等方面具有重要意义[18],而绿弯菌门为污水中常见的细菌,其在枯枝落叶分解的碳循环中具有潜在作用。然而,2套CW-MFC耦合系统阴极的微生物群落分布表现出较大的差异。CW-MFC1耦合系统阴极的优势菌门较为集中,主要为变形菌门(相对丰度为79.14%)和拟杆菌门(16.41%);而CW-MFC2阴极的优势菌门分布较为分散,主要为变形菌门(25.59%)、蓝藻叶绿体(Cyanobacteria_chloroplast,47.66%)、拟杆菌门(11.66%)和硝化螺菌门(Nitrospirae,4.96%)。有文献[19]报道蓝细菌(Cyanobacteria)在湿地固氮过程中可发挥关键作用,因此蓝藻叶绿体可能是CW-MFC2耦合系统中的主要脱氮群体。此外,硝化螺菌门中的硝化螺菌属(Nitrospira)可将亚硝酸盐氧化成硝酸盐[20],因此较高丰度的硝化螺菌门可促进CW-MFC2耦合系统阴极的脱氮过程。
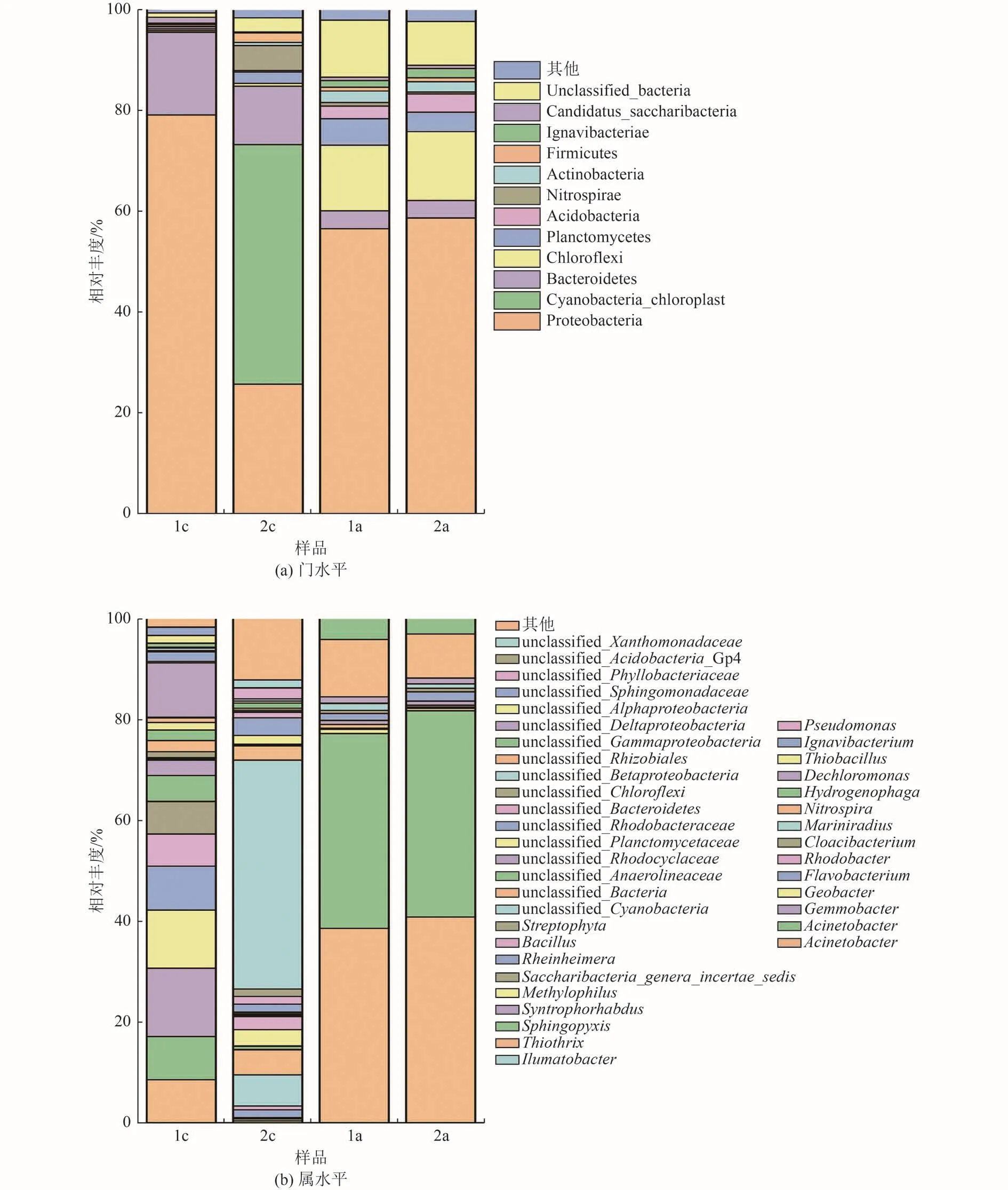
图5 CW-MFC耦合系统电极门和属水平上微生物的相对丰度Fig.5 Relative abundances of microorganisms at the phylum and genus levels in the electrodes of CW-MFC coupling system
从图5(b)可以看出,2套CW-MFC耦合系统阳极的主要菌属相对丰度较为接近,主要优势菌属为不动杆菌属(Acinetobacter)、未分类的绿弯菌门(unclassified_Chloroflexi)、未分类的浮霉菌门(unclassified_Planctomycetaceae)、未分类的厌氧绳菌科(unclassified_Anaerolineaceae)、未分类的拟杆菌门(unclassified_Bacteroidetes)和未分类的β-变形菌纲(unclassified_Betaproteobacteria)等。不动杆菌属在2套CW-MFC耦合系统阳极中的相对丰度最高,该菌属是一种常见的异养反硝化菌属,CW-MFC1耦合系统阳极的不动杆菌属相对丰度(40.84%)高于CW-MFC2(38.59%),表明不动杆菌属相对丰度的增加有利于总氮的去除,是CW-MFC耦合系统阳极中主要的反硝化菌属。如前所述,绿弯菌门、浮霉菌门和拟杆菌门中的一些细菌对湿地中碳、氮循环具有潜在作用[16-17],因此未分类的浮霉菌门和拟杆菌门相对丰度(CW-MFC1为3.78%和2.36%,CW-MFC2为2.90%和2.04%)的增加可能促进了CW-MFC1耦合系统的脱氮过程,而未分类的绿弯菌门相对丰度(CW-MFC1为2.23%,CW-MFC2为3.07%)的增加促进了CW-MFC2耦合系统中有机物的降解,这与本研究得到的污染物去除结果也是一致的。厌氧绳菌科的细菌可能与阳极有机碳的降解有关,并且溶解氧和氨氮浓度是影响其群落的主要因素[21-22]。此外,2套CW-MFC耦合系统中阳极的典型产电菌Geobacter属的相对丰度均较低,分别为0.84%和0.44%。有文献[23]报道未分类的酸杆菌Gp4科(unclassified_Acidobacteria_Gp4)可利用多种有机酸作为底物产电,因此CW-MFC2耦合系统中未分类的酸杆菌Gp4科的相对丰度(1.29%)高于CWMFC1(0.78%)可能与其输出电压较高有关。
从图5(b)还可以看出,2套CW-MFC耦合系统阴极的优势菌属相差较大。CW-MFC1耦合系统阴极主要的优势菌属为巨大芽殖杆菌属(Gemmobacter,13.56%)、地杆菌属(Geobacter,11.51%)、未分类的红环菌科(unclassified_Rhodocyclaceae,10.81%)、黄杆菌属(Flavobacterium,8.70%)、不动杆菌属(Acinetobacter,8.56% ) 和 红 杆 菌 属 (Rhodobacter,6.43%)等;而CW-MFC2耦合系统阴极的主要优势菌属为未分类的蓝藻细菌(unclassified_Cyanobacteria,45.41%) 、Mariniradius(6.16% ) 、 硝 化 螺 菌 属(4.96%)、未分类的红杆菌科(unclassified_Rhodobacteraceae,3.49%)、硫杆菌属(Thiobacillus,3.25%)和假单胞菌属(Pseudomonas,2.58%)等。有文献[24-26]报道芽殖杆菌属、未分类的红环菌科和红杆菌属具有反硝化脱氮的特性,地杆菌属、黄杆菌属和不动杆菌属也常作为CW-MFC系统主要的反硝化菌属[27-28]。此外,脱氯单胞菌属(Dechloromonas)在CW-MFC1耦合系统阴极中也具有较高的相对丰度(3.04%),而该菌属是重要的反硝化聚磷菌,能够在厌氧环境中利用硝酸根和亚硝酸根降解有机物,具有反硝化脱氮功能[29]。因此,大量富集的传统反硝化菌(巨大芽殖杆菌属、地杆菌属、黄杆菌属、不动杆菌属和脱氯单胞菌属等)可能是CW-MFC1耦合系统阴极主要的反硝化菌属。蓝藻细菌常出现在富营养化水体中,能够吸收营养物质,迅速将太阳能转化为碳基化合物,阴极中高丰度的未分类蓝藻细菌可能是由于CW-MFC2耦合系统出水中氮浓度较高所致。硫杆菌属和假单胞菌属的许多细菌被报道具有异养反硝化潜能[30-31],并且假单胞菌属中的某些细菌还具有同时自养和异养的反硝化潜能,可以利用有机碳源和无机电子供体进行协同反硝化脱氮[31]。硝化螺菌属是污水处理中常见的硝化细菌[20],可将亚硝酸盐氧化成硝酸盐,CW-MFC2耦合系统中高丰度的硝化螺菌属可能与蓝藻细菌光合作用释放氧气有关。综上,未分类蓝藻细菌、硫杆菌属、假单胞菌属和硝化螺菌属是CW-MFC2耦合系统中主要的脱氮功能菌群。微生物硝化反硝化作为湿地最主要的脱氮途径,占总氮去除的比例可高达60%~95%[32-33]。在传统的异养反硝化反应中,有机碳化合物可被反硝化菌同时用作生长所需碳源和电子供体,而硝酸盐作为电子受体,可被还原为N2。然而,在CW-MFC耦合系统中,除传统的异养反硝化过程外,还存在利用阴极作为电子供体的电极依赖型自养反硝化过程,这也是CW-MFC耦合系统强化脱氮的关键所在[15,34]。如前所述,地杆菌属是CWMFC1耦合系统阴极中主要的反硝化菌,但地杆菌属同时也是一种典型的产电菌[35],因此,阴极大量富集的地杆菌属可显著促进CW-MFC1耦合系统阴极的自养脱氮过程。
3 结论
(1) 阳极颗粒活性炭的加入可显著提升CWMFC耦合系统的产电性能和产电的稳定性。CWMFC耦合系统的平均输出电压可提升18.7%(从251 mV提高至 298 mV),最大功率密度可提升8.0%(从 7.77 mW/m2提高至 8.39 mW/m2)。
(2) 阳极加入颗粒活性炭对CW-MFC耦合系统氨氮去除效率的提升仅在试验运行初期(0 ~29 d)较为显著(P<0.05);随着试验时间的延长(30 ~105 d),阳极未加入颗粒活性炭的CW-MFC耦合系统的氨氮和总氮去除效果优于阳极加入颗粒活性炭的CW-MFC耦合系统。
(3) 阳极颗粒活性炭的加入对CW-MFC耦合系统阳极的微生物群落组成影响较小,但却造成阴极微生物群落产生较大差异。未加入颗粒活性炭的CW-MFC耦合系统阴极的主要脱氮功能菌群为巨大芽殖杆菌属、地杆菌属、黄杆菌属、不动杆菌属和脱氯单胞菌属等,而加入颗粒活性碳的CW-MFC耦合系统则为未分类蓝细菌、硫杆菌属、假单胞菌属和硝化螺菌属。
