GITR阳性的效应T淋巴细胞参与AAF/PH小鼠肝脏再生调控
2023-02-07李丽何宇刘锴王萍
李丽 何宇 刘锴 王萍
肝脏是体内具有较强再生修复能力的器官,既可通过成熟肝实质细胞直接进入细胞周期完成肝脏的再生修复,也可以通过肝脏干/前体细胞成熟分化为肝实质细胞完成再生修复[1]。在慢性肝脏疾病中,反复的肝细胞损伤修复过程导致肝细胞增殖能力耗竭,起源于终末胆管的肝脏干/前体细胞被活化,并成为主导肝脏再生修复的主要细胞类型[2-4]。因此,探讨肝细胞增殖能力被抑制的情况下肝脏干/前体细胞主导的再生修复过程,有助于进一步揭示慢性肝病情况下肝脏的损伤修复的细胞分子机制。
糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced TNF receptor, GITR)主要表达于活化的效应T淋巴细胞、调节性T细胞、自然杀伤细胞等,GITR是效应T淋巴细胞活化的一个标志物,GITR与其配体(GITR ligand, GITRL)结合可作为协同刺激信号促进效应T淋巴细胞增殖和细胞因子分泌[5-7]。在CB17/Icr+/+ Jcl小鼠大脑中动脉闭塞卒中模型中,GITR活化后通过提高促炎性细胞因子的水平,加重脑卒中后缺血性损伤程度,抑制GITR的表达可以提高脑卒中后神经前体细胞的存活[8]。此外,GITR在C57BL/6小鼠单纯疱疹病毒1型感染以及Sv129小鼠卡拉胶致急性肺炎模型中的表达也上调[9,10]。而关于GITR/GITRL在肝脏中的研究主要集中在肝移植术后、基因治疗后的患者免疫耐受与肝脏肿瘤的免疫治疗方面[11-13],在肝脏再生修复过程中表达GITR的效应T淋巴细胞的变化情况尚不清楚。本研究采用经典的肝脏前体细胞活化模型——2-乙酰氨基芴联合部分肝切除(2-acetylaminofluorene and partial hepatectomy, AAF/PH)模型,利用AAF有效阻断肝细胞增殖进而活化肝脏前体细胞,观察前体细胞主导的肝脏再生修复过程中效应T淋巴细胞比例的变化情况和GITR阳性效应T淋巴细胞比例的变化情况。
材料和方法
一、主要材料
6~8周龄雄性无特殊病原体(SPF)级的C57BL/6J小鼠20只,体质量(22.0±2.0)g,购自北京华阜康实验动物有限公司,AAF购自美国Sigma公司。免疫荧光所用抗原封闭液购自美国Agilient Technologies公司,免疫荧光和免疫印迹用Sox9抗体购自美国Cell Signaling Technology公司,Alexa Fluor 555标记驴抗兔IgG抗体购自美国Invitrogen公司,化学发光液购自德国Millipore公司。组织细胞分离所用的胶原酶D、DNaseI购自瑞士罗氏公司,Percoll、4%多聚甲醛购自北京索莱宝科技有限公司,红细胞裂解液、TruStain fcXTM、BV421标记CD45抗体、PE-CY7标记CD3抗体、PerCP5.5标记CD4抗体、APC-Cy7标记CD8抗体、APC标记GITR抗体购自美国BioLegend公司。
二、小鼠AAF/PH动物模型制备
将AAF溶解于含10%乙醇的玉米油中,浓度为3 mg/mL,实验组小鼠连续5 d按30 mg/kg的剂量灌胃,对照组小鼠用相同体积玉米油灌胃。第6天实施肝部分切除术,1%的戊巴比妥钠按50 mg/kg的剂量对小鼠进行腹腔注射麻醉,麻醉后取腹部正中切口,在距离肝门2~3 mm处结扎并切除肝左外侧叶,保留中间叶、尾状叶和右侧叶,做1/3部分肝切除。术后继续用30 mg/kg的AAF灌胃,分别于术后7 d、14 d处死小鼠,收取肝组织。
HE染色:将肝组织石蜡切片依次放入二甲苯和梯度酒精中脱蜡至水后,依次用苏木素、伊红进行细胞核和细胞质染色,将切片依次放入梯度酒精和二甲苯中脱水透明,中性树胶封片,荧光显微镜观察拍照。
天狼星红染色:将肝组织石蜡切片依次放入二甲苯和梯度酒精中脱蜡至水后,放入天狼猩红染液中染色8 min。将切片依次放入梯度酒精和二甲苯中脱水透明,中性树胶封片,荧光显微镜观察拍照。
免疫荧光染色:石蜡包埋切片于70℃烤箱中1 h后,依次置于二甲苯、无水乙醇、90%乙醇、80%乙醇、70%乙醇、PBS中脱蜡水化。加入柠檬酸抗原修复液(pH=6.0)于高压锅中进行抗原热修复。待冷却后用PBS洗去抗原修复液,滴加抗原封闭液室温封闭20 min,滴加Sox9抗体(用抗体稀释液按1∶200倍配制)后于4℃孵育过夜。0.1%PBST洗次切片3后,加入Alexa Fluor 555标记驴抗兔IgG抗体(用抗体稀释液按1∶600倍配制)室温孵育20 min,0.1%PBST洗去抗体后滴加含DAPI的封片剂封片,荧光显微镜观察拍照。
三、蛋白印迹检测Sox9蛋白的表达
Sox9蛋白是肝脏前体细胞特异性标志物[14]。取小鼠肝组织称重后剪碎,按10 mg/mL加入适量蛋白裂解液,匀浆器匀浆以提取蛋白,BCA法测定蛋白浓度,按每孔7 μg蛋白进行聚丙烯酰胺凝胶电泳,之后用390 mA恒流电转将蛋白转印到硝酸纤维素膜上。硝酸纤维素膜经含5%脱脂奶粉的TBST封闭2 h,兔抗Sox9抗体(1∶2000倍稀释)或小鼠抗GAPDH抗体(1∶2000倍稀释)4℃摇床孵育过夜。TBST洗膜3次后,对应辣根过氧化物酶标记二抗(1∶3000倍稀释)室温孵育1 h后,TBST洗膜3次,加入显色液显影,应用伯乐分子成像仪ChemiDoc XRS+(美国)的Image Lab软件(版本3.0)拍照。
四、流式细胞术检测肝脏组织浸润炎症细胞
GITR是效应T淋巴细胞活化的标志[15]。小鼠处死后,0.9%氯化钠原位灌注至肝脏呈暗黄色以去除血液细胞,将肝组织剪成小块重悬于含0.01%胶原酶D和0.001% DNase I的消化液中,匀浆器匀浆后于37℃水浴中消化35 min,80 目滤网过滤后加入含2%胎牛血清的PBS终止酶的消化作用。50×g离心5 min去除肝细胞沉淀后,上清液经2000 r/min离心5 min,将细胞沉淀重悬于30% Percoll密度梯度离心液中,2000 r/min离心5 min获得非实质细胞。加入红细胞裂解液冰浴裂解红细胞,再加入PBS终止反应,2000 r/min离心5 min后弃上清,将细胞沉淀打散加入小鼠TruStain fcXTM防止非特异性染色后,再加入BV421标记CD45抗体、PE-CY7标记CD3抗体、PerCP5.5标记CD4抗体、APC-Cy7标记CD8抗体、APC标记GITR抗体于4℃中染色30 min,使用MACS Buffer洗细胞一次后加入1%多聚甲醛固定细胞,应用BD FACS AriaII流式细胞仪(美国)检测,FlowJo流式分析软件分析。
五、统计学方法
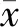
结 果
一、AAF/PH损伤后肝组织的病理变化
C57BL/6J小鼠在AAF/PH造模后,随着术后恢复时间增加,肝中间叶体积显著增大,肝右叶以及尾状叶体积轻度增大。对照组小鼠(n=3)肝脏重量为(0.95±0.08)g,实验组小鼠术后7 d(n=4)肝脏重量为(0.90±0.08)g,术后14 d(n=5)肝脏重量为(0.96±0.05)g,与对照组小鼠相比差异均无统计学意义(均P>0.05)。与此同时,对照组小鼠肝脏与体重比为(4.20±0.40)%,术后7 d、14 d分别为(4.29±0.46)%、(4.37±0.17)%,与对照组小鼠相比差异均无统计学意义(均P>0.05)。HE染色结果显示,AAF/PH术后7 d肝组织内未见明显的炎症细胞浸润,术后14 d,汇管区出现明显的炎症细胞浸润。天狼星红染色结果显示术后7 d肝组织中无明显细胞外基质沉积,而术后14 d汇管区周围出现明显的细胞外基质沉积。见图1。

图1 小鼠AAF/PH模型肝组织的病理变化 A:对照组小鼠(HE);B:实验组小鼠术后7 d(HE);C:实验组小鼠术后14 d;D:对照组小鼠(PSR);E:实验组小鼠(PSR);F:实验组小鼠(PSR)
二、AAF/PH模型活化肝脏前体细胞
肝组织免疫荧光染色显示与对照组小鼠(n=3)相比,PH术后7 d(n=4)、14 d(n=5)时,Sox9+细胞数量呈明显的时间依赖性增加(图2A)。蛋白质印迹结果也显示PH术后7 d、14 d时,Sox9表达亦显著增加(图2B),表明AAF/PH模型活化了肝脏前体细胞。
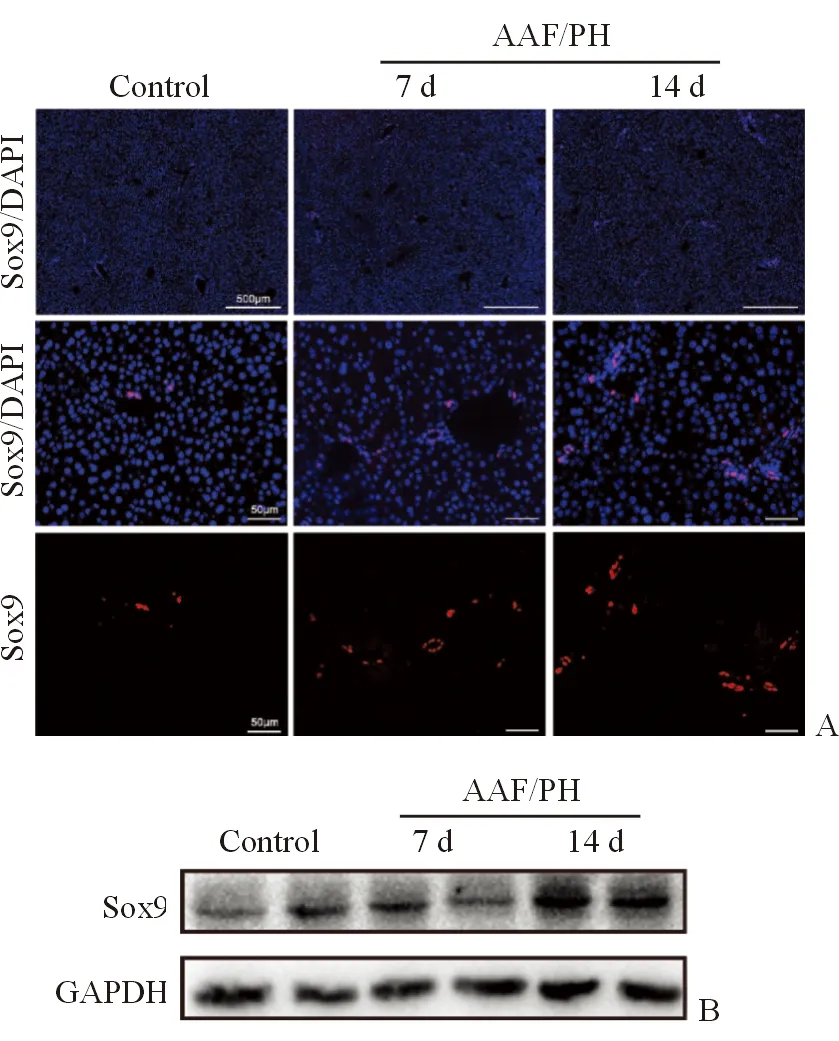
图2 小鼠AAF/PH模型活化肝脏前体细胞 A. 肝组织免疫荧光染色示Sox9+细胞数量呈时间依赖性增加;B. 蛋白印迹示Sox9表达量在术后14 d明显增加
三、AAF/PH肝再生模型中CD8+ T淋巴细胞比例显著增加
利用胶原酶消化和Percoll密度梯度离心的方法获得肝脏非实质细胞,经多色免疫荧光染色与流式分析结果显示,与对照组小鼠(n=3)相比,PH术后7 d(n=4)时,CD4+T淋巴细胞(CD45+CD3+CD4+)和CD8+T淋巴细胞(CD45+CD3+CD8+)占CD3+T淋巴细胞(CD45+CD3+)的比例均没有明显变化,CD8+T淋巴细胞与CD4+T淋巴细胞的相对比例也没有明显变化(P=0.3541);术后14 d(n=5)时,CD8+T淋巴细胞占CD3+T淋巴细胞的比例明显增加(P=0.0289),而CD4+T淋巴细胞占CD3+T淋巴细胞的比例仍无明显变化(P=0.1250),CD8+T淋巴细胞与CD4+T淋巴细胞的相对比例亦没有明显变化(P=0.0874),见表1,表明CD8+T淋巴细胞是参与AAF/PH模型肝脏再生修复过程的重要淋巴细胞亚群。
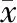
表1 小鼠AAF/PH模型中CD8+、CD4+T淋巴细胞比例变化情况(±s)
四、GITR在AAF/PH肝再生中表达上调
流式分析结果显示,与对照组小鼠(n=3)相比,CD8+T淋巴细胞中GITR的阳性率在PH术后7 d(n=4)时显著增加(P=0.0098),在术后14 d(n=5)时显著下降(P= 0.0427)(图4);而CD4+T淋巴细胞中GITR阳性率在PH术后7 d时没有明显变化(P=0.1037),术后14 d时GITR阳性率显著下降(P=0.0225),见表2。
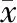
表2 小鼠AAF/PH模型中CD8+、CD4+T淋巴细胞GITR阳性率变化情况(±s)
讨 论
肝脏再生修复过程是由免疫系统主导的,由多种细胞因子和生长因子调控的复杂过程。本研究利用抑制肝细胞增殖以活化前体细胞的AAF/PH小鼠肝脏再生模型研究发现CD8+T淋巴细胞是参与活化前体细胞的肝脏再生修复的重要淋巴细胞亚群,且其活化标志物GITR的表达随时间呈先升高再降低的变化趋势。尽管前体细胞主导的肝脏再生修复过程中CD4+T淋巴细胞占T淋巴细胞的比例没有显著变化,但是在汇管区纤维化出现时GITR阳性、活化CD4+T淋巴细胞比例显著下降。
肝脏前体细胞的活化过程伴随着肝脏的炎症细胞浸润,肝脏中T淋巴细胞显著增加。缺少T淋巴细胞的Rag(-/-)小鼠经部分肝切除后肝脏损伤加重且DNA合成能力下降[16]。用CDE饮食喂饲缺少T淋巴细胞的CD3epsilon(-/-) and Rag2(-/-)小鼠,与正常对照小鼠相比,前体细胞的活化被显著抑制[17],表明T淋巴细胞参与了肝脏再生修复过程,并具有刺激肝脏前体细胞增殖的作用。本研究发现,在小鼠AAF/PH模型中CD8+T淋巴细胞占T淋巴细胞的比例增加最为显著,提示CD8+T淋巴细胞可能是参与肝脏再生调控的重要淋巴细胞亚群。
效应T淋巴细胞的活化过程是其增殖和发挥功能的关键,而GITR是重要的效应T淋巴细胞活化的标志物[5, 15, 18]。本研究在观察到AAF/PH小鼠模型中CD8+T淋巴细胞比例变化的基础上,检测了GITR阳性的CD8+T淋巴细胞的比例变化情况,以反映组织浸润的活化CD8+T淋巴细胞的变化情况。发现在前体细胞主导的肝脏再生的早期阶段活化的CD8+T淋巴细胞比例显著增加,而在汇管区形成纤维化的阶段,活化的CD4+T淋巴细胞和CD8+T淋巴细胞比例均显著下降,其具体的机制和与前体细胞的关系仍有待进一步研究。
综上,AAF/PH小鼠肝再生模型中,伴随着肝脏前体细胞的活化,CD4和CD8效应T淋巴细胞均参与了小鼠的肝脏再生过程,为后续进一步从T淋巴细胞的角度探索肝脏前体细胞调控的肝脏再生修复提供了研究思路与线索。
利益冲突声明:所有作者均声明不存在利益冲突。
