一贯煎通过调节Parp-1的翻译后修饰保护肝细胞DNA
2023-02-06张宇佳叶杰卢艳琳闫晓风王晓玲
张宇佳,叶杰,卢艳琳,3,闫晓风,李 华,王晓玲
(1.上海中医药大学基础医学院生物教研室,上海 201203;2.苏州卫生职业技术学院临床医学院,江苏 苏州 215009;3.上海中医药大学附属龙华医院肿瘤科,上海 200032)
“感受-修复-恢复”模型是机体对内、外源性DNA损伤后做出的一系列反应。DNA损伤修复是保障基因组稳定的关键[1]。当DNA损伤时,聚腺苷二磷酸核糖聚合酶-1(poly ADP-ribose polymerase 1,Parp-1)作为最明显的DNA损伤“感受器”被募集到损伤处,无论是对单链还是双链DNA断裂损伤都有快速应答能力,在DNA损伤后几秒到几分钟之内就被募集到损伤区[2]。Parp-1被损伤的DNA激活后,首先将腺苷二磷酸核糖单体转移到底物蛋白包括自身上,催化合成多聚腺苷二磷酸核糖(poly ADP-ribose,Par)聚合物,此聚合物大分子作为平台募集其它DNA损伤修复相关酶,共同参与DNA损伤修复。Parp-1过度活化可导致DNA碎片化,进而引起细胞死亡,被认为是一个关键的细胞死亡介导者[3],但过度抑制Parp-1活性也将导致细胞凋亡,如肿瘤治疗中采用Parp-1抑制剂引发癌细胞凋亡[4]。因此,在DNA损伤修复过程中,Parp-1的活性调节对细胞存活或死亡至关重要。
肝细胞是肝脏组织中含量最为丰富的实质细胞,约占肝质量的80%以及肝脏细胞总量的80%左右。药物、酒精、病毒感染以及自身免疫等因素均可能导致肝细胞损伤,甚至死亡。肝细胞死亡造成数量减少既是各种因素所致肝病的病理表现,也是影响疾病预后的重要因素。氧化应激是致肝细胞损伤、死亡的重要因素之一[5],可通过损伤细胞膜、溶酶体、DNA等引发细胞损伤和死亡[6-7]。
一贯煎(Yiguanjian decoction,YGJ)是中医滋阴柔肝的名方,出自清代医家魏之琇的《续名医类案》。方中重用生地黄滋阴养血、补益肝肾为君,内寓滋水涵木之意。当归、枸杞养血滋阴柔肝;北沙参、麦冬滋养肺胃,养阴生津,意在佐金平木,扶土制木,四药共为臣药;佐以少量川楝子疏肝理气。既往研究发现,YGJ治疗慢性肝病的主要作用靶标在肝细胞,其修复了损伤的肝细胞,所以没有造成肝细胞数量减少[8]。在此基础上,本文研究过氧化氢(H2O2)诱导肝细胞DNA损伤修复时,YGJ通过调节Parp-1活性保护肝细胞的作用机制。
1 材料与方法
1.1 材料
1.1.1一贯煎制备 YGJ(北沙参9 g、麦冬9 g、当归身9 g、生地黄30 g、枸杞子12 g、川楝子5 g)由上海中医药大学附属曙光医院国家中医药管理局中药制剂中心一次制备成浓缩液,水浴干燥成流浸膏后由上海中医药大学中药学院真空干燥成干粉,冷藏保存,每克药粉含生药2.196 g。称取0.5 g冻干粉+5 mL DMEM配制成母液,0.45 μm滤膜过滤,分装,-80 ℃保存。临用时,先以无血清DMEM培养液配制成100 g·L-1生药浓度,再以无血清培养液配制成使用浓度。
1.1.2细胞 小鼠胚胎来源肝细胞系BNL CL2(ATCC®TIB-73TM)购自中国科学研究院上海细胞库。
1.1.3 试剂胎牛血清(Gibco),DMEM高糖培养液(Hyclone),过氧化氢(H2O2)和HRP-羊抗兔二抗购自凯基生物;一抗:γ-H2AX(ab11174)、Parp1(#227244)、Sirt-1(ab189494)、兔多克隆抗体GAPDH(ab00073877)购自abcam公司,Par(CST,83732s),EdU细胞增殖检测试剂盒(碧云天)。Cy3-标记羊抗兔荧光二抗(威奥,WH1123),兔抗小鼠一抗Acetylated-Lysine(1 ∶1 000,CST,#9441S),二抗为羊抗兔HRP-linked二抗(1 ∶5 000,CST,#7074)。
1.2 方法
1.2.1EDU掺入检测细胞增殖及γ-H2AX检测细胞DNA损伤 1×104个细胞种于激光共聚焦皿,培养24 h,加入H2O2或YGJ刺激。干预后,每孔加入2 μL EDU原液,继续培养2 h,以4%多聚甲醛(4 ℃预冷)室温固定细胞。洗涤后,0.3% Triton-X-100 PBS冰浴透膜15 min。加入200 μL Click反应液,室温避光30 min。γ-H2AX检测时,收集细胞洗涤后,加入含10%羊血清的PBS封闭液30 min,γ-H2AX一抗(1 ∶500)4 ℃孵育过夜。洗涤后,Cy3-标记羊抗兔荧光二抗(1 ∶200),37 ℃,避光孵育2 h。Hoechst33342(1 ∶1 000),室温避光孵育6 min标记细胞核。加入抗荧光淬灭剂,ZEISS激光共聚焦成像系统成像,随机视野成像5张,以IPP软件,红色相对荧光强度(relative fluorescence intensity,RFI)记作γ-H2AX表达量,同时检测Hochest记作总细胞数,检测绿色荧光值记作EDU阳性细胞,EDU阳性细胞率/%=阳性细胞数/总细胞数×100%。
1.2.2Annexin V/PI流式细胞术检测细胞凋亡 细胞按5×105个/皿接种至60 mm培养皿中,50 mg·L-1YGJ预处理细胞,然后按不同时间点加入终浓度500 μmol·L-1H2O2收集细胞。PBS洗涤细胞,0.25%胰蛋白酶(不含EDTA)消化细胞,离心后,将细胞重悬在1×Annexin V binding buffer中(确保细胞浓度1×106L-1),加入5 μL Annexin V和5 μL PI,室温避光孵育15 min,置冰上,轻轻混匀,1 h内上机检测。
1.2.38-OhdG比色法检测细胞DNA氧化损伤 细胞按5×103个/孔接种于96孔细胞培养板中。依据试剂盒说明操作,酶标仪波长650 nm测读。
1.2.4Western blot检测细胞蛋白质 细胞接种于10 cm培养皿中,培养48 h后,加入500 μmol·L-1H2O2处理细胞,H2O2/YGJ用药组分别按50 mg·L-1YGJ作用不同时间,弃上清,收集细胞,测定蛋白质浓度,与SDS上样缓冲液混合,95 ℃变性5 min;制胶,上样,电泳,切胶,恒压70 V转膜1.5 h,将蛋白质转移至PVDF膜上。5%BSA/TBST封闭液室温封闭1.5 h。一抗:Parp1(1 ∶1 000)、Par(1 ∶1 000)、GAPDH(1 ∶5 000),4 ℃孵育过夜,分别加入相应的HRP标记二抗(1 ∶2 000-1 ∶20 000),室温孵育1 h,ECL反应后用全自动凝胶成像系统成像。
1.2.5免疫沉淀(immunoprecipitation,IP) 细胞接种于10 cm培养皿中,经药物处理后,RIPA裂解细胞,测定蛋白质浓度,加入兔抗小鼠Parp1一抗(1 ∶200),另取正常对照组样本一份,加入兔源IgG(1 μg,碧云天,A7016)作为IgG对照组,3D摇床100 r·min-1混匀过夜。
将beads液加入样本混合,4 ℃,水平摇床混匀,洗涤、煮沸、离心,取上清做Western blot,一抗为兔抗小鼠Acetylated-Lysine一抗(1 ∶1 000),二抗为羊抗兔HRP-linked二抗(1 ∶5 000)。
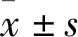
2 结果
2.1 一贯煎对H2O2诱导肝细胞凋亡的影响加入H2O2作用不同时间,选取3、6、12和24 h时间点观察,晚期凋亡的肝细胞均较正常对照组(19.6%)增加明显,分别上升到44.5%、56.0%、32.2%和27.8%,YGJ作用后相应地分别下降到38.5%、50.5%、29.3%和22.9%,这些结果显示H2O2在作用3~6 h细胞凋亡达到高峰,随后凋亡细胞减少但仍高于正常对照组;YGJ可减少细胞凋亡,保护作用从3 h一直持续到24 h(Fig 1)。
2.2 一贯煎对H2O2损伤肝细胞增殖的影响EDU绿色荧光细胞阳染代表细胞增殖。0 h对照组细胞绿色荧光细胞阳染率为19.01%±3.19%,加入500 μmol·L-1H2O2作用6 h、12 h和24 h后分别为10.92%±0.48%(P<0.01)、13.39%±1.46%(P<0.05)和17.60%±1.65%;而加入50 mg·L-1YGJ作用6 h、12 h和24 h,细胞阳染率分别恢复为16.22%±0.65%(P<0.05)、18.25%±0.23%(P<0.05)和18.35%±1.85%,与相应时间点H2O2组比较,6和12 h组差异明显。这些结果提示,H2O2可明显抑制肝细胞增殖,至6 h增殖能力达到最低,随后逐渐恢复,24 h几乎恢复至正常水平;YGJ在整个实验观察时间点都可以明显促进细胞增殖(Fig 2)。
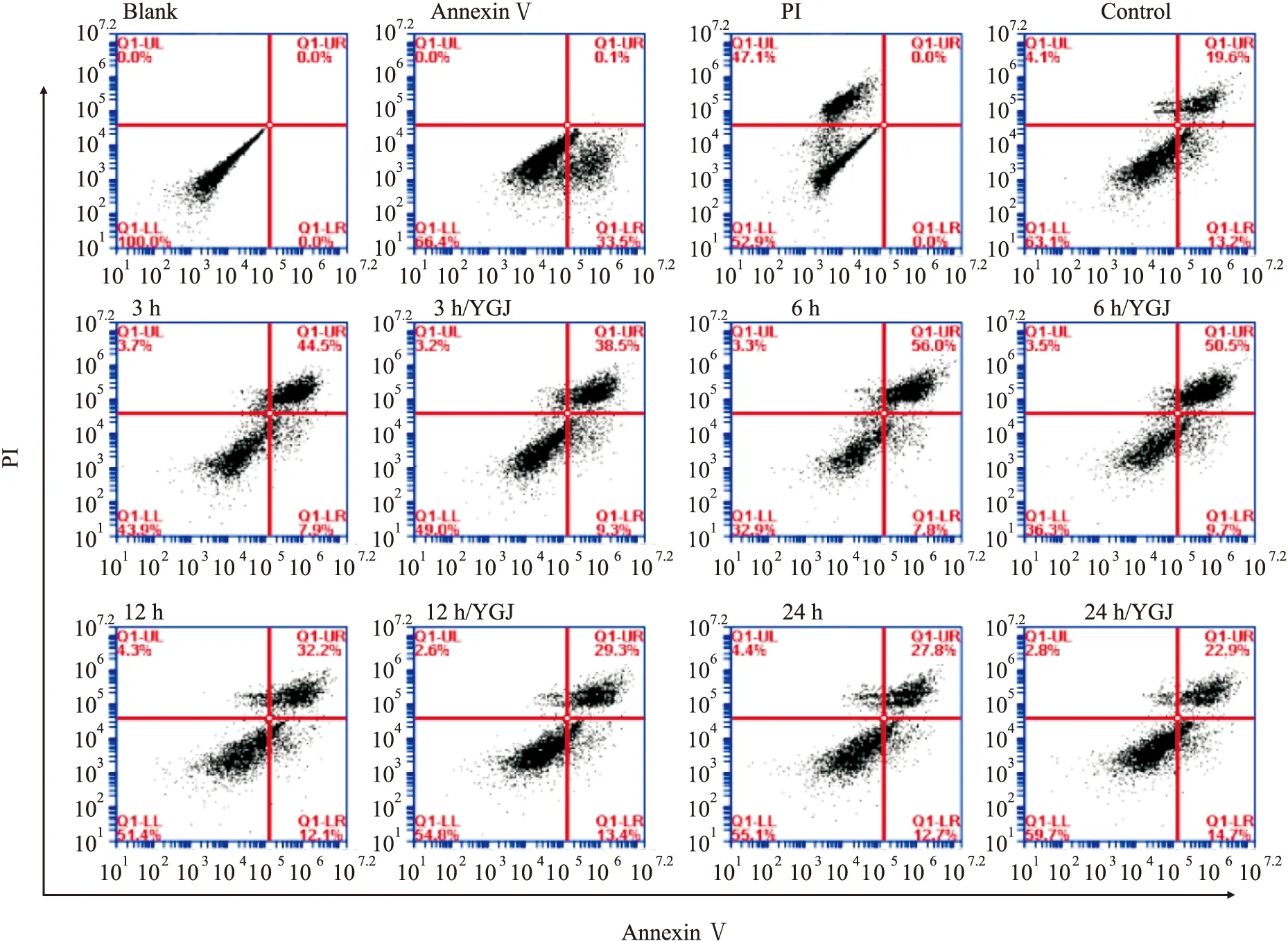
Fig 1 Time effects of Yiguanjian decoction on apoptosis of H2O2-induced hepatocytes
2.3 一贯煎对H2O2诱导肝细胞DNA氧化损伤的影响比色法检测肝细胞8-羟基脱氧鸟苷(8-OhdG)含量,结果显示0 h对照组8-OhdG的吸光度值为0.08±0.02,加入H2O2作用不同时间,选取3 h、6 h、12 h和24 h时间点观察,吸光度值分别上升至0.24±0.01(P<0.01)、0.26±0.00(P<0.01)、0.27±0.02(P<0.01)和0.29±0.02(P<0.01),显示H2O2可导致DNA氧化损伤,且持续存在于整个实验过程。加入50 mg·L-1YGJ作用6、12和24 h后,细胞吸光度值分别下降至0.24±0.00(P<0.05vs6 h H2O2)、0.24±0.00和0.26±0.01。结果可见,YGJ在6 h即可明显降低8-OhdG含量,12 h和24 h有下降趋势(Fig 3)。
Fig 2 Time effects of Yiguanjian decoction on proliferation of *P<0.05,**P<0.01 vs 0 h H2O2 group;#P<0.05 vs H2O2 group.Scale bar=10 μm.

Fig 3 Time effects of Yiguanjian decoction on inhibiting H2O2**P<0.01 vs 0 h H2O2 group,#P<0.05 vs H2O2 group.
2.4 一贯煎对H2O2诱导的肝细胞内γ-H2AX的影响红色相对荧光强度(Relative fluorescence intensity,RFI)记作γ-H2AX表达量。0 h对照组细胞γ-H2AX含量为1.88±3.25,500 μmol·L-1H2O2作用6、12和24 h后,γ-H2AX含量分别为27.31±1.51(P<0.01)、15.77±2.56(P<0.01)和5.32±0.31,结果显示,H2O2在整个观察时间点均可明显提高细胞内γ-H2AX含量;加入50 mg·L-1YGJ后6 h、12 h和24 h,γ-H2AX含量分别为5.41±0.81(P<0.01)、6.51±1.26(P<0.01)和2.65±1.53,与相应时间点单独H2O2作用比较,在6和12 h差异有统计学意义,24 h有下降趋势,表明YGJ在各对应的时间点均可明显减少H2O2诱导的肝细胞γ-H2AX含量(Fig 4)。
2.5 一贯煎对H2O2诱导肝细胞内Parp-1含量和Par化修饰的影响500 μmol·L-1H2O2作用3、6、12和24 h后,Parp-1含量分别为0.76±0.09、1.31±0.00(P<0.01)、1.21±0.20(P<0.05)和1.25±0.04(P<0.01),与0 h对照组(0.79±0.10)比较,从6 h起各时间点均具有统计学意义;加入50 mg·L-1YGJ作用3 h、6 h、12 h和24 h,Parp-1含量分别为1.27±0.13(P<0.01)、1.21±0.20、1.03±0.12和1.04±0.09(P<0.05),在3 h明显升高,而24 h明显降低。以上结果显示,H2O2作用6 h后细胞内Parp-1含量明显增加且持续至24 h,而YGJ作用3 h后细胞内Parp-1含量增加,12 h后逐渐降低,提示YGJ可使细胞内Parp-1的表达提前(Fig 5A,B)。

Fig 4 Time effects of Yiguanjian decoction on γ-H2AX **P<0.01 vs 0 h H2O2 group,##P<0.01 vs H2O2 group.Scale bar=10 μm.
H2O2作用3、6、12和24 h后,Parp-1的Par化修饰分别为0.50±0.02、0.95±0.04(P<0.01)、0.7±0.05(P<0.01)和0.74±0.03(P<0.01),与0 h对照组(0.52±0.02)比较,除3 h外,其余组均具有统计学意义;加入YGJ作用3、6、12和24 h后,Parp-1的Par化修饰分别为0.94±0.07(P<0.01)、1.05±0.02(P<0.05)、0.96±0.03(P<0.01)和0.84±0.05(P<0.05)。这些结果表明,H2O2作用6 h后Parp-1的Par化升高达到峰值,之后稍有下降,但与0 h对照组比较仍具有统计学意义;YGJ在3 h即可明显增加Parp-1的Par化,同样至6 h达到峰值,并均高于各观察时间点单独H2O2作用组,提示YGJ可明显促进细胞内Parp-1的Par化修饰(Fig 5C,D)。
2.6 肝细胞内Sirt-1对Par化的影响采用不同浓度Sirt-1激动剂SRT1720作用细胞观察Parp-1的Par化修饰,结果可知,与对照组(1.09±0.03)相比,0.01 μmol·L-1SRT1720、0.1 μmol·L-1SRT1720和1 μmol·L-1SRT1720分别为0.86±0.05(P<0.05)、0.43±0.01(P<0.01)和0.41±0.01(P<0.01),表明SRT1720可明显降低Parp-1的Par化修饰(Fig 6A-B)。Sirt-1抑制剂EX527作用细胞观察Parp-1的Par化修饰,结果显示:与对照组(0.31±0.04)相比,0.5、1、2 μmol·L-1EX527分别为0.55±0.07、0.54±0.04(P<0.05)和0.60±0.06(P<0.05),表明EX527可明显提高Parp-1的Par化修饰(Fig 6C-D)。这些结果表明,Sirt-1在Parp-1活性调节中发挥负性调控作用。
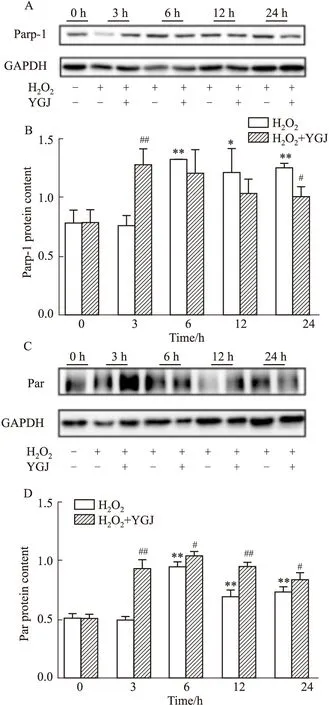
Fig 5 Effects of Yiguanjian decoction on Parp-1 and its PARylation in hepatocytes induced by n=3)*P<0.05,**P<0.01 vs 0 h H2O2 group,#P<0.05,##P<0.01 vs H2O2 group.
2.7 一贯煎对H2O2损伤肝细胞内Parp-1乙酰化的影响H2O2作用3、6、12和24 h后,乙酰化修饰的Parp-1分别为0.48±0.02、2.09±0.08(P<0.01)、1.67±0.11(P<0.01)和0.63±0.02(P<0.05),与0 h对照组(0.49±0.01)相比,从6 h开始Parp-1乙酰化修饰增加,且差异均具有统计学意义;加入50 mg·L-1浓度YGJ作用3、6、12和24 h后,乙酰化修饰的Parp-1分别为1.49±0.01(P<0.01)、0.78±0.02(P<0.01)、0.71±0.02(P<0.01)和0.43±0.04(P<0.05)。这些结果表明,H2O2作用后肝细胞内Parp-1的乙酰化修饰在6 h达峰值,随后逐渐减低但仍高于0 h对照组;而YGJ作用后使其峰值提前至3 h且迅速下降,至6 h之后均低于相应时间点对照组。

Fig 6 Effects of agonist and inhibitor of Sirt-1 on Parp-1 protein n=3)*P<0.05,**P<0.01 vs control.
3 讨论
活性氧可诱发DNA中鸟嘌呤第8位碳原子上的氢原子羟基化(8-OhdG),是导致细胞内DNA损伤重要的因素之一[9]。本文中,肝细胞内8-OhdG含量随H2O2作用时间延长而逐步升高;γ-H2AX是DNA双链断裂较为敏感的生物标志物[10],随H2O2作用时间延长其含量也相应升高,表明H2O2可导致肝细胞DNA氧化和双链断裂等损伤、抑制细胞增殖,最终引发肝细胞凋亡;而YGJ可明显拮抗H2O2诱导DNA损伤。

Fig 7 Effects of Yiguanjian decoction on Parp-1 acetylation induced by H2O2 in n=3)*P<0.05,**P<0.01 vs 0 h H2O2 group,#P<0.05,##P<0.01 vs H2O2 group.
细胞应对DNA损伤有一定的修复机制,Parp-1作为DNA损伤感受器,可快速应答DNA损伤,启动修复过程。Parp-1自身的Par化修饰对DNA损伤修复至关重要。本研究表明,H2O2作用6 h即可明显增加Parp-1含量以及Parp-1的Par化,表明H2O2诱导DNA损伤后肝细胞可迅速启动修复机制;H2O2作用自6~24 h,Parp-1表达均处于高位,但Par化自6 h达到峰值后即降低,两者不完全一致;YGJ干预结果显示自3 h起即可明显促进Parp-1表达,早于H2O2单独作用,且Par化结果更显示YGJ可迅速激活Parp-1活性,促进DNA修复且维持时间更持久。
去乙酰化酶Sirtuin 1(silent information regulator 1,Sirt-1)是NAD+依赖型的去乙酰化酶,能够催化多种蛋白质的乙酰赖氨酸进行去乙酰化反应,在染色质重塑、基因调控、代谢、癌症等相关疾病及延缓衰老等方面发挥重要作用[11]。Parp-1与Sirt-1都是参与DNA损伤修复的重要蛋白质,在细胞内彼此之间既相互协作又相互制约而维持DNA损伤后的平衡修复,避免Parp-1过度激活或过度抑制,造成细胞死亡[12]。Parp-1和Sirt-1发挥酶活性都需要以NAD+作为辅酶,Parp-1对NAD+的亲和性较Sirt-1高5~10倍,持续消耗NAD+,会导致Sirt-1活性降低,反过来Sirt-1可以直接抑制Parp-1基因的启动子,从而抑制Parp-1表达和活性[13-14];另一方面,Parp-1催化产生多聚ADP核糖链可招募Sirt-1到达损伤位点,使染色质重塑因子去乙酰化而增强ATPase活性,促进损伤位点附近核小体松散,推动DNA修复[15],Parp-1的乙酰化可竞争性抑制Parp-1泛素化,从而阻遏Parp-1降解,维持Parp-1稳定[16]。本研究中YGJ作用后Parp-1的乙酰化在6 h后降低,而其Par化反而升高,这解释了Parp-1含量随作用时间降低而活性却不降低这一现象。Sirt-1抑制剂EX527可明显提高Parp-1的Par化,而其激动剂可明显抑制Parp-1的Par化,表明Sirt-1对Parp-1的活性呈负调控机制。
总之,H2O2诱导肝细胞DNA损伤可抑制DNA复制导致细胞增殖减少,细胞死亡增加,而YGJ可通过调节Parp-1修复损伤的DNA,维持肝细胞基因组的完整性从而促进肝细胞增殖及抵抗H2O2诱导肝细胞凋亡。
