紫檀芪减轻小鼠肝窦内皮细胞氧化损伤的机制
2023-02-06蔡海建陈立建唐震海
姚 雷,蔡海建,刘 邓,陈立建,唐震海,都 建
(安徽医科大学 1.基础医学院、2.科研实验中心、3.第一附属医院麻醉科,安徽 合肥 230032)
肝脏缺血/再灌注损伤(ischemia reperfusion injury,IRI)长期以来被认为是引起缺血性休克、肝切除和肝移植不良结果的主导因素[1]。缺血/再灌注损伤引起炎症因子积聚,加剧器官急性排斥反应发生,同时引起胆道并发症,致使移植物失功。在IRI的防治中,之前的研究重点是保护肝脏实质细胞,然而,最近的研究结果发现,肝窦内皮细胞(liver sinusoidal endothelial cells,LSECs)在早期再灌注过程中会出现功能和表型失调,并对邻近细胞和肝脏疾病病理生理学产生负面影响[2]。LSECs是肝脏内最丰富的非实质细胞,维持肝内微循环稳态发挥重要作用。LSECs形成肝窦壁,与其他毛细血管不同,它们缺乏有组织的基底膜,细胞质被开放的小孔穿透,使肝脏微血管内皮细胞不连续[3],这种连接方式使得肝实质细胞与肝窦间物质交换更加便捷[4];窗孔是一种动态结构,肝脏的病理生理改变都会影响窗孔的大小改变,调控肝脏微循环[5]。血红素加氧酶是催化血红素降解的限速步骤,产生胆红素、一氧化碳(CO)和铁离子[6],分解产物具有抗炎、抗氧化、调节细胞周期、改善微循环等作用[7-8],尤其在临床肝移植手术过程中,肝微循环在再灌注后的恢复极为重要。紫檀芪(pterostilbene,PTE)是从紫檀、蓝莓等植物提取的天然酚类化合物。近年来发现,PTE具有良好的抗氧化、抗炎、抗肿瘤等活性而被普遍关注[9-10]。由于其3、5位甲基化特殊结构,使其具备比其他酚类化合物,如白藜芦醇、白皮杉醇更高的生物利用度以及更强的稳定特性。有相关研究表明,PTE对肝脏缺血/再灌注损伤有保护作用[12],然而对于LSECs保护及具体途径尚不清楚。本实验通过原代提取LSECs为细胞模型建立体外氧糖剥夺模型(oxygen-glucose-serum deprivation/reoxygenation,OGD/R),研究PTE通过保护LSECs使肝脏免受缺血/再灌注损伤的作用机制。
1 材料与方法
1.1 材料C57BL/6J小鼠(雄性,6-8周龄)购于河南斯克贝斯生物科技技术公司,动物生产许可证号:SCXK(豫)2020-0005。PTE(批号:41876)购于MCE公司;胎牛血清(批号:2203013)、链霉素(批号:2149393)均购于Vivacell公司;无糖培养基(批号:2323273)购于Gibco公司;ECM(批号:34356)完全培养基购于Sciencell公司;HO-1抗体(批号:KK1123)、HRP标记的山羊抗兔(批号:KK1116)、山羊抗鼠二抗(批号:KK0824)购于成都正能生物公司;β-actin(批号:10021787)购于武汉三鹰公司;AST(批号:20211027)及ALT(批号:20211028)检测试剂盒购于南京建成公司。
1.2 实验方法实验小鼠分为:假手术组、模型组(I/R组)、PTE处理组(10、20、40 mg·kg-1)。实验前1 d对上述分组小鼠12 h禁食处理。(1)假手术组:1%戊巴比妥钠腹腔麻醉小鼠,固定小鼠,于肋下缘与腹中线交点作纵向切口,裸露出第一肝门,眼科镊小心游离出门静脉和肝动脉,不夹闭肝叶供血,不进行任何其他处理,最后缝合腹腔。(2)肝缺血/再灌注损伤模型组(I/R):1%戊巴比妥钠腹腔麻醉小鼠,固定小鼠,于肋下缘与腹中线交点作纵向切口,裸露出第一肝门,眼科镊小心游离出门静脉和肝动脉,止血夹夹闭肝中叶和左叶门静脉,夹闭0.5 min观察左叶和中叶同肝右叶对比明显变白,临时缝合腹腔创口,覆盖无菌纱布,立即将小鼠置于37 ℃恒温垫维持体温恒定。持续缺血60 min,拆除缝合线,快速取下止血夹,0.5 min肝脏缺血部分逐渐恢复正常颜色,缝合腹腔,再灌注6 h后摘取眼球收集血液样本,取肝脏样本。(3)PTE处理组(10、20、40 mg·kg-1):肝缺血/再灌注前1 h,小鼠腹腔注射3种浓度的PTE,再灌注6 h后眼球取血,取肝脏样本。
1.3 LSECs原代细胞提取分组1%戊巴比妥钠注射麻醉小鼠,沿腹股沟中线开放腹腔,留置针穿刺门静脉,切开下腔静脉,使用37 ℃预热的0.5 mmol·L-1的EGTA灌流3 min,蠕动泵速率为60 r·min-1,换用37 ℃预热的消化液对肝脏再灌注5 min,蠕动泵速率为40 r·min-1,至肝脏松塌有裂痕。剪下肝脏放入纯培养基的平皿,撕碎让肝细胞流出,200目滤网过滤未消化的组织,分离肝窦内皮细胞使用Percoll梯度离心法和选择贴壁法纯化。LSECs分组为对照组、模型组、PTE处理组。对照组使用正常培养基培养,无任何处理;模型组做缺氧复氧处理;PTE处理组使用不同浓度PTE(10、20、40 μmol·L-1)预处理6 h,再进行缺氧复氧处理。
1.4 小鼠血清ALT/AST测定各实验组小鼠在手术完成后,使用眼科镊摘去眼球取血,37 ℃静置1.5 h,4 ℃(3 500 r·min-1,10 min) ,收取血清,按照检测试剂盒说明书操作,在405 nm测定吸光度,分别计算ALT/AST含量。
1.5 肝组织病理学检查小鼠肝脏缺血/再灌注后,离体分离在4%多聚甲醛固定。乙醇梯度脱水后包埋,苏木精伊红染色后封片,随机选择区域光学显微镜拍摄观察。
1.6 透射电镜观察肝窦内皮组织细胞根据上述方法分组,小鼠肝脏组织再灌注后,将肝脏标本分割成1 mm3,立即放入5%稀释浓度的戊二醛中固定,乙醇梯度脱水、块染、渗透和包埋处理,使用超薄切片机获得超薄切片,在透射电子显微镜(Talos L120C G2)观察。
1.7 扫描电镜观察窗肝窦内皮细胞窗孔按照上述分组,肝窦内皮原代细胞提取后接种于24孔板,孔板下覆盖14 mm细胞爬片,经缺氧复氧步骤处理,5%稀释浓度的戊二醛固定6 h,经乙醇梯度脱水后,K850型临界点干燥仪干燥,离子溅射仪涂上薄层金属,并在场发射扫描电子显微镜下(Gemini SEM 300)观察。
1.8 Western blot按照上述分组,原代细胞经体外缺氧复氧步骤在RIPA裂解缓冲液中制备全细胞裂解物,经恒压SDS凝胶电泳采用恒流湿转至硝酸纤维素转印膜,放于封闭液中常温封闭3 h。洗膜后常温一抗孵育2 h,漂洗后室温二抗于低速摇床上孵育1.5 h,通过化学发光成像系统获取图像。使用ImageJ软件定量。
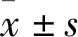
2 结果
2.1 PTE处理对肝脏ALT、AST表达影响检测各组血清ALT和AST水平,由Fig 1可得出,I/R组ALT和AST水平明显上升髙(P<0.01),同时PTE治疗组血清ALT和AST水平较I/R组明显降低(P<0.01),说明PTE对小鼠肝脏有明显保护作用。
2.2 PTE处理对肝脏结构保护小鼠肝脏组织HE染色结果如Fig 2,假手术组(Fig 2A)肝细胞形态边界完整,无任何病理性改变;I/R组(Fig 2B)核固缩,出现严重坏死,病理损伤明显增加。经3种剂量的PTE治疗组(Fig 2C~E)显示出较小的肝细胞死亡区域,同I/R组相比坏死明显降低。
2.3 PTE处理对肝窦内皮细胞保护作用TEM观察肝脏各组超微结构(Fig 3),假手术组:肝窦内皮细胞绕肝窦腔排列,呈扁平状,可明显观察到大量的开放的开窗结构,内皮下膜薄,缺乏有组织的基底膜,腔内胶原纤维较少;I/R组:窗孔数量同假手术组相比,明显减少,内皮下胞膜增生变厚,出现连续基底膜;PTE预处理组:窗孔开放数量明显增多。

Fig 1 Changes in serum ALT and AST levels in mice A:Serum ALT level;B:Serum AST level;CON:Control group;I/R:Model group;PTE-10:Pterostilbene 10 mg·kg-1 treatment group;PTE-20:Pterostilbene 20 mg·kg-1 treatment group;PTE-40:Pterostilbene 40 mg·kg-1 treatment group;##P<0.01 vs CON group;**P<0.01 vs I/R group.
2.4 PTE处理对肝窦内皮细胞窗孔的影响肝窦内皮原代细胞SEM检测(Fig 4),结果显示:在正常肝窦内皮细胞中,具有明显的窗孔结构,窗孔开放;I/R组细胞窗孔明显减少;PTE处理组窗孔数量同I/R组相比,有明显增加。表明PTE可改善缺血/再灌注后肝窦内皮细胞窗孔开放,有利于肝脏微循环恢复,减轻肝脏缺血/再灌注损伤。
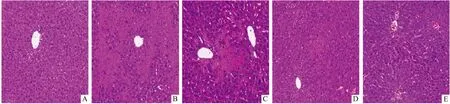
Fig 2 Hetopathological HE staining of liver in various groups of miceA:Sham group;B:I/R group;C:Pterostilbene 10 mg·kg-1 treatment group;D:Pterostilbene 20 mg·kg-1 treatment group;E:Pterostilbene 40 mg·kg-1 treatment group.
Fig 3 Effects of pterostilbene on liver tissue in various groups of mice observed by transmission electron microscopy (TEM)A:Liver tissue in the sham group;B:Liver tissue in the I/R model group;C:Pterostilbene treatment group.E:endothelial cells,H:hepatocytes,V:villi,F:fenestrae,S:blood sinuses

Fig 4 Effects of pterostilbene on fenestrae of liver sinusoidal endothelial cells in each group of mice observed by scanning electron microscopyA:Liver sinusoidal cells of normal mice;B:Liver sinusoidal endothelial cells of model group;C:Liver sinusoidal endothelial cells of pterostilbene treatment group.
2.5 PTE处理对肝窦内皮细胞一氧化氮合酶蛋白表达影响同对照组相比(Fig 5),OGD/R后HO-1蛋白表达明显下降(P<0.01),经过PTE预处理后,HO-1表达水平明显上调(P<0.01)。
3 讨论
PTE从蓝莓浆果中提取,属于天然结构化合物,具有抗炎、抗氧化作用。PTE能通过上调 PINK1介导的线粒体自噬在肝脏I/R损伤中发挥保护作用;并且还可以降低TNF-α、IL-1β和NF-κB的表达,减轻急性肝损伤诱导的组织损伤、炎症反应[12]。在前期研究中,通过体内实验建立70%肝脏缺血/再灌注(缺血60 min)模型,也证实了PTE处理显著降低血清中ALT、AST表达,减少肝脏缺血/再灌注后的组织水肿坏死。但这都是在肝实质细胞中讨论,对于非实质细胞还没有具体研究。

Fig 5 Effects of pterostilbene on HO-1 protein expression levels of liver sinusoidal endothelial cells in various groups A:Western blot detected the expression level of HO-1;B:HO-1 protein semi-quantitative analysis;1:Control group;2:OGD/R group;3:Perostilbene 10 μmol·L-1 treatment group;4:Pterostilbene 20 μmol·L-1 treatment group;5:Pterostilbene 40 μmol·L-1 treatment group;##P<0.01 vs Control group;**P<0.01 vs OGD/R group
肝脏70%非实质细胞为LSECs,与其他血管内皮细胞的形态和功能不同,LSECs沿窦壁排列呈扁平状,细胞边界清晰,存在典型的窗孔结构。缺乏基底膜,没有隔膜,从而使肝脏微血管内皮不连续[13]。最新研究发现,LSECs在IRI期间迅速去分化,获得血管收缩、促炎和促血栓特性,这一过程被称为“毛细血管化”,窗孔和基膜沉积的缺失阻碍了肝细胞的适当氧化,ATP供应减少,物质运输障碍,最终导致损伤相关分子模式(DAMP)的分泌[14]。本研究在体内实验通过TEM观察发现,缺血/再灌注后LSECs窗孔数量明显减少,内皮下胞膜增生变厚,出现连续基底膜。而当PTE预处理后窗孔开放数量显著增多。为进一步证实这种现象,体外实验通过差速离心法分离原代LSECs,并采用氧-葡萄糖剥夺再恢复(OGD/R)构建肝缺血/再灌注模型。SEM显示,正常组LSECs窗孔数较多,缺氧后窗口数减少;与模型组相比,PTE治疗组LSECs窗口数显著增加。这些证据说明肝脏I/R期间,PTE对于LSECs窗孔结构的完整性具有很好的保护作用,进而维持肝脏的微循环,保证能量供应和物质运输。
HO-1是催化血红素降解限速酶,是炎症细胞和组织损伤的关键介质,通过减轻氧化应激损伤,调节细胞周期以及改善微循环发挥有益作用。有相关研究表明通过上调HO-1可以减轻LSECs中的缺血性损伤[15]。本课题组发现,PTE能够诱导OGD/R后LSECs内HO-1表达,降低LSECs缺氧-复氧损伤。
综上所述,PTE通过保护LSECs的结构和功能减轻肝脏免受缺血/再灌注损伤。该过程中,PTE通过保护LSECs窗孔结构的完整性,上调HO-1蛋白表达水平发挥重要作用。因此,本研究为PTE保护肝脏免受缺血性损伤提供了新的理论依据。
