链霉菌中3个新脂肪酰胺类化合物
2023-02-04何江波康大伟牛燕芬王纪爱毕晓旭曹艳茹
何江波,王 莹,康大伟,牛燕芬,王纪爱,陈 秀,毕晓旭,栾 杰,曹艳茹**
(1.昆明学院 医学院,云南 昆明 650214;2.云南省疾病预防控制中心 理化检测中心,云南 昆明 650022)
特殊生境的微生物具有较高的创造能力,可以产生多种多样结构新颖的活性成分,这些活性化学物质可以成为研究药物的先导化合物,有的甚至可以成为生物农药[1].在特殊生境微生物的研究中,链霉菌研究受到广大学者的较高关注.链霉菌属于好氧革兰氏阳性菌,广泛分布于土壤、海洋、极端环境和一些生物体内[2-5].链霉菌基因组特有的生物合成基因簇,可以产生具有生物活性的次生代谢产物,这些代谢产物被应用于抗病毒、抗真菌、抗肿瘤药物开发等[6].李惠玲等[7]从海洋链霉菌Streptomycessp.S598的次生代谢产物中分离得到抗菌活性物质缬氨霉素,对白色念珠菌和金黄色葡萄球菌均有较好的抑制活性.在现代农用抗生素开发方面,链霉菌也具有较大的优势,李萍等[8]从黄抗霉素链霉菌的次生代谢产物中分离得到一种杀线虫活性化合物TDD,该化合物对线虫48 h的致死率为40%.国产的杀稻瘟菌素就是从有色产色链霉菌(Streptomyces griseochromogenes)的代谢产物中分离得到[9].因此链霉菌是一类应用前景广阔的微生物资源,研究链霉菌的次生代谢产物,对挖掘药物资源具有重要的意义.
本课题组一直从事微生物资源开发,Streptomyces plumbidurans[10]是我们从昆明东川铜矿中分离得到,并经16S rRNA基因鉴定为链霉菌(GenBank号:MW526995).为深入研究该菌,寻找可利用的天然产物,我们采用PDB培养基发酵该菌,对发酵液进行浓缩,然后采用乙酸乙酯萃取,并对乙酸乙酯部分进行系统分离与化学成分鉴定.从中分离得到3个新脂肪酰胺类化合物,分别命名为kcacylamide A~C (1~3) (图1).我们对化合物1~3进行体外抗肿瘤活性和体外抑菌活性评价,3个化合物在50 μmol/L浓度下均无明显的抑制人结肠癌细胞 (HCT116)、人宫颈癌细胞 (Hela)、肝癌细胞 (LM-3)肿瘤细胞生长活性和抑制大肠杆菌(ATCC25922)、金黄色葡萄球菌(ATCC25923)以及枯草芽孢杆菌(ATCC6051)活性.本文主要报道Streptomyces plumbidurans代谢产物中的3个脂肪酰胺类化合物分离鉴定及初步活性筛选结果.
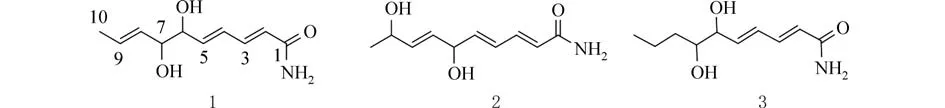
图1 化合物1~3的化学结构Fig.1 Chemical structures of compounds 1~3
1 材料与方法
1.1 材料菌株鉴定:自云南昆明东川铜矿中分离,16S rRNA基因序列分析结果表明KC 17012为链霉菌属(Streptomyces)菌株, GenBank号:MW526995.菌种目前保存于昆明学院农学与生命科学学院菌种库(编号为KC 17012).
Streptomyces plumbidurans活化培养基:PDA培养基,土豆 200 g,葡萄糖20 g,琼脂20 g,自来水1 000 mL,微量盐 1 mL,121 ℃,灭菌30 min.
Streptomyces plumbidurans发酵培养基:PDB培养基,土豆200 g,葡萄糖20 g,自来水1 000 mL,微量盐1 mL,121 ℃,灭菌 30 min.
指示菌培养基:LB 固体培养基,胰蛋白胨 10 g,酵母提取物 5 g,氯化钠10 g,琼脂20 g,自来水1 000 mL.
1.2 菌株活化与种子液的培养将保存于4 ℃的菌株Streptomyces plumbidurans接种于PDA平板,28 ℃培养7 d以进行活化.然后将单菌落接种至改良ISP 2培养基 (1 L):恒温摇床28 ℃,180 r/min,培养 3 d,作为种子液.
1.3 菌株发酵将种子液接种至PDB培养基25 L,培养8 d,28 ℃,180 r/min,发酵液采用纱布过滤,收集滤液,得发酵液25 L,然后将发酵液减压浓缩至2 L.
1.4 仪器与试剂质谱仪(美国Agilent 6500系列Q-TOF LC/MS);核 磁 共 振 仪(Avance 600 MHz,TMS作为内标);万分之一电子天平(上海越平科学仪器有限公司);摇床(上海智城分析仪器制造有限公司,ZWY-2102);柱色谱用硅胶、薄层色谱用硅胶GF254(青岛海洋化工厂有限公司);Sephadex LH-20(美国GE公司); D101大孔树脂(沧州宝恩吸附材料科技有限公司);色谱试剂(上海星可高纯度试剂公司);石油醚、二氯甲烷、丙酮、乙酸乙酯、甲醇等有机溶剂均为工业纯,经重蒸后使用.显色剂为H2SO4(10%)的乙醇溶液.
1.5 发酵代谢产物的提取与分离发酵液浓缩液采用等体积的乙酸乙酯萃取3次,浓缩萃取液,得乙酸乙酯浸膏43 g.将乙酸乙酯浸膏用甲醇溶解,过滤,除去不溶物,然后采用D101大孔树脂柱(φ80 mm×500 mm)初步分离,洗脱剂为10%~100%乙醇水梯度洗脱;根据薄层色谱(TLC),10%浓硫酸乙醇溶液显色合并相似成分,得6个组分Fr A~F.
Fr A组分(1.3 g),经Sephadex LH-20柱(MeOH)纯化,根据TLC合并相似组分,得到Fr A 1~3.Fr A-2(132 mg)部分,采用硅胶柱色谱分离,洗脱剂为石油醚-丙酮(体积比20∶1~3∶1),得到化合物1(11 mg)和化合物2(6 mg).FrA-3(78 mg) 部分结晶后的母液,通过硅胶柱色谱分离,洗脱剂为石油醚-丙酮(体积比15∶1~3∶1),得到化合物3(2.8 mg).
1.6 体外抗肿瘤和抑菌活性评价
1.6.1 体外抗肿瘤细胞毒活性 实验采用MTT法检测人结肠癌细胞(HCT116)、人宫颈癌细胞(Hela)、肝癌细胞(LM-3)存活率,按照使用说明书用MTT [3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]法检测细胞存活率.全自动酶标仪(波长570 nm)测定各孔OD值(A);空白对照加等体积DMSO处理,以紫杉醇为阳性对照药(4 μmol/L),每组重复3个复孔.将A值作为反映细胞活性及代谢状况的参数,各实验重复3次,抑制率按公式进行计算.

1.6.2 体外抑菌实验 采用微量稀释法检测化合物的体外抑菌活性.分别将大肠杆菌、金黄色葡萄球菌以及枯草芽孢杆菌接种于LB固体培养基,37 ℃培养24 h后,挑取单菌落2~3个于20 mL LB液体培养基中,37 ℃,180 r/min摇床培养6 h,用LB液体培养基稀释成1×105CFU/mL菌悬液.称取适量的化合物1~3,用DMSO配制成100 μmol/L的储存液,并用0.22 μm微孔滤膜过滤.取无菌的96孔板,外周36孔分别加入100 μL无菌水,其余每孔加入100 μL 1×105CFU/mL菌悬液.同时,选取环丙沙星作为阳性对照,DMSO作空白对照,且每个梯度设3个复孔,微板观察法检测其最小抑菌浓度(Minimum Inhibitory Concentration, MIC)值.
2 结果与分析
2.1 化合物1的结构鉴定无色油状物,易溶于甲醇、氯仿.HR-ESI-MS显示分子式为C10H15NO3(m/z198.112 0 [M+H]+,计算值为 C10H15NO3[M+H]+198.112 5),不饱和度为4.化合物1的1H NMR谱(表1)显示含有2个含氧的次甲基氢[δH4.07(t,J=5.4 Hz,H-6),3.95(t,J=6.0 Hz,H-7)],6个烯氢[δH6.02(d,J=14.4 Hz,H-2),7.17(dd,J=15.0,11.4 Hz,H-3),6.41(dd,J=15.6,11.4 Hz,H-4),6.16(dd,J=15.6,6.0 Hz,H-5),5.52(ddd,J=15.6,7.2,1.8 Hz,H-8),5.72 (1H,dq,J=15.0,6.6 Hz,H-9)],根据耦合常数确定3个双键为E式,1个甲基信号[δH1.71,d,J=6.6 Hz,H-10],共10个 氢 信 号.13C NMR和DEPT谱显示该化合物有10个碳信号(表1),包括1个酮羰基[δc171.2],2个次甲基的碳信号[δc76.7,76.0],1个甲基信号[δc18.0],其余为双键碳信号,因此由3个双键和1个羰基构成该化合物的4个不饱和度,推测该化合物为链状不饱和脂肪酰胺.根据1H-1H COSY相关,我们可以得到H-2/H-3/H-4/H-5/H-6/H-7/H-8/H-9/H-10相关(图2).二维HMBC图谱给出H-10与C-9,C-8相关,H-8与C-7,C-9相关,H-5与C-6,C-4相关,H-2与C-1,C-3相关.由此确定化合物1的平面结构,因该类成分为长链化合物,故未鉴定其绝对构型,因此本文报道其平面结构为(2E,4E,8E)6,7-二羟基-癸酸酰胺,并命名为kcacylamide A.
2.2 化合物2的结构鉴定无色油状物,易溶于甲醇、氯仿.HR-ESI-MS显示分子式为C10H15NO3(m/z198.112 2 [M+H]+,计算值为 C10H15NO3[M+H]+198.112 5),不饱和度为4.化合物2的1H NMR谱(表1)显示含有2个含氧的次甲基氢[δH4.67(t,J=6.0 Hz,H-6),4.25(t,J=5.1 Hz,H-9)],6个烯氢[δH6.04(d,J=15.0 Hz,H-2),7.16(dd,J=15.0,10.8 Hz,H-3),6.38(dd,J=15.0,11.4 Hz,H-4),6.09(dd,J=15.6,6.0 Hz,H-5),5.65(dd,J=15.6,6.0 Hz,H-7),5.74(dd,J=15.6,6.0 Hz,H-8)],根据耦合常数确定3个双键为E式,1个甲基信号[δH1.22,d,J=6.6 Hz,H-10],共10个氢信号.13C NMR和DEPT谱显示该化合物有10个碳信号(表1),包括1个酮羰基[δc171.2],2个次甲基的碳信号[δc76.7,76.0],1个甲基信号[δc18.0],其余为双键碳信号,因此由3个双键和1个羰基构成该化合物的4个不饱和度,推测该化合物为化合物1的类似物.根据1H-1H COSY和HMBC图谱推测该化合物的平面结构(图2),为(2E,4E,7E)6,9-二 羟 基-癸 酸 酰 胺,并 命 名 为kcacylamide B.

表1 化合物1~3的1H NMR(600 MHz)和13C NMR(150 MHz) 数据Tab.1 1H NMR (600 MHz) and 13C NMR (150 MHz) data of compounds 1-3
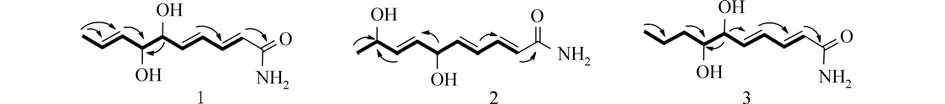
图2 化合物1~3的重要1H-1H COSY和HMBC相关Fig.2 The key 1H-1H COSY and HMBC of compounds 1-3
2.3 化合物3的结构鉴定无色油状物,易溶于甲醇、氯仿.HR-ESI-MS显示分子式为C10H17NO3(m/z200.127 8 [M+H]+,计算值为 C10H17NO3[M+H]+200.128 1),不饱和度为3.化合物3的1H NMR谱(表1)显示含有2个含氧的次甲基氢[δH4.02(t,J=6.0 Hz,H-6),3.51(m,H-7)],4个烯氢[δH6.02(d,J=15.6 Hz,H-2),7.20(dd,J=15.0,10.8 Hz,H-3),6.43(dd,J=15.6,11.4 Hz,H-4),6.24(dd,J=15.6,6.6 Hz,H-5)],根据耦合常数确定3个双键为E式,1个甲基信号[δH1.71,d,J=6.6 Hz,H-10],共10个氢信号.13C NMR 和DEPT 谱显示该化合物有10个碳信号(表1),包括1个酮羰基[δc171.2],2个次甲基的碳信号[δc76.7,76.0],1个甲基信号[δc18.0],其余为双键碳信号,因此由3个双键和1个羰基构成该化合物的4个不饱和度,推测该化合物为链状不饱和脂肪酰胺.根据1H-1H COSY相关,我们可以得到H-2/H-3/H-4/H-5/H-6/H-7/H-8/H-9/H-10相关(图2).二维HMBC图谱给出H-10与C-9,C-8相关,H-8与C-7,C-9相关,H-5与C-6,C-4相关,H-2与C-1,C-3相关.由此确定化合物3的平面结构,为(2E,4E,8E)6,7-二羟基-癸酸酰胺,并命名为kcacylamide C.
2.4 活 性 鉴 定 结 果通 过MTT法 检 测 化 合 物1~3的体外抗肿瘤活性,检测人结肠癌细胞(HCT116)、人宫颈癌细胞(Hela)、肝癌细胞(LM-3)存活率;采用微板观察法检测枯草杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)MIC值(阳性对照环丙沙星MIC为2 μmol/L),结果显示3个化合物在50 μmol/L浓度下均无显著的抗肿瘤细胞毒活性及抑菌活性.
3 讨论与结论
在普通微生物研究达到一定程度后,越来越多的研究者们将研究目标锁定在特殊环境微生物,例如:海洋微生物、高温温泉微生物、内生菌等.这些特殊环境微生物具有产生丰富代谢产物的潜力,可以利用其次级代谢产物开发创新型杀菌剂、新药等.链霉菌本身就是一个具有较高代谢能力的菌株,国内外较多学者均在不遗余力地深入挖掘该类菌株.Streptomyces plumbidurans自云南昆明东川铜矿中分离,采用PDB培养基发酵得到次生代谢产物.采用高效液相检测发现,该菌的代谢产物较为丰富,而且较为复杂.于是我们在没有优化培养基的条件下进行该菌株的大规模发酵,采用经典的植物化学分离鉴定方法,对其发酵液进行研究,获得3个新的脂肪酰胺类成分.关于该类成分的研究报道较少,我们利用目前实验室现有的活性筛选平台,对其进行抗肿瘤细胞毒和抑菌活性筛选,目前暂时没有发现以上3个新成分具有显著的生理活性,因此我们将继续开发其他方面的生理活性.脂肪酰胺类成分在链霉菌的次生代谢产物中被报道较少,2019年Hou等[11]从海洋链霉菌Strptomyces youssoufiensis的基因突变体的分离得到一个新的脂肪酰胺类化合物.土壤来源的链霉菌Strptomyces maoxianensis中曾报道分离得到2个新的脂肪酰胺类成分,通过细胞毒测试发现化合物1和2存在较弱的抗人肺癌细胞A549、人肝癌细胞HepG2和白血病K562细胞的活性[12].关于这类成分的活性研究报道,C20长链脂肪酰胺具有类似大麻素的生理活性,具有开发成抗抑郁和抗焦虑药物的潜力[13].同时还认为脂肪酰胺虽然结构较为简单,但是却是一类重要的信号分子,影响我们的痛觉、炎症、睡眠等重要的生理功能[14].由此可见,对于该菌的开发,还可以进一步深入研究,通过优化培养基以提高代谢产物的多样性,为先导化合物的开发提供资源.
本文从东川铜矿中分离得到一株Streptomyces plumbidurans,采用PDB培养基发酵该菌,并研究其次生代谢产物,从中分离得到3个全新的脂肪酰胺类化合物,并利用核磁、质谱、红外光谱等确定其平面结构.对3个新化合物进行了初步的抗肿瘤细胞毒活性测试和抗菌活性测试,为深入研究该菌的次生代谢产物奠定了基础.
