肢端肥大症性心肌病1例报告
2023-02-04潘红梅赵红王聪李成博
潘红梅 赵红 王聪 李成博
华北理工大学附属医院心内科 河北唐山 063000
肢端肥大症是指体内生长激素持久过度分泌,所导致的一种内分泌代谢性疾病,是发生在青春期之后,骨骺已经完全闭合,病因与腺垂体内分泌功能紊乱有关,约98%的患者继发于分泌生长激素的垂体肿瘤;其主要表现为:面容宽阔、眉骨突出、巨耳大鼻、内部脏器和体格异常肥大及身材过高等症状。肢端肥大症患者的心血管疾病发生率较正常人明显增高,生长激素持续高分泌状态导致心脏结构及功能发生改变,从而引起肢端肥大症性心肌病。我科近期收治肢端肥大症性心肌病患者1例,现结合其临床资料及相关文献,进行回顾性分析,并作出相应总结以便提高对本病的认识。
1 病例资料
患者,男,24岁,主因咳嗽咳痰,活动后喘息15d,加重伴夜间不能平卧10d于2020年9月20日收入我院。患者于入院前15d受凉后出现咳嗽咳痰,为黄色黏痰,伴活动后喘息,无发热,无胸闷、胸痛,就诊于当地诊所,考虑为“支气管炎”,给予抗炎、化痰药物(具体不详)治疗后症状未见明显缓解。入院前10d上述症状加重,夜间平卧受限,就诊于当地中医医院,辅助检查提示白细胞明显升高(白细胞 15.08×109/L,中性粒细胞 13.13×109/L)。降钙素水平轻度升高(0.103ng/mL)。心肌酶轻度异常(cTnI:0.5ng/mL,MYO:348mg/mL,CK:1757U/L,CK-MB:33U/L,LDH:319U/L)。N端脑钠肽前体(NT-proBNP)明显升高(7666pg/mL)。空腹血糖:7.01mmol/L。肺炎支原体抗体IgG阳性。心脏彩超提示:全心增大,左心功能减低,左室壁增厚,三尖瓣少量反流,肺动脉高压,心包积液,射血分数:29%。考虑“社区获得性肺炎”,给予抗炎、化痰等治疗,病情未得到明显改善。为求进一步诊治,于2020年9月20日就诊于我院。入院查体:T:36.6℃,P112次/min,R20次/min,BP130/102mmHg,神志清楚,语言流利,身型巨大(BMI=37.5),声音低沉,手脚粗大,面貌粗犷,颧弓突出,眉弓高,口唇增厚,耳鼻宽大,双呼吸音粗,可闻及湿啰音,叩诊心界向两侧扩大,心率112次/min,律齐,各瓣膜听诊区未闻及病理性杂音,腹部查体未见异常,双下肢无指凹性水肿。入院辅助检查:入室心电图:窦性心律,I、V6导联T波低平,aVL、V4、V5导联倒置,见图1。床旁胸片(2020年9月20日):(1)心影增大,考虑心功能不全伴两肺瘀血;(2)两下肺少许渗出性病变;(3)左肺少许纤维性病变。NT-proBNP(2020年9月20日)14231.2pg/mL。降钙素原:轻度升高(0.10ng/mL),血沉正常(18mm/h),空腹血糖7.63mmol/L,尿酸高(856μmol/L)。人血浆脂蛋白磷脂酶A2、病毒抗体系列、甲功五项、尿常规、复查心肌酶均未见异常。心脏超声(2020年9月20日):全心扩大,收缩功能减低,左房内径45.8mm,左室内径78.8mm,右房横径43mm×50mm,室间隔厚度12.3mm,左室后壁12.7mm,射血分数38%。三尖瓣轻度反流,少-中量心包积液(侧心包腔深约9.8cm,后心包腔深约7.9cm,心尖腔深约10.4cm)。入院初步诊断:心力衰竭心功能IV级(NYHA分级);肢端肥大症?肺炎; 糖尿病待除外。
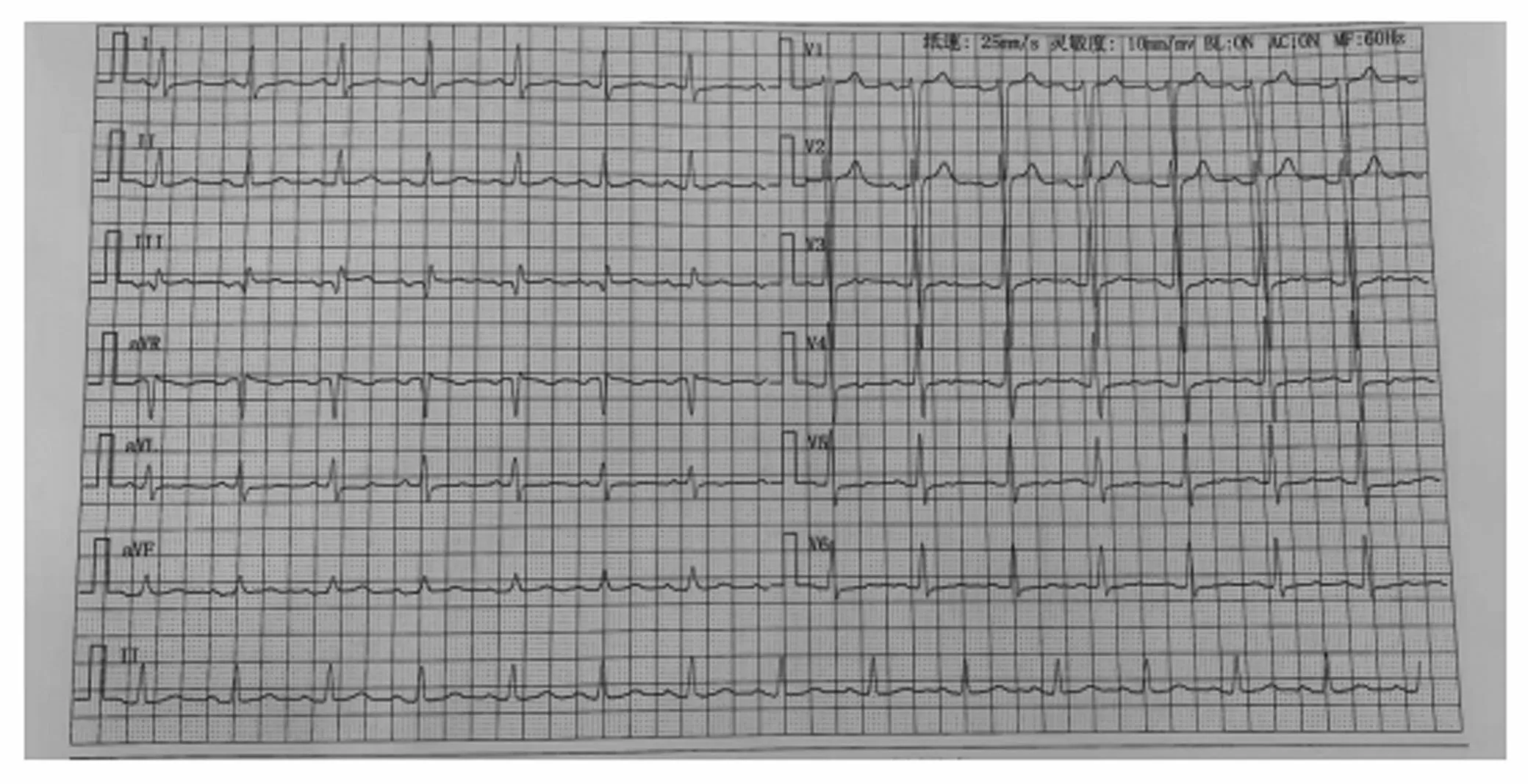
图1 入室心电图
结合患者面部特征及肢端肥大表现,不除外肢端肥大症可能,请内分泌科会诊后完善口服葡萄糖生长激素抑制试验(OGTT-GH):空腹生长激素(growth hormone,GH)26.44ng/mL(正常值≤1.00ng/mL),60minGH 22.61 ng/mL,120minGH 26.27 ng/mL,180minGH 30.92ng/mL。血清IGF-I水平1399μg/L(正常值116~358 μg/L)。胰岛素+C肽检测:空腹胰岛素51.57μU/mL,30min胰岛素185.1μU/mL,60min空腹胰岛素188.0μU/mL,120min胰岛素165.9μU/mL,180min胰岛素79.83μU/mL。空腹C肽18.85ng/mL,30minC肽5.66ng/mL,60minC肽28.51ng/mL,120minC肽31.19ng/mL,180minC肽26.28ng/mL。性激素:催乳素偏高(504.8μIU/mL),孕酮偏高(1.23nmol/L),睾酮偏低(4.30nmol/L)。血浆皮质醇测定8:00、16:00、24:00,促肾上腺皮质激素未见明显异常。垂体增强核磁:(1)垂体中部及左侧占位性病变,考虑垂体瘤(大小约1.8cm×1.5cm×1.3cm),病变与左侧海绵窦及左侧颈内动脉海绵窦段关系密切;(2)垂体右后部异常信号,考虑Rathke’s囊肿可能;(3)两侧筛窦及上颌窦炎;(4)大枕大池,见图2。

图2 垂体增强核磁
入院后予抗感染、利尿以减轻心脏负荷、抑制心室重塑等综合治疗,喘息症状较前明显好转,复查NT-proBNP(2020年9月23日):477.6ng/mL,肾功能(2020年9月24日):尿素10.03mmol/L,肌酐110μmol/L,尿酸1060μmol/L。结合患者上述症状、体征、GH及垂体核磁结果,请神经外科会诊,诊断为生长激素型垂体腺瘤。但考虑患者目前心功能差不能耐受手术,暂给予肌肉注射善龙(注射用醋酸奥曲肽微球)20mg降低血清GH水平,28d为1个周期,待内环境稳定后行手术治疗。于2020年9月30日行第一次肌内注射善龙治疗,治疗后患者自行出院。出院诊断:生长激素型垂体腺瘤,肢端肥大症性心肌病,心功能IV级(NYHA分级)。出院前(2020年9月29日)复查心脏超声:左房52.2mm,左室62.3mm,室间隔12.4mm,左室后壁13.5mm,射血分数20%。左心及右室增大,左室壁增厚,左心功能明显减低。出院后分别于2020年10月28日、11月25日、12月23日及2021年1月20日、3月18日在我院神经外科接受善龙肌内注射治疗。每次注射前均行超声心动图检查,结果见表1。
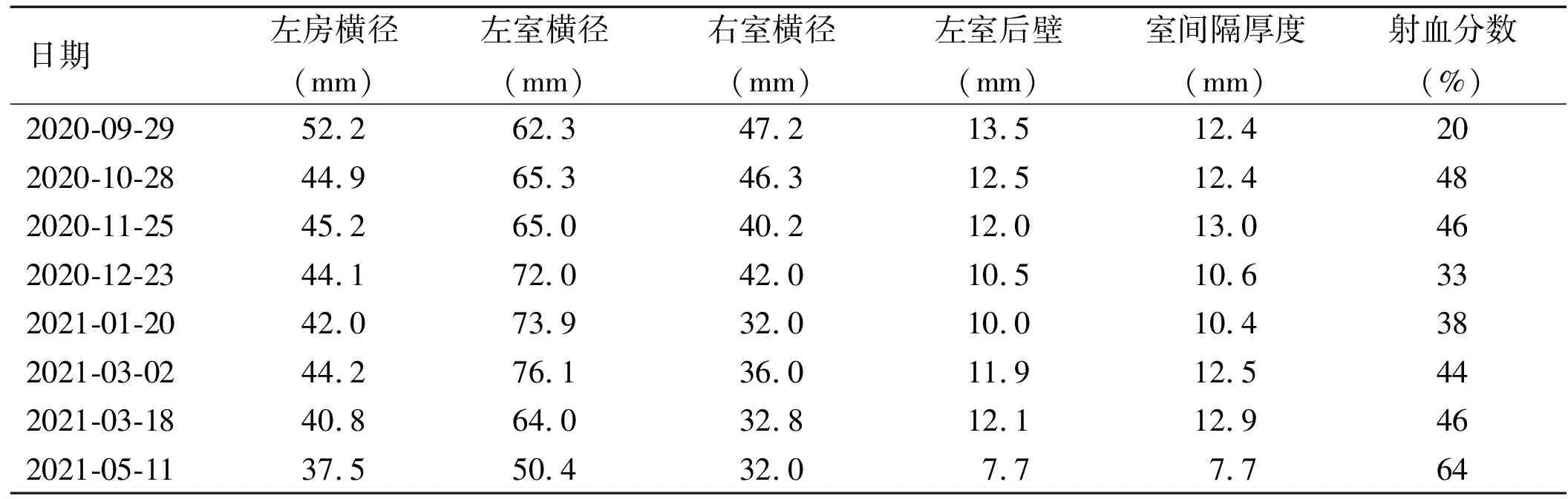
表1 多普勒超声心动图检查结果
2 讨论
肢端肥大症是由GH长期高分泌引起的一种内分泌代谢性疾病,绝大多数继发于生长激素型垂体腺瘤。GH作用于肝脏,促进胰岛素样生长因子-1 (insulin-like growth factor-1,IGF-1)分泌增加,持续过量的GH、IGF-1导致患者出现典型肢端肥大症状、体征,随病程的持续发展,亦可出现呼吸系统、心血管系统、消化系统和糖代谢等多系统并发症,其中以心血管并发症最为常见。
中国肢端肥大症诊治共识(2021版)指出肢大诊断标准为OGTT-GH谷值≥1.0μg/L。该患者以典型面貌、肢端肥大为主要特征,入院完善OGTT-GH、IGF-1均明显高于正常值上限,垂体增强核磁提示垂体瘤,肢端肥大症诊断明确。肢端肥大症通常起病隐匿,主要以心血管系统并发症多见,主要表现为心脏增大,其次为高血压、冠心病、室性心律失常和充血性心力衰竭等,即引起肢端肥大症性心肌病[1]。肢端肥大症性心肌病这一概念是于1957年Bridgen提出的,是指排除其他病因后,由肢端肥大症所致的心脏结构及功能异常[2]。主要临床表现为双心室肥厚、舒张及收缩功能障碍和瓣膜反流。肢端肥大症性心肌病病程主要分三个阶段:早期持续升高的GH、IGF-1使左右心室心肌细胞肥大,心肌收缩力增加,心排血量增加。在中期心肌肥厚更加明显,心室舒张功能受损,运动时左心室射血分数下降。随病程发展,最终发展为静息状态下收缩功能障碍和心力衰竭。本例为青年男性,本次入院以活动后喘息为主要表现,完善超声心动图提示左房、双心室扩张(以左心室为主),室间隔、左室后壁增厚,射血分数明显下降,左心功能减低。完善检验及影像学检查后可明确为肢端肥大症所致的心脏结构及功能障碍。追问病史诉既往无心血管疾病病史,故心功能不全病因与GH长期持续高分泌所致心脏结构、功能改变相关,本次感染后导致充血性心力衰竭的急性发作。
肢端肥大症性心肌病发病主要考虑与以下几点相关:(1)过量的GH可以直接作用于心肌组织,使心肌细胞肥大。同时促进细胞外胶原沉积和淋巴细胞浸润,使心肌纤维紊乱,引起心肌纤维化,导致双心室向心性肥厚,从而影响心脏的收缩和舒张功能,从而导致充血性心力衰竭[1,3];(2)GH是肝脏产生IGF-I的内分泌启动子,过量的GH通过间接作用IGF-I而促使器官组织生长发育。且早已有确凿证据表明GH/IGF-I轴对心脏发育和心肌肥厚的调控有重要作用[4-6]。GH通过刺激局部IGF-I的产生而发挥作用,随后IGF-I再通过旁分泌或自分泌机制促进组织生长[1]。在已有实验中当给垂体切除的大鼠注射IGF-I后,包括心脏在内的众多器官均有显著的促生长作用[7]。IGF-I作为一种内分泌性生长因子通过体循环发挥作用,而心脏与其他组织、器官相比增大最为明显,主要是因为GH受体基因在心肌细胞中的表达程度最高,GH通过增加心脏中IGF-I的含量从而诱导IGF-ImRNA的表达。因此IGF-I控制机体组织生长的旁分泌和自分泌机制的主要先决条件存在于心肌细胞中[8]。
肢端肥大症另一常见的代谢并发症为糖代谢异常,20%~56%的肢端肥大症患者存在糖尿病,16%~64%存在糖耐量异常[9]。本例患者入院测空腹血糖>7.0mmol/L,完善糖耐量试验可见胰岛素呈高分泌状态,提示患者存在胰岛素抵抗。一方面,GH既可以促进肝糖原的生成又能抑制肌糖原的代谢。另一方面,GH促进肝脏产生过量IGF-1,间接促进胰岛素微作用,导致胰岛素抵抗,从而进一步发展为高胰岛素血症[10]。
肢端肥大症的治疗目标是尽早恢复生长激素、IGF-1正常水平。治疗方法包括手术治疗、放射治疗及药物治疗[11]。本例患者垂体瘤诊断明确,首选经蝶窦手术治疗,但由于心功能差不能耐受手术,暂给予药物治疗。治疗药物包括长效生长抑素受体配体(somatostatin receptor ligands,SRLs)、多巴胺受体激动剂 (dopamine receptor agonists,DAs)和 GH受体拮抗剂三大类。本例患者给予善龙(注射用醋酸奥曲肽微球)治疗。善龙是一种人工合成的天然生长抑素的八肽衍生物,可与广泛存在于中枢神经系统、垂体和胰腺β细胞等处的生长抑素受体结合产生生物学效应。对于肢端肥大症患者,能够产生稳定的有治疗作用的血清奥曲肽水平,从而持续降低生长激素水平并使血清IGF-I水平降低。本例患者分别于2020年9月30日、10月28日、11月25日、12月23日及2021年1月20日、3月18日给予善龙治疗,复查心脏彩超可见左、右心室较前明显减小,左房较前减小,射血分数较前明显增加。生长抑素类似物可使生长激素和IGF-1水平正常化,经过1~3个月的短期治疗,已被证明可有效降低左室后壁和室间壁厚度,长期治疗效果更显著[12]。由此可见,对于肢端肥大症性心肌病患者来说,当生长激素水平下降至正常水平后,心脏结构也会随之改变,心功能得到相应改善。马驰原等[13]回顾分析13例肢端肥大症性心肌病患者,在明确诊断的基础上实行垂体腺瘤切除术后,其中8例术后心肌肥厚减轻或恢复正常,3例心肌肥厚明显减轻。由此可见,经蝶窦切除垂体瘤是肢端肥大症的首选治疗;因此,在给予药物治疗后,将心功能控制在III级之下,尽早手术可有效逆转病变,获得满意的疗效。
肢端肥大症虽罕见,但并发症多,病死率高。因此早期诊断、及时治疗是限制肢端肥大症性心肌病进展的最佳途径,而治疗该病的关键在于尽早恢复生长激素正常水平。无论是对心血管危险因素的控制、内科药物治疗,还是外科手术切除垂体腺瘤,都有助于帮助逆转其病理生理变化,降低心血管疾病的风险从而改善预后[8]。
