高迁移率族蛋白1对系统性红斑狼疮肾损伤肾小球内皮细胞通透性影响
2023-02-04杨玉淑韩玉祥彭晨星
田 玉,杨玉淑,韩玉祥,丁 萌,彭晨星
河北医科大学第二医院 风湿免疫科,河北 石家庄 050000
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多器官、多系统,具有高异质性特征的自身免疫性疾病[1-2]。炎症反应和免疫紊乱是SLE发生发展的病理基础[3]。肾小球滤过屏障(glomerular filtration barrier,GFB)受损所导致的蛋白尿是SLE肾损伤的重要临床表现,而人肾小球内皮细胞(human glomerular endothelial cell,HRGEC)是GFB的重要组成部分。因此,探讨HRGEC在SLE肾损伤中的作用十分重要。高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种存在于真核细胞核中的非组蛋白核蛋白,细胞损伤后,HMGB1可大量释放至细胞外,除直接刺激细胞,还会与DNA、细胞因子、外源性因子、核小体等形成免疫刺激复合物,在自身免疫性疾病和炎症的发生发展中具有重要作用[4]。有研究表明,狼疮性肾炎(lupus nephritis,LN)患者血清HMGB1水平明显升高,且与蛋白尿、狼疮活动指数呈正相关[5],提示HMGB1可能参与了SLE患者肾损伤的发生过程。但HMGB1是否参与了SLE中HRGEC的损伤尚未明确。本研究以SLE肾损伤患者血浆刺激HRGEC来模拟疾病的微环境,旨在探讨HMGB1在SLE中对HRGEC通透性的影响,以期为临床治疗提供理论依据。现报道如下。
1 资料与方法
1.1 一般资料 选取自2020年1月至2022年3月于河北医科大学第二医院行血浆置换术治疗的50例SLE患者为研究对象。以24 h尿蛋白定量0.5 g为标准将患者分为A组(无蛋白尿,n=27)和B组(有蛋白尿,n=23)。另选取同期于我院体检的50例健康者纳入健康组。SLE患者纳入标准:(1)符合SLE诊断标准[6];(2)未合并血液系统疾病或恶性肿瘤;(3)未合并重要器官严重损伤;(4)临床资料完整。排除标准:(1)合并糖尿病;(2)妊娠或哺乳期女性;(3)精神状态较差,无法配合本研究。A组中,男性3例,女性24例;年龄29~53岁,平均40.90岁。B组中,男性5例,女性18例;年龄20~56岁,平均37.80岁。健康组中,男性11例,女性39例;年龄25~62岁,平均40.92岁。各组研究对象年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 血清学检查 采集所有研究对象空腹静脉血,离心收集血浆,采用酶联免疫吸附法检测血浆HMGB1、内皮素-1、溶性血管细胞黏附分子(soluble vascular cell adhesion molecule,sVCAM-1)水平,所有操作均按照试剂盒说明书进行。HMGB1、sVCAM-1、内皮素-1酶联免疫吸附试剂盒均购自上海碧云天生物技术有限公司。
1.2.2 HRGEC培养 原代HRGEC购自美国sciencell公司。使用含10% FBS、Penicillin、Streptomycin、生长添加剂的ECM培养基培养HRGEC,每2~3 d换液1次,将细胞置于含5%二氧化碳的细胞培养箱中,37℃静置培养。
1.2.3 CCK8检测细胞活力 将HRGEC分为control组与LN组。control组以健康者血浆刺激细胞,LN组以SLE肾损伤血浆刺激细胞,刺激浓度分别为0、5%、10%、15%和20%,孵育24 h后利用CCK8试剂盒检测各组细胞的增殖活力。
1.2.4 跨膜电阻检测 利用transwell小室构建HRGEC单层,应用跨细胞电阻仪测定control组与LN组SLE肾损伤血浆刺激6 h、12 h、18 h、24 h细胞层的跨膜电阻(transepithelial electrical resistance,TEER)。Transwell小室使用前给予牛纤维连接蛋白包被,加入全培养基在培养箱平衡过夜。将HRGEC细胞悬液以1×105个/ml接种于transwell小室上室,下室加入培养基,另设只有培养基的空白孔。镜下观察细胞呈融合状态,且反复多次跨膜电阻仪测定TEER值稳定24 h以上,提示HRGEC单层构建成功。测量空白孔的电阻值,连续测量3次,取平均值。TEER值=(各孔电阻值-空白孔电阻值)×transwell上室底面积,结果重复5次。
1.2.5 FITC-BSA法检测HRGEC单层的通透率 测定control组与LN组SLE肾损伤血浆刺激6 h、12 h、18 h、24 h的HRGEC单层的通透率。在transwell小室上室接种细胞,待TEER值稳定24 h后,PBS漂洗小室,根据分组在上室分别加入相应的试剂,同时加入5 mg/ml的FITC-BSA 0.1 ml,下室加入等摩尔、无标记的BSA 0.3 ml,避光环境下37℃细胞培养箱孵育。按照实验设计要求孵育不同时间后,分别从上室及下室吸取培养基,倍比稀释,利用荧光分光光度计检测上室、下室样品的荧光强度(激发波长495 nm,发射波长520 nm)。FITC-BSA购自北京索莱宝科技有限公司。
采用通透系数(P)表示内皮细胞单层对BSA的通透性大小,通透率的计算公式:P=[F](1/A)(v/[L])。[F]为下室FITC-BSA的荧光强度,A为transwell上室底面积,v为下室溶液体积,[L]为上室荧光强度。每组实验重复5次,取平均值。
通透率=(LN组P/control组P)×100%
1.2.6 细胞免疫荧光法检测血管内皮细胞钙黏蛋白的表达 以冰生理盐水冲洗LN组与control组细胞,4%多聚甲醛室温固定10 min,PBS洗后给予0.5% Triton 100打孔,再次PBS冲洗,正常山羊血清封闭后滴加兔抗血管内皮细胞钙黏蛋白(VE-cadherin)一抗(1∶200), 4℃过夜,滴加FITC-羊抗兔IgG,37℃孵育后PBS冲洗,防淬灭封片剂封片,激光共聚焦显微镜观察,拍照。兔抗VE-cadherin单克隆抗体购自CST公司。
1.2.7 HMGB1对HRGEC单层的通透率的影响 细胞分组:control组、LN组、LN+HMGB1中和抗体(LN+H ab)组、LN+对照IgG抗体(LN+IgG ab)组。control组给予健康血浆刺激细胞,LN组给予SLE肾损伤血浆刺激细胞,LN+H ab组及LN+IgG ab组分别给予HMGB1中和抗体(沈阳万类生物)及对照IgG抗体预处理细胞30 min,然后给予SLE肾损伤血浆刺激细胞12 h,其他操作同1.2.5。

2 结果
2.1 各组研究对象血浆HMGB1、内皮素-1、sVCAM-1水平比较 A组和B组血浆HMGB1、内皮素-1、sVCAM-1水平均明显高于健康组,且B组高于A组,差异均有统计学意义(P<0.05)。见表1。

表1 各组研究对象血浆HMGB1、内皮素-1、sVCAM-1水平比较
2.2 CCK8细胞活力检测结果 CCK8结果显示,随着血浆刺激浓度的增加,control组细胞活力无明显改变(P>0.05);当刺激浓度为10%、15%、20%时,LN组细胞活力明显下降(P<0.05),因此在后续的试验中选取10%作为刺激浓度。见图1。
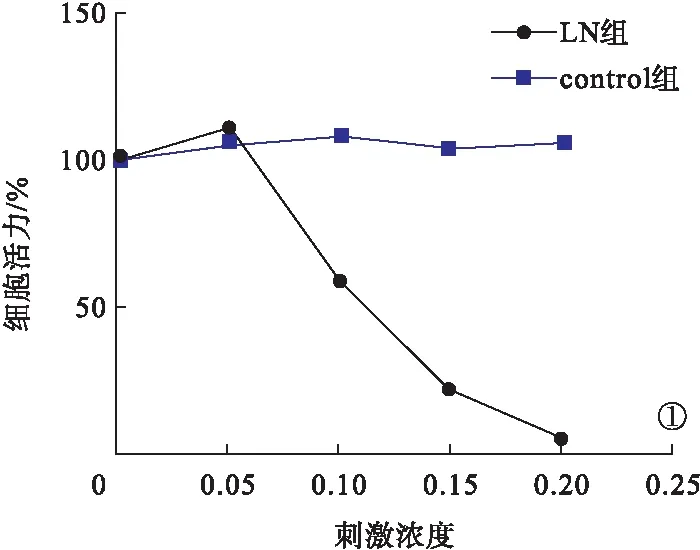
图1 CCK8细胞活力检测结果
2.3 SLE肾损伤血浆刺激HRGEC不同时间TEER值变化 LN组刺激12 h、18 h、24 h的TEER分别为(7.33±1.03)Ω·cm2、(6.15±1.18)Ω·cm2、(4.77±1.32)Ω·cm2,均显著低于control组的(11.23±0.58)Ω·cm2,差异有统计学意义(P<0.05)。LN组刺激6 h的TEER为(11.03±1.40)Ω·cm2,与control组比较,差异无统计学意义(P>0.05)。
2.4 SLE肾损伤血浆刺激HRGEC不同时间通透率变化 LN组刺激6 h时HRGEC的荧光通透率为(104.27%±6.59%),与control组的100.00%比较,差异无统计学意义(P>0.05)。LN组刺激12 h、18 h、24 h的通透率分别为(137.22%±14.88%)、(156.92%±14.28%)、(200.06%±10.08%),均显著高于control组,差异有统计学意义(P<0.05)。
2.5 SLE肾损伤血浆刺激HRGEC细胞间VE-cadherin表达结果 免疫荧光结果显示,control组VE-cadherin于细胞间紧密连接处连续表达,而LN组VE-cadherin的分布不连续,细胞间隙增大,部分VE-cadherin表达在细胞浆,提示细胞间紧密连接受损。见图2。
2.6 HMGB1中和抗体预处理后各组HRGEC细胞TEER值及荧光通透率变化 与control组比较,LN组的TEER值明显下降、荧光通透率明显增加,差异有统计学意义(P<0.05);与LN组比较,LN+H ab组TEER值明显升高、荧光通透率明显降低,差异有统计学意义(P<0.05)。见图3~4。

图2 免疫荧光检测HRGEC细胞膜上的VE-cadherin表达(a.control组;b.LN组;bar=25 μm) 图3 各组HRGEC细胞TEER值检测结果 图4 各组HRGEC细胞荧光通透率检测结果
2.7 HMGB1中和抗体预处理后各组HRGEC细胞间VE-cadherin表达 免疫荧光结果显示,LN+H ab组细胞间VE-cadherin的表达较LN组有所增加,提示细胞间紧密连接有所改善。见图5。

图5 免疫荧光显示各组HRGEC细胞间VE-cadherin表达的情况(a.control组;b.LN组;c.LN+H ab组;d.LN+IgG ab组;bar=25 μm)
3 讨论
HRGEC是一种高度分化的内皮细胞,位于GFB的最外层。GFB的屏障功能和完整性对于维持血管稳态至关重要,当内皮细胞受损,细胞间的紧密连接松散,细胞形态收缩,一些大分子物质如白蛋白从细胞旁漏出,导致肾小球毛细血管通透性增加,进而出现蛋白尿。有研究报道,SLE患者存在内皮细胞损伤,且SLE与动脉粥样硬化进展及心血管事件风险有关[7]。内皮素-1是一种由血管内皮细胞产生的高效内源性血管收缩肽,参与了慢性肾病的发生发展,且与SLE活动度有关[8-9]。sVCAM-1已被证实在LN患者的血清中明显升高,且与内皮细胞损伤有关[10]。本研究结果显示,A组和B组患者血浆内皮素-1、sVCAM-1水平均明显升高,且B组升高更为明显,提示SLE肾损伤患者存在更严重的内皮血管病变。此外,在体外试验中,笔者利用transwell小室构建HRGEC单层模型以模拟肾小球内皮屏障,以SLE肾损伤血浆刺激HRGEC,结果显示,HRGEC单层的跨细胞电阻降低、荧光通透率增加,细胞间VE-cadherin表达减少,细胞间紧密连接破坏,提示SLE肾损伤患者HRGEC单层的通透性增加。
HMGB1是高迁移率族蛋白家族成员,具有25 kda的分子量和2个带正电荷的核酸结合序列。细胞外的HMGB1作为一种损伤相关分子模式,会激活免疫系统并促进炎症发生[11]。有研究报道,活动性LN的SLE患者血液及尿液中HMGB1水平较健康者明显升高[12-13]。本研究结果显示,血浆HMGB1在SLE患者中明显升高。这提示,HMGB1可能在SLE肾损伤中发挥重要作用。HMGB1可以与TOLL样受体2和4结合,诱导肾小球系膜细胞的增殖[14-15],沉默HMGB1基因可以减少过敏性紫癜患儿血管内皮细胞凋亡,改善血管的通透性[16-18]。HMGB1可能参与了SLE肾血管内皮的病理过程[19-20]。为进一步探讨HMGB1在SLE肾损伤中对HRGEC单层通透性的影响,本研究应用HMGB1中和抗体预处理细胞,然后再给予SLE肾损伤血浆刺激,结果显示,HMGB1中和抗体部分逆转了HRGEC单层的跨膜电阻及荧光通透率,改善了细胞间VE-cadherin的表达。
综上所述,SLE患者血清中HMGB1水平明显升高,且存在肾损伤者更为明显,HMGB1中和抗体能够部分逆转HRGEC单层的通透性,改善细胞间的紧密连接,HMGB1可能参与了SLE的HRGEC损伤。
