基于肺癌放化疗前增强CT图像影像组学方法对非小细胞肺癌放化疗敏感性评估
2023-02-04刘大治卑贵光
辛 迪,刘大治,佟 晶,王 聪,卑贵光
北部战区总医院1.放射诊断科;2.胸外科,辽宁 沈阳 110016
全球癌症统计报告2020版数据库显示,全球新发癌症1 929万例,其中,肺癌占比11.4%;同年,全球约990万例癌症患者死亡,其中,肺癌占比18%[1-2]。因此需要更为精准的医疗手段对肺癌的分级分期、疗效及预后作出评估,以降低肺癌的发病率及病死率。近年来,功能与解剖相结合的成像模式,整合了可视化肿瘤生物学与高分辨率结构成像的优点,彻底改变了肿瘤患者的临床管理模式[3]。影像组学作为功能与解剖相结合的成像模式,是由计算机辅助诊断(computer aided diagnosis,CAD)发展而来,2012年由荷兰学者Lambin等[4]首次提出,介绍了关键技术和应用前景;Kumar等[5]进一步扩展了定义,并分析了工作流程中的各个步骤。本研究旨在探讨基于肺癌放化疗前增强CT图像的影像组学标签,结合相关临床信息,建立评估非小细胞肺癌(non small cell lung cancer,NSCLC)放化疗敏感性的数据模型,并评估模型的效能。现报道如下。
1 对象与方法
1.1 研究对象 回顾性分析自2010年11月至2019年12月北部战区总医院经病理证实为NSCLC,具有完整的放化疗前肺部增强CT影像数据的125例(共236个病灶)患者的临床资料,其中,男性97例,女性28例;年龄32~92岁,中位年龄61岁;病理类型:鳞癌72例,腺癌42例,未特指的NSCLC 11例。纳入标准:(1)治疗前均经穿刺活检或纤维支气管镜检病理证实为NSCLC或NSCLC术后复发;(2)在我院首次进行放化疗,治疗前未进行过其他任何治疗;(3)有完整的放化疗前影像数据资料。排除标准:(1)临床资料不全、离院或放弃治疗;(2)病灶过小或病灶实性成分过少导致纵隔窗显示不清;(3)图像质量欠佳(图像伪影),不能用于定量分析。本研究选择总生存期作为随访终点,总生存期定义为从患者接受治疗的日期起至死亡的日期或是最后1次随访日期(2020年3月25日)之间的差值。本研究经医院伦理委员会批准。所有研究对象均对本研究知情同意。
1.2 CT扫描方法 使用HD750 64层螺旋CT机(GE公司),双筒高压注射器,18G套管针,经肘前静脉以3.5 ml/s的速度注入生理盐水16 ml,再以相同的速度注入碘帕醇(270 mgI/ml)0.5~2.0 ml/kg,自动触发容积扫描,然后再以相同的速度注入生理盐水20 ml冲洗。管电压120 kV,自动毫安,矩阵512×512,将容积数据包上传至PACS工作站。
1.3 治疗方法 所有患者均参考肿瘤放射治疗组[6]及美国国立综合癌症网络[7]2020年发布的肿瘤临床实践指南,并对脊髓、臂丛神经、心脏/心包、食管、气管/支气管、皮肤和胸壁等正常器官进行保护及限量。鳞癌患者给予吉西他滨(1 000~1 250 mg/m2,第1、8天)加顺铂(75 mg/m2,第1天),化疗2个周期(21 d为1个周期);非鳞癌患者给予多西他赛(75 mg/m2或60 mg/m2,第1天)加顺铂(75 mg/m2,第1天),化疗2个周期。同步放疗1个周期,肿瘤区60~66 Gy、临床靶区50~54 Gy,每周第1至5天,连续治疗,共30次。
1.4 实体瘤疗效评价标准 根据实体瘤疗效评价标准1.1(response evaluation criteria in solid tumors 1.1,RECIST 1.1)单径测量法将疗效反应分为4级。其中,完全缓解:所有靶病变消失,任何病理性淋巴结(无论是非靶向淋巴结还是靶向淋巴结)必须短轴缩小至<1.0 cm。部分缓解:靶病变总直径减少≥30%。疾病进展:靶病变直径总和增加≥20%,总和还必须要求绝对增加≥0.5 cm(发现1个或多个新的病变也被认为是进展)。疾病稳定:在研究期间,以总直径为参考,既没有足够的减少符合部分缓解,也没有足够的增加符合疾病进展。把完全缓解和部分缓解归类于对放化疗敏感,疾病稳定和疾病进展归类于非敏感。
1.5 CT图像采集及分割 导出图像前将所有图像设置为统一的窗宽(400 HU)、窗位(40 HU),采用层厚5 mm的原始图像,将所有数据以DICOM格式从PACS系统导出,上传至Dr.Wise 1.6.2.1多模态科研平台(北京深睿博联科技有限责任公司,中国,以下简称Dr.Wise平台)。由两名拥有5年以上肺部影像诊断经验的放射科主治医师应用Dr.Wise平台,采用双盲法勾画病灶。由平台进行每一层面图像的自动分割,勾画出肿瘤的边界,两名医师分别审阅工作站分割的图像,并进行手动校正,勾画感兴趣区(region of interest,ROI),并避开囊变、钙化、血管及坏死区,得到每一层的ROI。为了评估影像组学特征的测量者间的一致性,进行测量者间一致性评价(interclass correlation coefficients,ICC),也是间接评估提取的影像组学特征的稳定性和可重复性。当ICC>0.75认为其一致性较好。CT图像选取ROI以及提取的相应图像标签见图1、2。
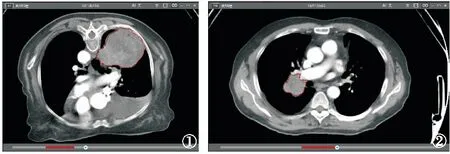
图1 女性患者,77岁,鳞状上皮异性增生癌变 图2 男性患者,56岁,右肺鳞癌
1.6 影像组学特征提取、筛选 采用Dr.Wise平台提取一致性较好的ROI图像标签,进行影像组学分析。通过经数据标准化的影像中提取组学特征,每个患者提取7类105个影像组学特征。
1.7 模型建立 以随机分配原则将患者按照1∶4比例分为验证组及训练组(每组各25例)。采用决策树(decision tree,DT)、支持向量机(support vector machine,SVM)、逻辑回归(logistic regression,LR)、随机森林(random forest,RF)、线性支持向量(liner support vector machine,LSVM)5种分类器方法建立模型。采用5折交叉验证法进行学习(图3)。

图3 5折交叉验证法
1.8 统计学方法 采用Medcalc 19.0.4统计学软件进行分析,加载相应的程序包和函数库进行计算。使用受试者工作特征(receiver operating characteristic,ROC)曲线分析各个分类器的预测效能,并分别计算其曲线下面积(area under curve,AUC)、准确度、灵敏度及特异度,并保留AUC最大且特异度较高的模型。分析评估模型的诊断性能。RECIST与最优预测效能的分类器统计采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 SVM模型提取的影像组学特征分析 为了降低提取的特征值之间的高度重复性,防止出现过拟合风险,需要对105个特征进行降维分析。首先进行单因素方差分析,然后采用基于方差分析的特征筛选(ANOVA F-value),具有显著性差异的特征被认为对于分类具有区分度,将被保留。最终筛选出一阶纹理特征、形状特征、灰度共生矩阵、灰度级区域大小矩阵、灰度相关矩阵、灰度行程矩阵6类影像组学特征。
2.2 基于影像组学特征建立的预测模型结果 5种分类器通过学习从肺增强CT图像中提取的特征值分别建立模型,对各自模型的训练组及验证组进行评价。用AUC、准确度、灵敏度及特异度对5种分类器的效能进行比较。基于肺增强CT图像上的影像组学特征所建立的模型,以SVM分类器下的AUC面积最高,评估放化疗敏感性的训练组准确度为0.90,灵敏度为0.82,特异度为0.74,AUC为0.90(95%可信区间:0.860~0.935)。验证组准确度为0.70,灵敏度为0.53,特异度为0.82,AUC为0.76(95%可信区间:0.700~0.824)。见表1、图4~6。

表1 基于肺CT图像建立5种分类器模型的ROC曲线分析结果

图4 5种分类器模型验证组ROC曲线 图5 SVM模型训练组ROC曲线 图6 SVM模型验证组ROC曲线
2.3 SVM模型与RECIST预测NSCLC放化疗敏感性结果比较 SVM模型与RECIST预测NSCLC放化疗敏感性的结果比较,差异无统计学意义(P>0.05),说明SVM模型与RECIST预测NSCLC放化疗敏感性的效能相仿。见表2。
3 讨论
NSCLC是最常见的肺癌类型之一,放化疗是NSCLC治疗的关键手段,主要目的是最大限度地控制肿瘤发展,同时尽量减少对患者正常组织的损伤,所以需要通过个体化治疗来提高治疗效果[8-9]。近年来,随着大数据和各种信息技术的发展,基于影像组学的大数据研究可以通过结合患者的临床信息来构建相应疾病模型,实现肿瘤的精准诊断,提高疗效评估和预后判断[10-11]。本研究基于肺癌放化疗前增强CT图像构建影像组学模型对NSCLC进行放化疗敏感性的评估,辅助临床医师制定个体化治疗方案,以降低不良结果的风险并提高患者的存活率。

表2 RECIST与SVM模型预测NSCLC放化疗敏感性的结果比较/例(百分率/%)
本研究结果显示,影像组学特征可以作为评估放化疗敏感性的指标,并且与传统指南(RECIST 1.1)对敏感性的预测效能相似。在RECIST 1.1指南中,肿瘤对治疗的反应是通过肿瘤大小的一维测量来衡量的。由于放化疗后肿瘤细胞代谢变化要比形态学变化早,而肿瘤细胞受抑制,解剖结构变化过程相对缓慢,很难被影像学检查发现。而影像组学分析所应用的数据是在治疗前采集,因此,相比于传统指南,影像组学可以实现治疗前的放化疗敏感性的评估,有望在制定NSCLC个体化治疗方案方面起到更大的作用。Corolle等[12]的研究表明,影像组学能够提供额外的表型信息,可以反映肿瘤对放化疗的敏感性,这与本研究结论相仿。Farchione等[13]研究发现,提取NSCLC患者放疗前增强CT图像的影像组学特征后所建立的模型,准确地预测了化疗后肿瘤的退缩情况。Yan等[14]认为,影像组学特征可以反映肿瘤细胞的放射敏感性。
在本研究中,5种分类器方法建立的模型最终依据AUC的差异,确定了SVM分类器法最优。SVM是Cortes和Vapnik于1995年提出的一种二分类模型[15]。SVM分类器被广泛地用于分类任务,因为,其设计不太容易过度拟合,即使在没有特征空间降维的情况下也能在一定程度上获得良好的泛化性能[16-17]。并且,SVM可以解决小样本下机器学习问题,对训练集之外数据的预测性能好、计算开销小、泛化错误率低,在二分类领域具有一定的优势。
本研究方向的影像组学研究还有很多价值。首先,影像组学特征建立的组学模型可以快速、无创地全面提取肿瘤内部的全部癌症特征信息、包括肿瘤内部的异质性[18],而通过活检从整个肿瘤提取一部分的生物样本反映的生物标记物信息是有限的。其次,相对于简单的肿瘤密度、大小指标,影像组学特征所建立的组学模型可以提供更加全面、详实的肿瘤信息,不仅可以反映整个肿瘤的生物学特性,还可以从定量影像中挖掘更多的信息并量化,为调整和定制个体化治疗方案提供更有价值的参考信息[19]。
影像组学在NSCLC治疗疗效评估中的前景可观,但在实践中仍有一些挑战。CT除了简单的描述性征象外,还包含了数量庞大的可深度探索的数字化信息。如果能够解码隐藏在影像图像中的因患者遗传变异、生理、细胞等多种因素共同决定的综合影像信息,并能定量化且客观的将其“内涵”呈现在临床诊断、治疗及预后评估分析的整个过程,这无疑会成为无创检测发展的革命,为临床医学带来重大意义[20]。
本研究存在一些局限性。首先,本研究是一项回顾性研究,所有患者均来自同一中心,还需要多中心、大规模及前瞻性的验证队列,以评估本研究提出模型的临床应用的潜力和通用性,并可以添加分子生物学标志物、基因表达特征等,将其纳入预测模型,从而为患者提供个性化的治疗方案。其次,本研究仅限于一个机构对肿瘤的描绘和验证,而不同机构的影像采集参数标准、图像组学特征提取和模型建立方法等方面都存在差异,导致临床结果评估可能存在差异[21]。
综上所述,SVM模型与RECIST预测NSCLC放化疗敏感性的效能相仿。基于NSCLC放化疗前增强CT图像获得的影像组学标签建立的影像组学模型对NSCLC放化疗敏感性的评估具有一定的应用价值。
