杜仲叶免疫调节机制的网络药理学分析及验证
2023-02-03崔恩慧薛玉环李辞霞朱晓岩柴学军赵善廷
崔恩慧,薛玉环,李辞霞,王 帅,朱晓岩,柴学军,赵善廷*
(1.西北农林科技大学动物医学院,杨凌 712100; 2.西安医学院基础医学部,西安 710021)
以往在畜牧业生产中,抗生素被广泛添加于动物饲料中,一方面防治疫病,另一方面作为生长促进剂以提高饲料转化效率和家畜生长性能,然而动物产品中的抗生素残留对人类健康构成了潜在威胁。加之目前国家饲料禁抗政策的实施,有必要开发既安全又高效的新型饲料添加剂替代品,取代抗生素来改善家畜健康和产品质量。
中药被公认为是提高动物生产性能和免疫力的良好饲料添加剂。杜仲(EucommiaulmoidesOliv.)是中国传统中药,资源丰富,应用广泛,其树皮、树叶、种子和花均可作为生产生物活性物质的原料[1],是我国农业农村部批准使用的饲料添加剂之一。近年来大量研究表明,杜仲叶也富含多种天然活性成分,如苯丙烷类、多糖、黄酮、环烯醚萜和木脂素[2-3],其化学成分与杜仲皮相似[4-6],二者药用功能基本一致,均具有补肝肾、强筋骨的功效,可用于治疗肝肾不足、腰膝酸痛等[7-9],在降血脂、降糖、抗菌消炎等方面杜仲叶或可代替杜仲皮使用[10]。同时,杜仲叶因其产量丰富、易得、易收集、生长周期快等特点而受到广泛关注。自2005年起,杜仲叶已正式载入《中国药典》,2018年被中华人民共和国国家卫生委员会列为药食同源物质试点名单,突出了其在食品和制药行业的开发潜力。一直以来,杜仲综合利用率很低,仅杜仲皮化学成分和药理研究较为广泛。因此,基于杜仲叶的优势,它在药理研究和饲料添加剂方面具有广阔的应用前景。虽然杜仲叶作为饲料添加剂的研究已经屡见不鲜,但是杜仲叶免疫调节的作用机制尚不清楚。本研究采用网络药理学和试验验证相结合的研究策略,探究杜仲叶的生物活性成分及其免疫调节作用机制,为其在饲料添加剂生产实践中的应用提供理论依据。
1 材料与方法
1.1 数据库及分析软件
中药系统药理学数据库及分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform, TCMSP, https://old.tcmsp-e.com/tcmsp.php),Uniprot数据库(https://www.uniprot.org/), 人类孟德尔遗传综合数据库OMIM(https://www. omim.org/), GeneCards综合数据库(https://www.genecards.org/), Swiss Target Prediction数据库 (http://www.swi sstargetprediction.ch/), String11.5(https://cn.string-db.org/), Cytoscape软件(3.8.2)。
1.2 药物活性成分的筛选
通过TCMSP数据库检索并结合文献收集,以口服生物利用度(OB≥30%)、类药性(DL≥0.18)为限定条件筛选杜仲叶有效化学成分,并根据已发表的文献报道补充未预测到的活性化合物的已知靶点,剔除没有靶基因的活性成分,然后通过Uniprot 数据库和Swiss Target Prediction数据库获得基因名。
1.3 疾病靶点筛选
在GeneCards和OMIM 数据库搜索框中输入“immune dysregulation”,收集与免疫失调相关的靶点基因,将挖掘得到的免疫失调相关基因与杜仲叶靶点基因筛选出交集基因并以维恩图形式表示,得到杜仲叶免疫调节的作用靶点。
1.4 蛋白质-蛋白质互作网络构建
通过String平台构建上述交集基因的PPI,将蛋白种类设置为“Homosapiens”,最低相互作用阈值设为“medium”(0.400),其它保持默认数值。将Tsv文件导入Cytoscape3.8.2软件绘制蛋白相互作用网络,利用插件CytoNCA进行网络拓扑学分析,计算每个节点的打分,筛选打分较高的节点再次构建网络,从而得出杜仲叶免疫调节PPI 网络中的核心靶点。使用R (3.6.3版本)进行GO功能富集分析和KEGG富集分析。
1.5 细胞体外试验验证
1.5.1 主要仪器与试剂 细胞培养箱(SANYO,MCO-18AIC),低温离心机(Sigma,1-14K),多功能酶标仪(Thermo,Varioskan LUX),DMEM(Gibco,10313021),胎牛血清(Gibco,10091148),青链霉素混合液(Solarbio,P1400),二甲基亚砜(DMSO)、中性红分析纯(天津市科密欧化学试剂有限公司);环磷酰胺(Solarbio, SC5540),杜仲叶提取物(陕西瑞林帕尼尔生物科技有限公司提供)。
1.5.2 腹腔巨噬细胞的制备 小鼠处死后,腹腔注射10 mL PBS收集巨噬细胞,加入高糖DMEM培养液(含10%热灭活胎牛血清,1%青霉素-链霉素)适量,调整细胞密度为2×106个·mL-1的单细胞悬液后加入96孔板,置于37 ℃ 5% CO2培养箱中培养。
1.5.3 巨噬细胞的增殖能力 将巨噬细胞(2×106细胞·mL-1) 加入96孔板,100 μL·孔-1,试验分组为空白对照组(巨噬细胞+培养液)、各浓度药物组(1 000、2 000、3 000、4 000、5 000、6 000、7 000、8 000、9 000、10 000 μg·mL-1杜仲叶提取物+巨噬细胞),37 ℃,5% CO2培养箱培养40 h,然后每孔加入20 μL MTT,继续培养4 h后再加入100 μL DMSO,用酶标仪在570 nm处测定各孔吸光度。
1.5.4 巨噬细胞的吞噬能力 每孔加入各浓度(1 000、2 000、3 000、4 000、5 000、6 000、7 000、8 000、9 000、10 000 μg·mL-1)杜仲叶提取物100 μL,每个药物浓度重复5孔,另设 LPS 对照组(LPS+巨噬细胞+培养基)和空白对照组(巨噬细胞+培养液)。37 ℃,5% CO2培养箱培养48 h,0.09%中性红染色4 h,然后用PBS溶液洗涤3次,去除多余的中性红,每孔加入100 μL DMSO 静置过夜,在酶标仪570 nm处读取吸光度。
1.6 体内试验
1.6.1 试验材料 杜仲叶水提物:由陕西瑞林帕尼尔生物科技有限公司生产提供,生产批号RP20210723;环磷酰胺:购自北京索莱宝。
SPF级雄性ICR小鼠60只,6~8周龄,购于西安交通大学医学部实验动物中心[SCXK(陕)2018-001]。小鼠饲养于西北农林科技大学神经生物学实验室,温度控制在(23±1)℃,相对湿度为50%~60%,试验期间动物自由进食和饮水。
1.6.2 动物分组 小鼠自由进食和饮水适应一周后,用苦味酸标记,随机分为:正常组、模型组、杜仲叶治疗组,每组8只。模型组和杜仲叶治疗组连续7 d腹腔注射70 mg·kg-1环磷酰胺,建立免疫抑制模型,正常组注射生理盐水。然后分别灌胃21 d不同物质:正常组和模型组灌胃生理盐水,杜仲叶治疗组灌胃1.6 g·kg-1杜仲叶提取物。
1.6.3 测量胸腺和脾脏指数 小鼠处死后,将免疫器官胸腺和脾通过手术分离并称重,用生理盐水温和漂洗干净,再用滤纸吸取表面水分后称重,并以小鼠处死前体重为基准计算相应的脾脏和胸腺指数。免疫器官指数以免疫器官重量(mg)/体重(g)表示。
1.6.4 外周血白细胞和淋巴细胞的检测 小鼠眼球采血,注入无菌的EDTA抗凝管中,采用迈瑞兽用全自动血液细胞分析仪进行计数。每组检测8个重复样本。
1.6.5 杜仲叶提取物对小鼠碳廓清能力的影响 小鼠经尾静脉注射稀释4倍的印度墨水100 μL。在2 min (tA)和10 min (tB)时间点,取眶后静脉血样,20 μL样品与2 mL 0.1% Na2CO3混合。测量每个样品在600 nm处的吸光度(tA为ODA, tB为ODB)。吞噬指数(α)计算如下:
廓清指数K=(lgODA-lgODB)/(tA-tB)
吞噬指数α=K(1/3)×WB/(WL+WS)
其中WB、WS、WL分别为体重、肝重、脾重。
1.6.6 杜仲叶提取物对小鼠迟发型超敏反应(DTH)的影响 DTH是评价细胞免疫功能的一种方法。第1天腹腔注射环磷酰胺(CTX)后,小鼠腹部剃毛3 cm×3 cm,涂抹5%DNCB的丙酮-麻油溶液20 μL·只-1致敏。5 d后将5%二硝基氟苯10 μL均匀涂于小鼠右耳两侧进行第二次致敏。24 h后处死小鼠,取下8 mm耳片称重,通过左右耳重量的变化来评价DTH的程度。
2 结 果
2.1 杜仲叶活性成分和靶基因的筛选
以OB≥30%,DL≥0.18作为筛选条件,通过TCMSP数据库并结合已发表文献,补充不符合筛选条件,但为药物主要功效成分的化合物绿原酸,作为最终活性化合物,包括山奈酚、儿茶素、槲皮素、绿原酸,排除无对应靶点的活性成分儿茶素(MOL000492),共得到3种潜在活性成分。同时通过Uniprot 数据库和Swiss Target Prediction数据库共筛选出306个靶点基因,见图1和表1。
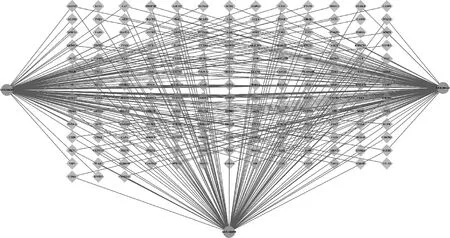
图1 杜仲叶化学成分-靶点网络图Fig.1 Compound-target network of Eucommia ulmoides leaf
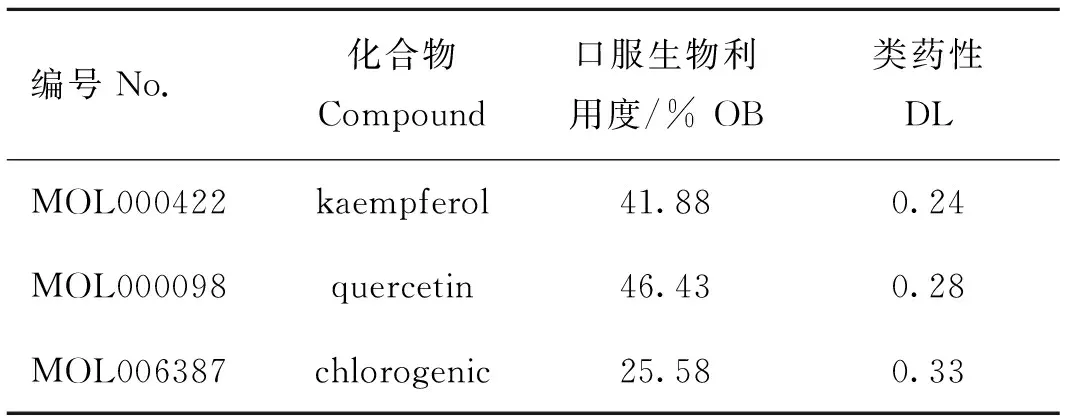
表1 杜仲叶的活性成分及参数Table 1 Active ingredients and parameters of Eucommia ulmoides leaf
2.2 杜仲叶和免疫调节交集基因的筛选
利用GeneCards和OMIM 数据库获得免疫调节相关靶点1 107个,建立了疾病靶点数据集。通过R软件取杜仲叶靶点和免疫调节靶点交集,共得到105个既与杜仲叶潜在活性化合物相关又与免疫调节相关的基因,见图2。
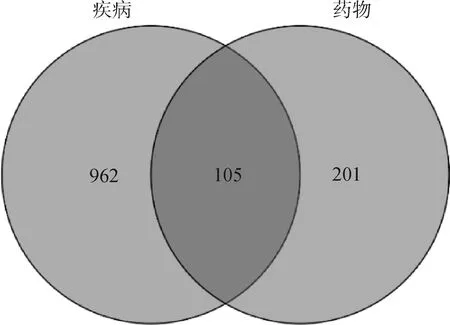
图2 药物与疾病的交集基因Fig.2 Intersection of drug genes and disease targets
2.3 杜仲叶和免疫调节核心蛋白相互作用网络
将105个交集基因经STRING进行分析,构建蛋白互作网络,见图3。通过网络拓扑分析进一步筛选核心靶点,筛选条件为连接度(Degree)、介度(Betweenness)、紧密度(Closeness),最终获得21个核心靶点,见图4。
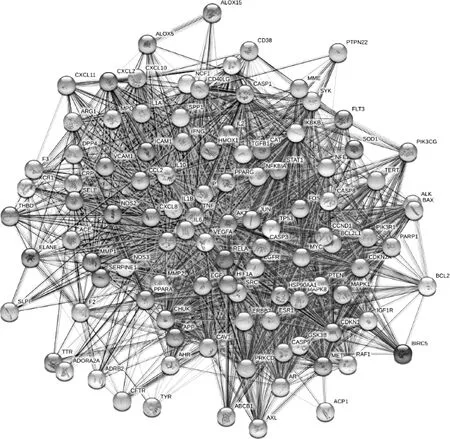
图3 杜仲叶-免疫调节靶点PPI网络Fig.3 PPI network of targets related to the treatment of immune dysregulation with ELE
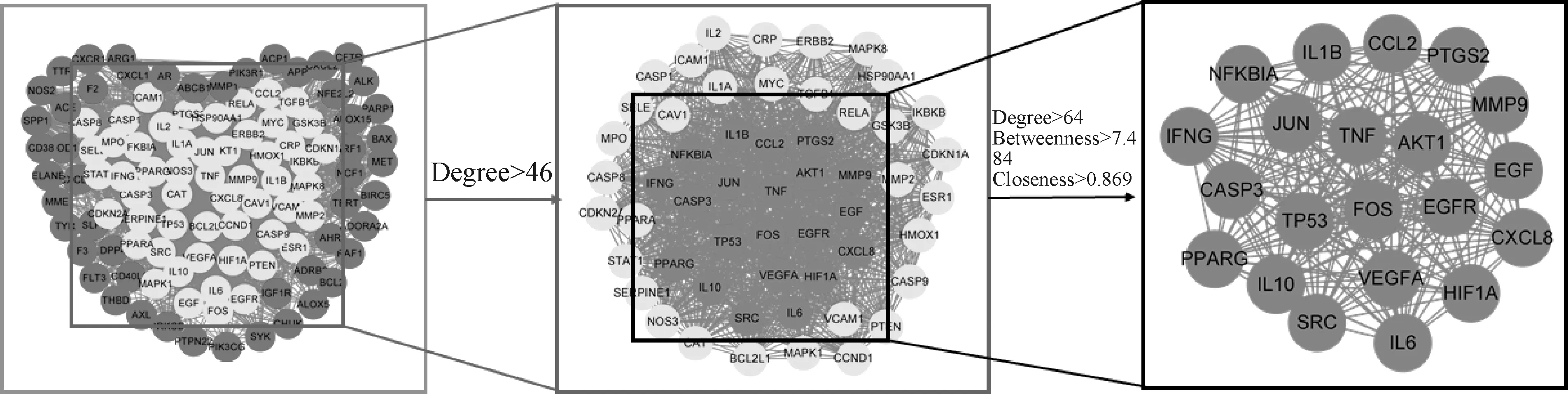
图4 PPI网络拓扑分析核心靶点Fig.4 Key target of PPI network topology analysis
2.4 杜仲叶和免疫调节GO功能富集分析和KEGG富集分析
对核心靶点进行GO富集分析,确定GO条目共2 342 个,包括2 218条生物学过程(biological process, BP),主要涉及脂多糖反应、细菌源性分子反应、氧化应激反应、平滑肌细胞增殖调控、细胞对氧化应激的调控、神经炎症反应等;13条细胞成分(cell component,CC),与RNA聚合酶II转录因子复合物、核转录因子、膜筏、膜微区、转录因子复合物、血小板α颗粒腔等相关;111条分子功能(molecular function,MF),包括细胞因子受体结合、细胞因子活性、受体配体活性、生长因子受体结合、泛素蛋白连接酶结合等,见图5。KEGG富集到135条通路,主要涉及IL-17信号通路、肿瘤坏死因子信号通路、人巨细胞病毒感染、卡波西肉瘤相关疱疹病毒感染、耶尔森菌感染、流体剪切应力与动脉粥样硬化、乙型肝炎、MAPK信号通路等,见图6。
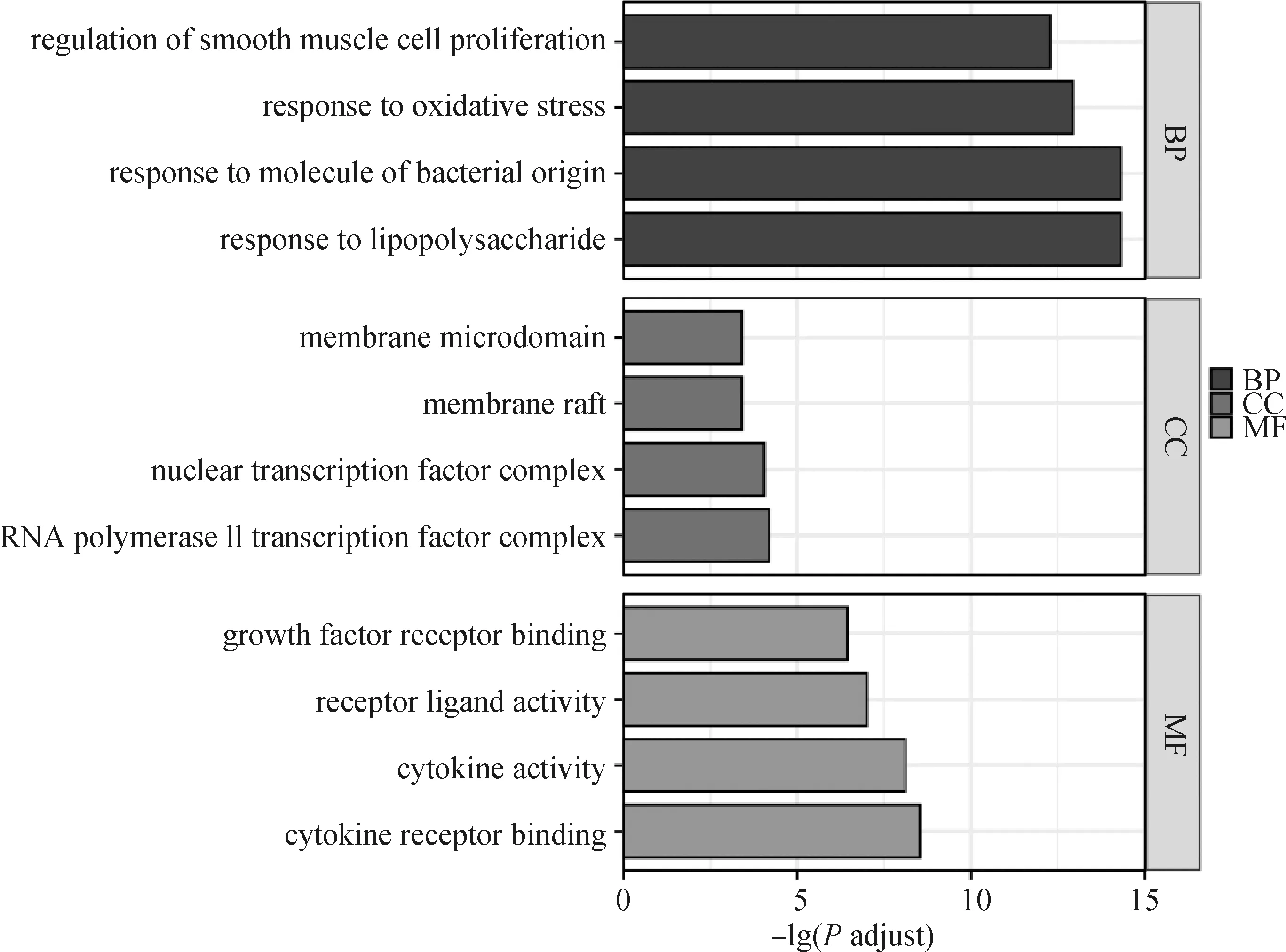
图5 交集靶点GO 富集分析Fig.5 GO enrichment analysis of key targets
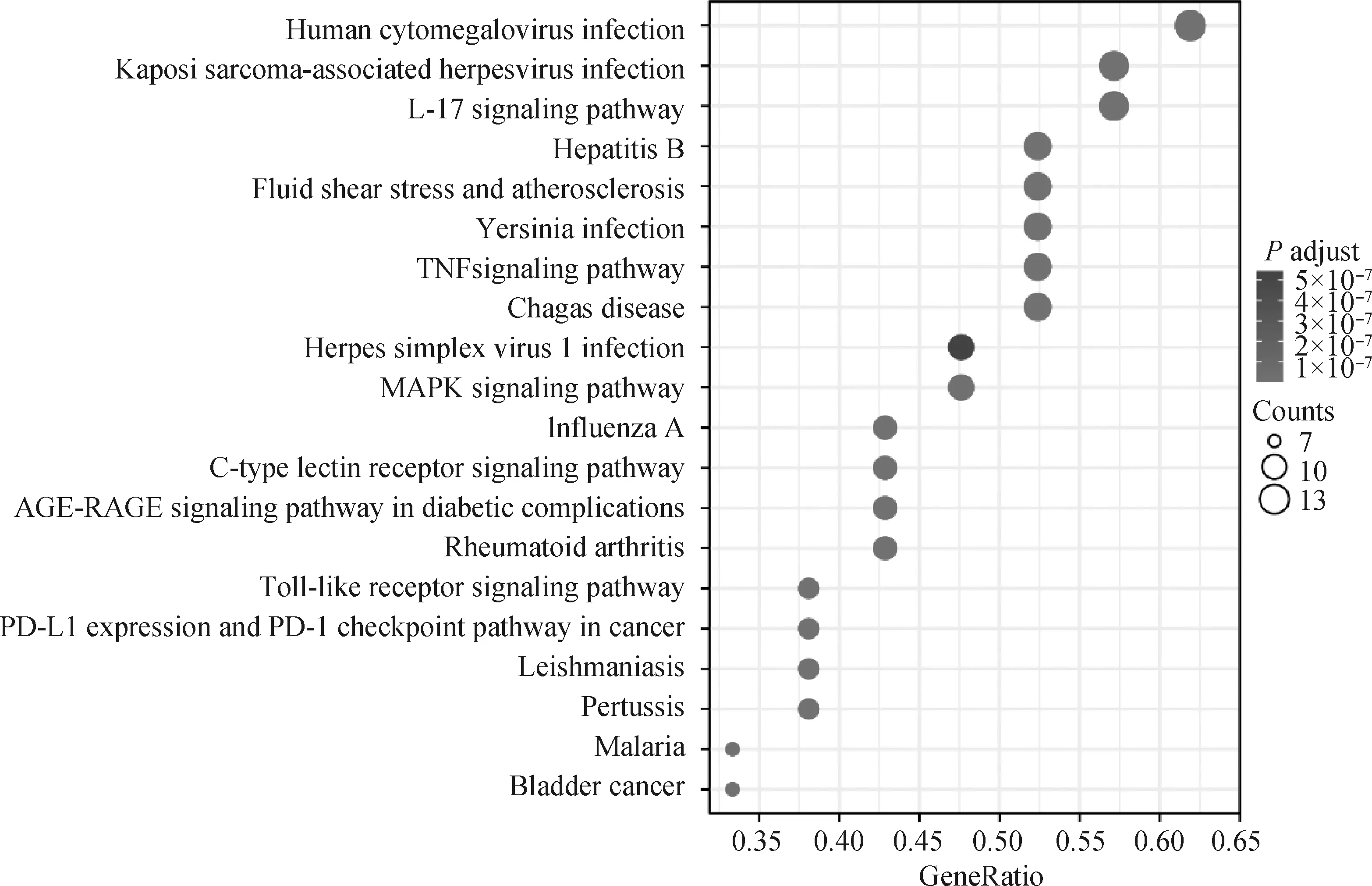
图6 核心靶点KEGG通路富集分析Fig.6 KEGG pathway enrichment analysis of key targets
2.5 腹腔巨噬细胞试验验证
2.5.1 杜仲叶提取物对巨噬细胞增殖的影响 按照不同浓度杜仲叶提取物处理巨噬细胞后,发现与空白对照组相比,10 000 μg·mL-1浓度的OD值显著降低(P<0.05),说明此浓度抑制细胞生长,对细胞有毒性;6 000~9 000 μg·mL-1浓度处理的巨噬细胞与空白对照组相比差异不显著(P>0.05),说明这几个药物浓度对细胞没有毒性作用,对细胞活力无显著影响;2 000~5 000 μg·mL-1浓度处理的巨噬细胞与空白对照组相比OD值显著性升高(P<0.01),说明这几个浓度均能促进细胞生长,且随着浓度增加细胞增殖越明显,具有一定剂量依赖性(图7)。
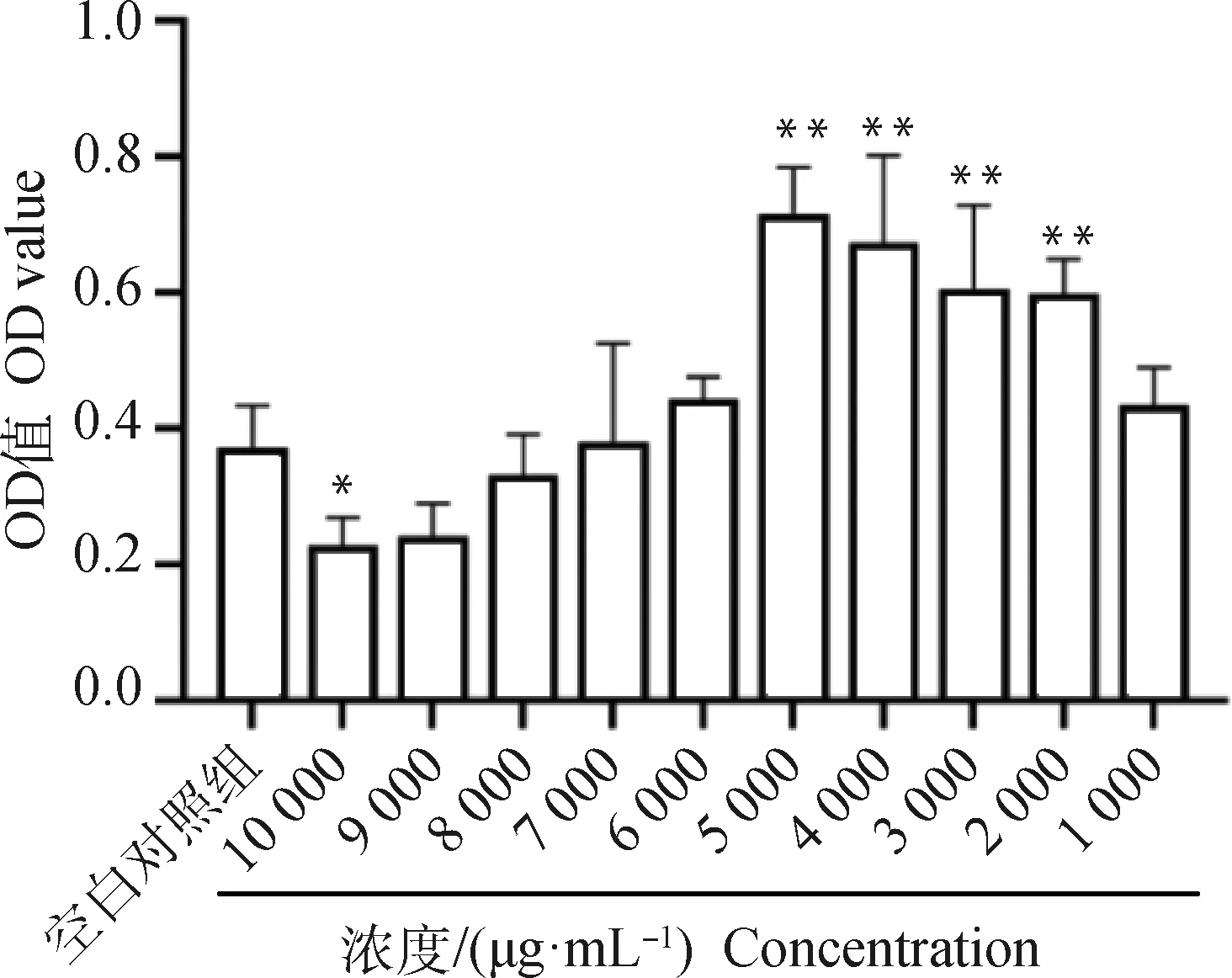
与空白对照组比较,**P<0.01, *P<0.05Compared with the blank control group, **P<0.01, *P<0.05图7 杜仲叶对小鼠巨噬细胞增殖的影响Fig.7 The influence of Eucommia ulmoides leaf in macrophage proliferation of mice
2.5.2 杜仲叶提取物对巨噬细胞吞噬功能的影响 LPS组OD值大于空白对照组,差异极显著(P<0.01),说明LPS能促进巨噬细胞吞噬作用。3 000、4 000、5 000 μg·mL-1浓度的杜仲叶与LPS相比差异极显著(P<0.01),2 000 μg·mL-1浓度的杜仲叶与LPS相比差异显著(P<0.05),说明这4个浓度促进巨噬细胞吞噬能力大于LPS,1 000 μg·mL-1浓度的杜仲叶与LPS相比差异不显著(P>0.05),但是1 000~5 000 μg·mL-1浓度的杜仲叶与空白对照组相比差异都是极显著(P<0.01),说明这5个浓度均能显著促进巨噬细胞吞噬能力(图8)。
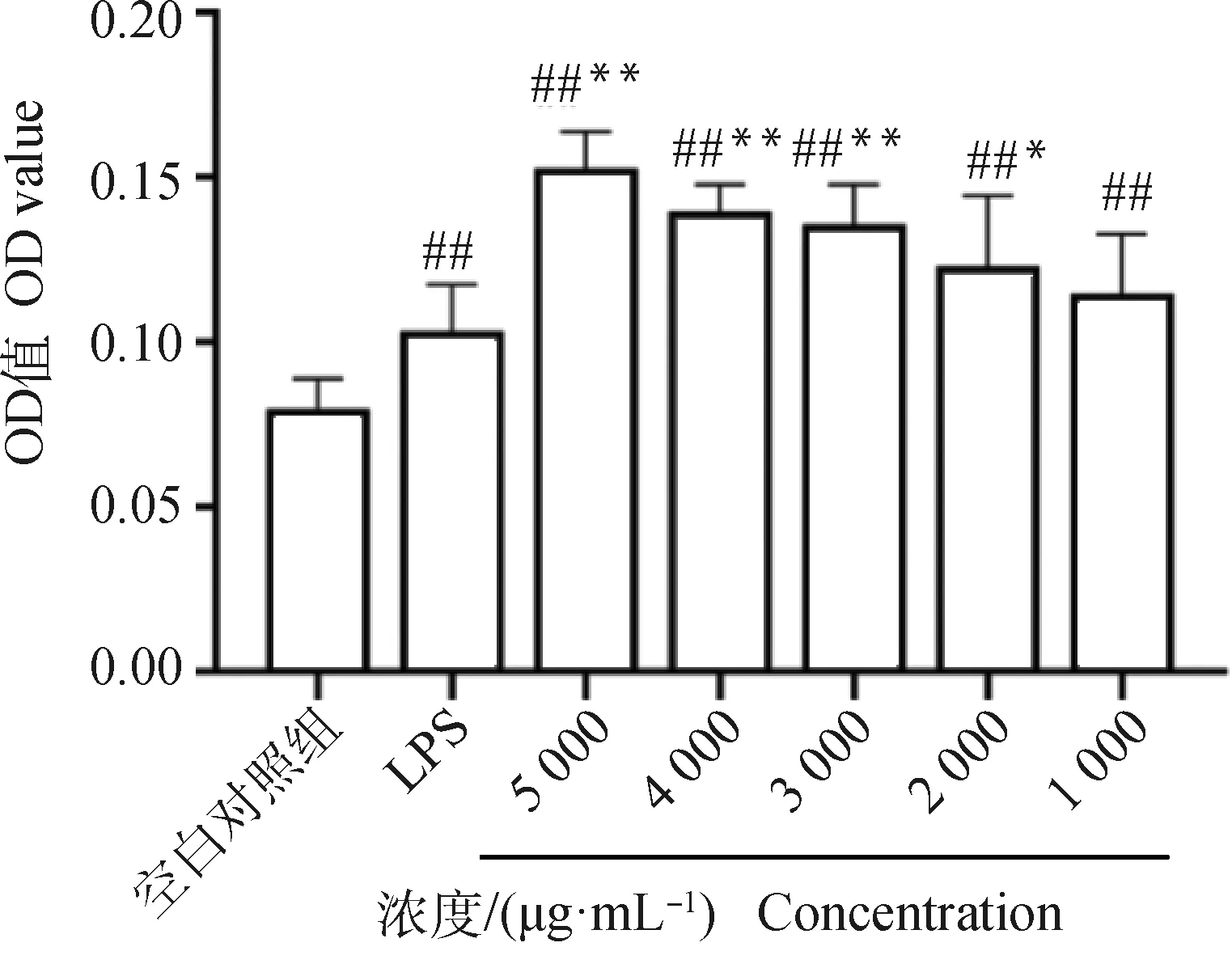
与空白对照比较,##P<0.01;与LPS组比较*P<0.05,**P<0.01Compared with blank control group, ##P<0.01; Compared with LPS group, *P<0.05,**P<0.01图8 杜仲叶对小鼠巨噬细胞吞噬功能的影响Fig.8 The influence of Eucommia ulmoides leaf in macrophage phagocytosis of mice
2.6 体内试验
2.6.1 小鼠体重的变化 腹腔注射环磷酰胺造模后小鼠精神不佳,食欲下降,毛色暗,说明造模成功。各组小鼠体重变化见表2。在注射环磷酰胺之前,各组小鼠体重无差异(P>0.05),第1~7天连续注射环磷酰胺7 d构建免疫抑制模型,模型组和杜仲叶组体重显著下降(P<0.05)。第8天治疗组开始灌胃杜仲叶提取物,试验结束后,模型组和杜仲叶治疗组之间无显著差异,但是有升高趋势,说明杜仲叶对小鼠体重有积极作用。
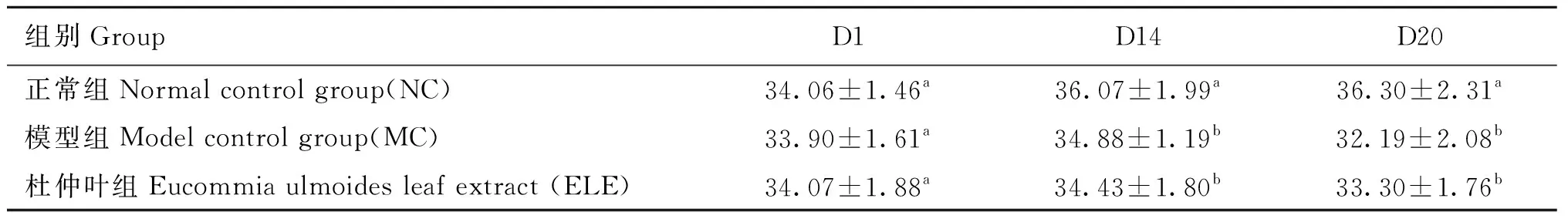
表2 小鼠体重变化Table 2 Change in mice body weight g
2.6.2 杜仲叶提取物对免疫器官的影响 如图9所示,模型组小鼠脾脏指数、胸腺指数均较正常对照组显著降低(P<0.05)。同时,与模型组相比,杜仲叶治疗组小鼠脾脏指数显著增加(P<0.05),胸腺指数也有增加。这表明,杜仲叶可以一定程度上抵抗环磷酰胺诱导的免疫抑制。
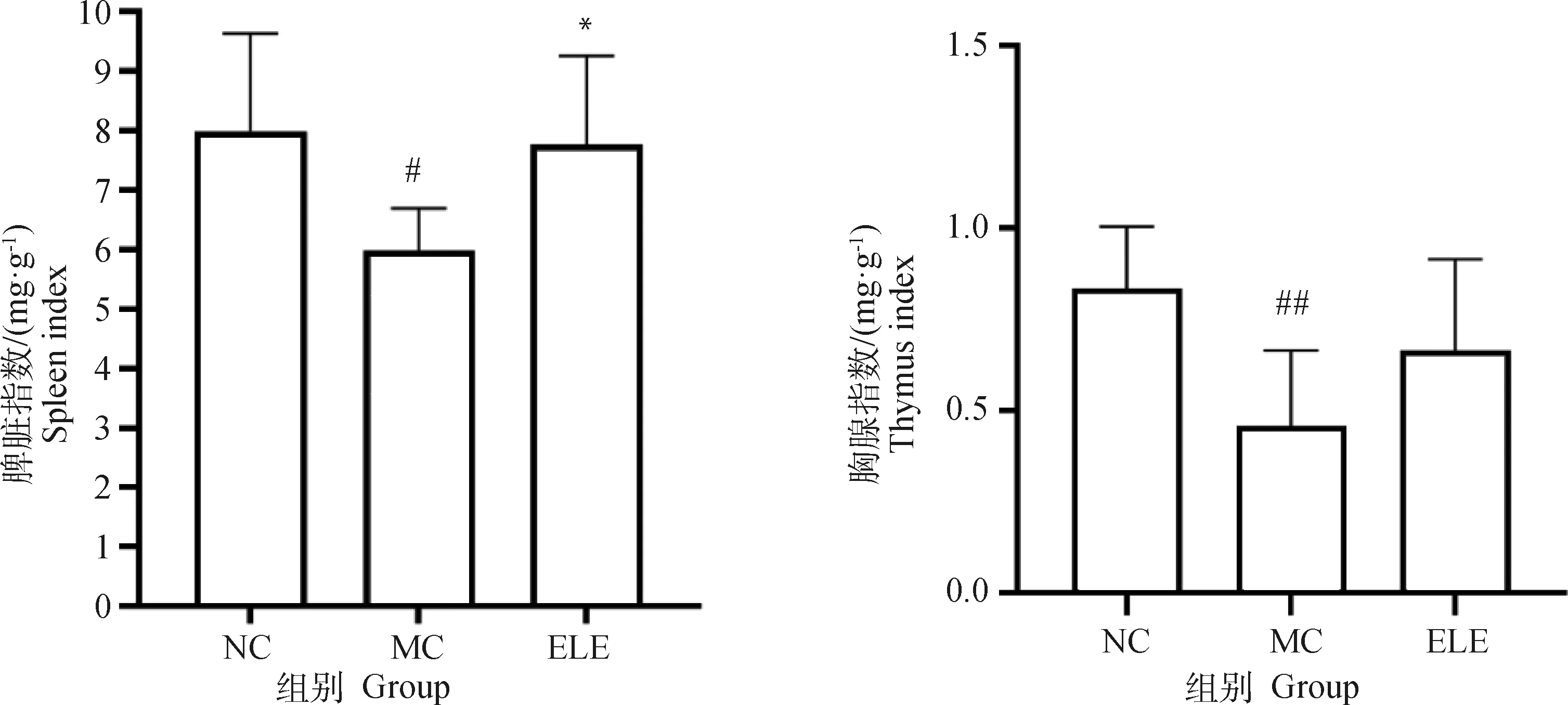
NC. 正常对照组;MC. 模型组;ELE. 杜仲叶提取物组。与正常对照比较,#P<0.05, ##P<0.01;与模型组比较,*P<0.05。下同NC. Normal control group; MC. Model control group; ELE. Eucommia ulmoides leaf extract group. Compared with blank control group, #P<0.05, ##P<0.01; *Compared with MC group, *P<0.05, **P<0.01. The same as below图9 小鼠免疫器官指数Fig.9 Immune organ indexes of mice
2.6.3 杜仲叶提取物对血常规的影响 如表3所示,与正常对照组相比,模型组小鼠外周血白细胞(WBC)、红细胞(RBC)、和血红蛋白(HGB)均显著下降(P<0.05)。杜仲叶治疗组小鼠血液中WBC含量显著高于模型组(P<0.05),RBC、HGB含量高于模型组但差异不显著,说明杜仲叶可促进小鼠白细胞、红细胞的生成。

表3 对小鼠血液指标的影响Table 3 Effects on blood routine index in mice
2.6.4 杜仲叶提取物对小鼠碳廓清能力的影响 单核细胞的吞噬作用可以通过碳廓清试验来评估见图10。与正常对照组相比,模型组小鼠吞噬指数(α)显著降低(P<0.05)。与模型组比较,杜仲叶治疗组能显著提高小鼠的吞噬指数(α)(P<0.05)。结果表明,杜仲叶能提高免疫抑制小鼠的碳清除能力。
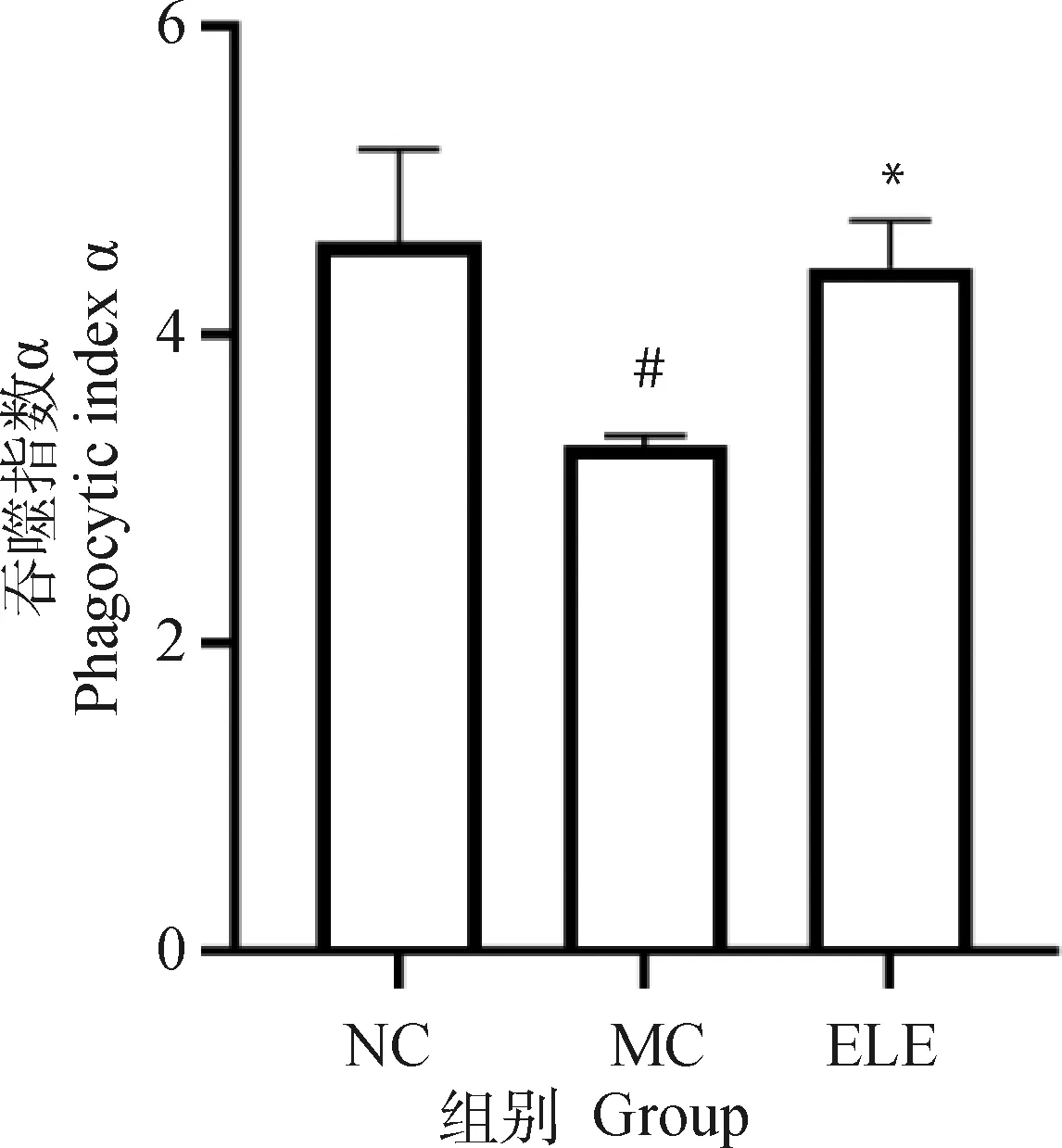
图10 小鼠吞噬指数αFig.10 Phagocytic index α of mice
2.6.5 杜仲叶提取物对小鼠DTH超敏反应的影响 耳廓肿胀表明DTH反应的强度,这是由参与细胞免疫的T细胞介导的。如图11所示,与正常组比较,模型组耳廓肿胀明显减轻(P<0.01),说明DNFB诱导的DTH模型建立成功。与模型组比较,杜仲叶能有效增加小鼠耳廓肿胀(P<0.01),说明杜仲叶能增强环磷酰胺处理小鼠的DTH反应。结果表明,杜仲叶的免疫调节活性可能与细胞免疫有关。
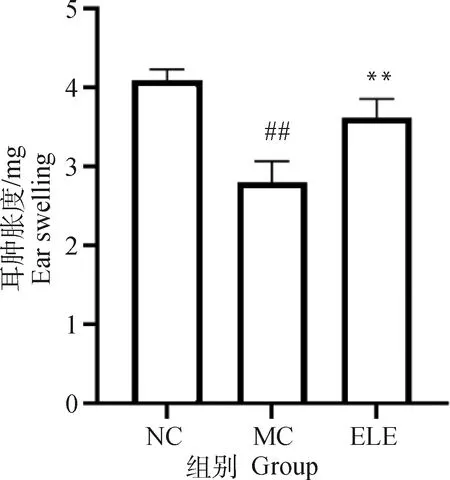
图11 小鼠DTH耳肿胀度Fig.11 Ear swelling in DTH of mice
3 讨 论
杜仲叶提取物和活性成分可以增强动物的机体免疫力。杜仲叶乙醇提取物能显著增强小鼠免疫力[11],绿原酸是杜仲叶中主要有效成分之一,具有提高犬抗氧化能力和体液免疫的功能[12]。杜仲叶及其提取物如绿原酸、黄酮等对养殖动物的生长性能、免疫、肉质及抗氧化能力等方面也具有促进作用[13-16]。
本研究基于网络药理学方法分析了杜仲叶在免疫失调中起调节作用的活性成分、药物靶点和关键途径。结果显示,杜仲叶免疫调节的主要化合物为山奈酚、槲皮素、绿原酸,这些有效成分主要作用于TNF、IL-6、VEGFA、IL-1β等关键靶点,然后通过IL-17信号通路、肿瘤坏死因子信号通路、MAPK信号通路等发挥免疫调节作用。
随后,本研究对杜仲叶免疫调节作用进行了体内、体外试验验证。体外试验研究了杜仲叶水提物对小鼠腹腔巨噬细胞增殖及对巨噬细胞吞噬功能的影响,发现杜仲叶提取物在1 000~5 000 μg·mL-1剂量范围内能够促进小鼠腹腔巨噬细胞增殖和细胞吞噬作用。
体内试验通过环磷酰胺诱导的免疫抑制模型研究了杜仲叶对免疫抑制的影响。环磷酰胺作为一种有效的免疫抑制剂,可影响机体的免疫系统并诱导免疫功能失衡,表现为体重、免疫器官指标和免疫球蛋白的下降[17-19]。本研究中,与正常对照组相比,模型组小鼠的脾脏指数、胸腺指数、巨噬细胞吞噬活性均显著降低,WBC、RBC和HGB也明显下降。以上结果表明,试验小鼠处于免疫抑制状态,说明免疫抑制小鼠模型是成功的。
体重是小鼠生长状况的指标,可以反映环磷酰胺诱导小鼠的免疫状态[20-21]。本试验中,杜仲叶可以改善环磷酰胺引起的机体损伤并一定程度恢复小鼠体重。免疫系统由免疫分子、免疫细胞和免疫器官组成。胸腺和脾是免疫系统的重要器官,它们的器官指数可以反映免疫功能和预后。与模型组相比,杜仲叶治疗组小鼠的胸腺和脾脏指数显著增加,减轻了环磷酰胺诱导的免疫抑制。
WBC、RBC和HGB等临床血液参数是监测化疗不良反应的常规标志物[22]。WBC由粒细胞(中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)、单核细胞和淋巴细胞组成。WBC计数是免疫激活和可能感染的生物标志物[23]。RBC在支持组织代谢方面发挥重要作用。高效的红细胞是维持组织氧合和酸碱平衡所必需的[24]。红细胞能够与内皮细胞、血小板和巨噬细胞相互作用,参与维持血栓形成和止血,在免疫反应中发挥重要作用[25]。红细胞中的HGB负责人体内氧气的运输。环磷酰胺可以影响骨髓的造血功能,导致外周血WBC、RBC、HGB等减少[26]。杜仲叶可以恢复外周血WBC、RBC和HGB的计数。说明杜仲叶能促进环磷酰胺诱导的免疫抑制小鼠造血功能恢复,这可能与促进骨髓造血功能有关。
巨噬细胞可以通过先天免疫作用进行吞噬[27]。杜仲叶治疗组吞噬指数(α)增加表明,杜仲叶可以增强巨噬细胞的吞噬能力。DNFB诱导的DTH是一种由T淋巴细胞介导的细胞免疫,其特点是非特异性炎症细胞的高度聚集[28]。本研究中,杜仲叶提取物可以通过增加小鼠耳部肿胀来增强 DTH。该结果表明杜仲叶可能在细胞免疫反应中发挥作用。
4 结 论
本研究通过网络药理学预测杜仲叶免疫调节的作用机制,并结合体外、体内试验验证了杜仲叶的免疫调节作用,对其免疫调节的机制做了初步探讨,为杜仲叶作为饲料添加剂的开发提供理论依据。
